GST-NRP-1融合蛋白的原核表达及纯化①
韩正祥 张梦瑾 徐 杰 王红梅 杜秀平 陈 翀 徐开林(徐州医学院附属医院肿瘤科,徐州221002)
GST-NRP-1融合蛋白的原核表达及纯化①
韩正祥张梦瑾徐杰王红梅杜秀平陈翀徐开林②
(徐州医学院附属医院肿瘤科,徐州221002)
[摘要]目的:构建带有GST标签的人NRP-1融合蛋白原核表达载体,在大肠埃希菌(E.coli)中诱导其表达,并进行包涵体的复性及纯化。方法:利用RT-PCR扩增人NRP-1基因,将其克隆至pCR-blunt载体,酶切制备NRP-1基因片段,插入表达载体pGEX-4T-1,生成pGEX-4T-1-NRP-1,转入BL21感受态细胞以IPTG诱导其蛋白的表达。裂解细菌后行Western blot检测GST-NRP-1融合蛋白的表达,表达的包涵体经复性后用Glutathione Sepharose 4B纯化。结果: RT-PCR扩增出NRP-1基因并连入pCR-blunt载体;经亚克隆构建了融合蛋白表达载体pGEX-4T-1-NRP-1。转入BL21感受态细胞后考马斯亮蓝染色检测到GST-NRP-1融合蛋白的表达,经包涵体复性后得到纯化的融合蛋白。结论:成功构建带有GST标签的人NRP-1融合蛋白原核表达载体,为进一步研究NRP-1的结构、功能及其与之相互作用的蛋白奠定了基础。
[关键词]NRP-1;原核表达;融合蛋白;纯化
①本文受国家自然科学基金(No.30901753)和江苏省“六大人才高峰”B类项目资助(No.2014-WSW-040)。
②徐州医学院附属医院血液科,徐州221002。
Prokaryotic expression and purification of GST-NRP-1 fusion protein
HAN Zheng-Xiang,ZHANG Meng-Jin,XU Jie,WANG Hong-Mei,DU Xiu-Ping,CHEN Chong,XU Kai-Lin.Department of Oncology,the Affiliated Hospital of Xuzhou Medical College,Xuzhou 221002,China
[Abstract]Objective: To construct GST-tagged human NRP-1 fusion protein expression vector and induce its expression in Escherichia coli (E.coli),then carry on inclusion body refolding and purification so as to obtain GST-NRP-1 fusion protein.Methods: NRP-1 gene was amplified by RT-PCR and inserted into pCR-blunt vector.Then the reconstructed plasmid was inserted into prokaryotic expression vector pGEX-4T-1.The constructed pGEX-4T-1-NRP-1 expression vector was transformed into BL21 cells and induced by isopropyl-β-D-thiogalactoside (IPTG) .Bacterial bodies were disrupted by sonication.Then the soluble fraction of fusion proteins were verified by Western blot and purified by Glutathione Sepharose 4B after inclusion body refolding.Results: The NRP-1 gene fragment was amplified by RT-PCR and inserted into pCR-blunt vector.Fusion protein expression vector pGEX-4T-1-NRP-1 was constructed successfully.After transformation,GST-NRP-1 expression vector was detected in BL21 cells and obtained purifying protein after refolding.Conclusion: The plasmid GST-NRP-1 was constructed successfully and laid basis for subsequent studies.
[Key words]NRP-1; Prokaryotic expression; Fusion protein; Purification
Neuropilins(NRPs)是一种跨膜糖蛋白受体,由含860个氨基酸组成的细胞外结构域、23个氨基酸组成的跨膜结构域以及40个氨基酸组成的细胞内结构域共同组成。NRPs最初被发现是作为semaphorin的受体,调节神经细胞和轴突的生长[1]。后来研究证实,作为VEGF的共受体,NRPs可以和VEGFR通过NRP的PDZ结合域形成NRP1-VEGFR复合受体,进而强化VEGF的血管生成作用[2];因NRP-1的胞内区短小,一般认为自身无信号转导功能。但近来Wang等[3]通过对NRP-1的跨膜结构域和胞内结构域的研究,证实NRP-1能单独介导VEGF诱导的内皮细胞迁移,并且胞内结构域中C末端的三个氨基酸在此功能中发挥重要作用。这提示NRP-1具有信号转导调控功能,但NRP-1通过何种机制调控其下游信号仍有待进一步确定。蛋白质组学手段是研究NRP-1与其偶联的接头蛋白相互作用,进而探索NRP-1作用机制的有效方法。GST-pulldown-质谱分析是捕捉和鉴定蛋白质间相互作用的高效手段。本研究探讨和优化了GST-NRP-1融合蛋白的制备流程,为蛋白质组学水平上解析NRP-1的调控网络提供工具,后续的GST-pulldown和质谱鉴定可进一步深入揭示NRP-1在肿瘤发生发展中的信号网络和作用机制,为肿瘤的治疗提供新的思路。
1 材料与方法
1.1材料
1.1.1主要试剂总RNA提取试剂TRIZOL、MMLV逆转录酶购自Invitrogen公司,PhusionDNA聚合酶、各种限制性内切酶和T4 DNA连接酶均购自美国NEB公司; 1 kb DNA分子质量标记物及蛋白分子量标准购自立陶宛Fermentas公司; GenClean柱式琼脂糖凝胶DNA回收试剂盒购自上海捷瑞生物工程有限公司; IPTG购自Sigma公司; PMSF、丙烯酰胺及双丙烯酰胺购自Amresco公司;其他化学试剂均为国产。
1.1.2质粒及细胞株克隆载体pCR-blunt购自美国Invitrogen公司;表达载体pGEX-4T-1购自GE Healthcare公司;大肠杆菌TOP10、BL21均购自美国Invitrogen公司。
1.1.3引物设计根据Genbank公布的NRP-1的cDNA序列用Primer 5软件设计PCR引物。不带酶切位点的上游引物: CGGAGAAGGGAGAATGGAGAG,带有酶切位点的上游引物: TggatccGAGAGGGGGCTGCCGC,下游引物: TTATTTGATACCTGATTGTATGGTGCTG。
1.2方法
1.2.1目的基因的克隆TRIZOL法从高表达NRP-1的MCF-7乳腺癌细胞株中提取细胞mRNA,使用M-MLV逆转录酶逆转录合成cDNA,利用Phusion聚合酶扩增NRP-1的CDS区,NRP-1的PCR扩增条件如下: 98℃2 min预变性,98℃30 s,68℃30 s,72℃2 min,共35个循环,最后72℃延伸2 min。取5 μl PCR产物,用1.0%琼脂糖凝胶电泳分离鉴定并回收目的片段。使用T4 DNA连接酶将NRP-1基因片段连入克隆载体pCR-blunt,转TOP10感受态细胞,挑选阳性克隆。EcoRⅠ单酶切初步鉴定重组质粒,将鉴定正确的质粒寄往Invitrogen公司上海测序部进行DNA测序,将鉴定正确的重组质粒命名为pCR-blunt-NRP-1。
1.2.2 pGEX-4T-1-NRP-1表达载体的构建及鉴定
重新设计有BamHⅠ酶切位点的上游引物,以测序正确菌液的小提质粒为模板重新PCR后连接至pCR-blunt载体上,且测序结果正确。用BamHⅠ和EcoRⅠ双酶切pCR-blunt-NRP-1及pGEX-4T-1质粒后,用1.0%琼脂糖凝胶电泳分离鉴定并回收目的片段NRP-1和线性化质粒pGEX-4T-1。使用T4 DNA连接酶将NRP-1基因片段与线性化质粒pGEX-4T-1连接,转化BL21感受态细胞。
1.2.3融合蛋白GST-NRP-1的诱导表达将测序正确的重组质粒转化入BL21感受态细菌,在含有氨苄青霉素(Amp)的LB上37℃培养过夜后筛选并提取质粒DNA,经BamHⅠ和EcoRⅠ再次双酶切后鉴定阳性克隆BL21菌种。在Ampr琼脂平板上挑选单菌落接种于LB/Amp液体培养基中,37℃摇床振荡培养过夜后,次日按1∶100转接LB培养基,37℃振荡培养至A600约为0.5时,加诱导剂IPTG 37℃振荡培养,诱导6 h,取超声破碎后样品收集上清及包涵体,经SDS-PAGE电泳分析显示表达产物主要以不溶性包涵体存在。
1.2.4目的蛋白诱导剂的选择将表达菌pGEX-4T-1-NRP-1 37℃摇床过夜,次日以1∶100转接,震荡培养至A600为0.5左右时,取培养的菌液15 ml,加入IPTG浓度分别为0.1、0.2、0.4、0.8、1.0 mmol/L,37℃继续培养6 h,4℃10 000 r/min离心5 min收集菌体,200 μl PBS重悬细菌,加入50 μl 5×上样缓冲液,加热煮沸5 min,取10 μl行10%SDSPAGE电泳,考马斯亮蓝染色并脱色。
1.2.5目的蛋白诱导时间的选择将表达菌pGEX-4T-1-NRP-1 37℃摇床过夜,次日以1∶100转接,震荡培养至A600为0.5左右时,取培养的菌液12 ml,加入IPTG至终浓度为0.4 mmol/L继续培养,分别于2 h、4 h、6 h、8h吸取菌液3 ml,按1.2.4的方法进行样品处理和分析。
1.2.6包涵体的复性及纯化将表达菌以1∶1 000转接1 L LB培养液,震荡培养至A600值为0.5左右时,加入IPTG至终浓度为0.4 mmol/L,37℃诱导表达6 h,离心收集表达菌体,按20 ml/g加入超声裂解液重悬,超声破碎细菌(直径2 mm变幅杆,工作3 s,停5 s,8 min一个循环,冰浴裂解)后,收集上清和沉淀,10% SDS-PAGE电泳,考马斯亮蓝染色显示融合蛋白以包涵体的形式进行表达。用包涵体洗涤液(1% TritonX-100,尿素1 mmol/L,EDTA 1 mmol/L,NaCl 0.3 mol/L)洗涤沉淀3次;然后以包涵体溶解液(ml)∶菌体湿重(g) = 15∶1的比例加包涵体溶解液(Tris-HCl 20 mmol/L,2%TritonX-100,NaCl 0.5 mol/L,DTT 0.2 mmol/L,尿素8 mol/L)重悬包涵体,4℃摇床缓慢震荡溶解3~4 h后离心取上清采用透析复性法进行透析,分别以尿素浓度4、3、2.5、2、1.5、1.0、0.5 mol/L进行梯度透析,透析过程在4℃进行,每个浓度的透析时间为4 h,同时密切观察有无浑浊或絮状物析出,如有及时4℃20 000 r/min、30 min超速离心去除析出蛋白继续复性。复性结束后将透析袋内的液体10 ml与500 μl洗涤后的谷胱甘肽-琼脂糖树脂匀浆混合成均匀悬液,4℃轻摇4 h; 4℃2 000 r/min离心5 min后弃上清;沉淀加入5倍床柱体积的PBS,颠倒混匀以洗去未结合的杂蛋白,4℃2 000 r/min离心5 min后弃上清,共进行3次。后加入等床柱体积的洗脱缓冲液(Reduced glutathione 10 mmol/L,Tris-HCL 50 mmol/L,NaCl 150 mmol/L)重悬匀浆,室温孵育10 min; 2 000 r/min离心5 min,保留上清,共洗脱三次合并3次所得上清。取超声裂解上清及不同浓度尿素洗涤、纯化的上清行SDS-PAGE电泳,分析目的蛋白的表达形式及融合蛋白纯化的最佳方案。
1.2.7 Western blot法检测融合蛋白蛋白纯化产物经SDS-PAGE电泳分离后,将融合蛋白转移至NC膜上,明胶室温封闭1 h,加入抗GST抗体,4℃孵育过夜。PBST洗膜3次,每次10 min,再加入HRP标记的山羊抗兔IgG,室温孵育1 h,PBST洗膜3次后,ECL化学发光显色。
2 结果
2.1人NRP-1基因的克隆和克隆载体的构建PCR产物经1.0%琼脂糖凝胶电泳,见一约1.8 kb的条带,与目的基因的大小相符(图1A)。使用限制性内切酶EcoRⅠ单酶切初步鉴定构建的重组质粒pCR-blunt-NRP-1,1.0%琼脂糖凝胶电泳可见大小约1.8 kb及3.5 kb两条清晰条带,与理论值相符(图1B)。
2.2融合蛋白表达载体pGEX-4T-1-NRP-1构建及鉴定使用BamHⅠ和EcoRⅠ酶切pCR-blunt-NRP-1及pGEX-4T-1质粒后,用T4 DNA连接酶连接后酶切鉴定,1.0 %琼脂糖凝胶电泳可见大小约4.9 kb及1.8 kb的两条条带,结果如下,与理论值相符(图2)。
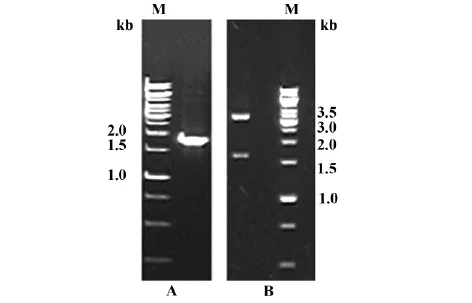
图1 NRP-1基因片段的扩增及pCR-blunt-NRP-1重组质粒的酶切Fig.1 Fragment NRP-1 amplified by PCR and recombinant plasmid digested with restriction enzyme
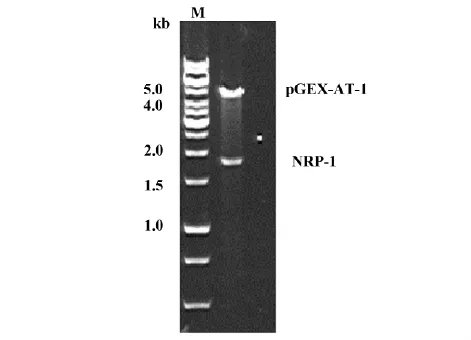
Note: M.1 kb DNA marker.Recombinant plasmid pGEX-4T-1-NRP-1digested by BamHⅠand EcoRⅠ.
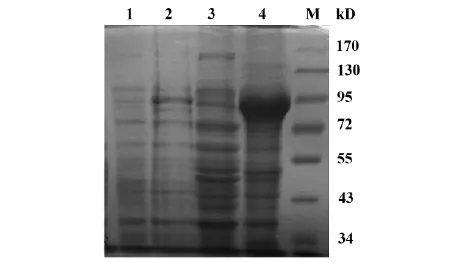
图3 GST-NRP-1融合蛋白的表达分析Fig.3 Analysis expression of GST-NRP-1 protein in E.coli
2.3融合蛋白GST-NRP-1的诱导表达收集IPTG诱导前、诱导后的菌液及超声裂解后上清和沉淀,进行考马斯亮蓝染色检测。结合GST及NRP-1的分子量大小,融合蛋白的分子量符合理论值大小。结果显示经IPTG诱导后GST-NRP-1融合蛋白以包涵体的形式高表达(图3)。
2.4不同诱导剂浓度对GST-NRP-1融合蛋白表达量的影响将表达菌pGEX-4T-1-NRP-1划板培养并在Ampr琼脂平板上挑选单菌落接种于LB液体培养基中,37℃摇床振荡至A600为0.6左右,诱导时间为6 h,诱导温度为37℃的条件下,诱导剂IPTG浓度在0.1~1.0 mmol/L的范围内,目的蛋白表达量在0.4 mmol/L IPTG浓度时表达量最高(图4)。
2.5不同诱导时间对GST-NRP-1融合蛋白表达量的影响诱导剂浓度为0.4 mmol/L,诱导温度为37℃的条件下,诱导时间在2、4、6、8 h时,目的蛋白表达量随着时间的延长而增加,诱导时间在6 h时蛋白表达量达到最高,之后趋于稳定(图5)。
2.6包涵体的复性及纯化包涵体洗涤、溶解及透析法复性后,与GST-beads结合,经谷胱甘肽洗脱后行考马斯亮蓝染色,结果显示有融合蛋白的表达且纯度尚可(图6)。

Note: M.Protein molecular weight marker; 1.The bacteria before induced by IPTG; 2-6.IPTG concentration were 0.1,0.2,0.4,0.8,1.0 mmol/L.
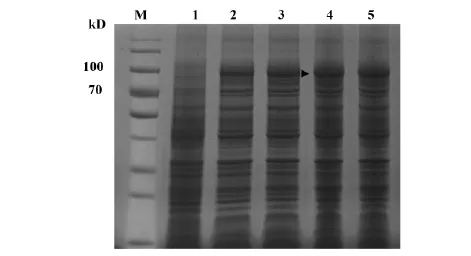
Note: M.Protein molecular weight marker; 1.The bacteria before induced by IPTG; 2-5.Induction time were 4 h,6 h,8h,10h.

图6 包涵体的复性及纯化Fig.6 Inclusion body refolding and purification

图7 融合蛋白的western blot分析Fig.7 Western blot analysis of GST-NRP-1 fusion protein
2.7 GST-NRP-1融合蛋白的检测收集经纯化后的蛋白,经Western blot检测,结果证实有GSTNRP-1融合蛋白的表达(图7)。
3 讨论
NRP-1是位于染色体10p12基因编码的Ⅰ型跨膜糖蛋白,为VEGF和SEMA家族受体。NRP-1在胚胎的骨骼肌和心血管系统,成人的上皮细胞、成骨细胞、骨髓干细胞以及其他组织包括肺、心脏、肝脏、肾脏、胰腺、胎盘等均有表达,在血管生成和血管发展方面起到重要作用[4]。有研究显示敲除NRP-1的老鼠因机能不全和血管形成滞后导致胚胎死亡[5]。对NRP-1的研究也涉及到许多肿瘤,包括前列腺癌、胰腺癌、乳腺癌、恶性黑色素瘤等。Gray等[6]发现在胰腺癌细胞系PANC-1中NRP-1过表达可抑制肿瘤生长,其机制与抑制AKT及Erk-1/2的磷酸化有关。通过其特异性siRNA下调NRP-1的表达,可导致肿瘤细胞的迁移及生长。但有研究却发现NRP-1高表达可促进肿瘤的生长、内皮细胞的增殖及血管的生成[7-10]。抗VEGF的靶向药物贝伐单抗可延长肿瘤的进展时间,在转移性乳腺癌中被广泛使用。然而,近来许多研究已经显示,贝伐单抗和细胞毒性化疗药物联合使用不增加病人的生存期,其具体机制不详[11]。作为VEGF165受体的NRP-1,在NRP-1阳性、VEGFR2阴性的乳腺癌细胞株中,VEGF165通过激活PI3K通路阻止肿瘤细胞凋亡,而且NRP1的水平和细胞生存直接相关[12]。另外,在介导乳腺癌迁移和转移中NRP1也起了非常重要的作用。有研究显示NRP-1和VEGF是独立的预后因素[13],因此NRP-1的具体作用机制仍有待研究。
本研究成功构建了携带NRP-1基因的原核表达载体pGEX-4T-1-NRP-1,转入BL21感受态细胞后表达了GST-NRP-1融合蛋白,该蛋白为后续进行GST-pull down实验及质谱分析深入研究NRP-1的作用机制及与其招募蛋白间的相互作用提供了有力工具。后续工作使用质谱分析等蛋白质组学手段结合免疫共沉淀和共定位等进一步验证手段可望基本阐明NRP-1的功能,将有助于深入认识NRP-1对癌症的调控机制,为后续的治疗提供新的思路。
参考文献:
[1]Fujisawa H,Takagi S,Hirata T.Growth-associated expression of a membrane Protein,neuropilin,in Xenopus optic nerve fibers[J].Dev Neurosci,1995,17(5-6) : 343-349.
[2]Murga M,Fernandez-Capetillo O,Tosato G.Neuropilin-1 regulates attachment in human endothelial cells independently of vascular endothelial growth factor receptor-2[J].Blood,2005,105 (5) : 1992-1999.
[3]Wang L,Zeng H,Wang P,et al.Neuropilin-1-mediated vascular permeability factor/vascular endothelial growth factor-dependent endothelial cell migration[J].J Biol Chem,2003,278 (49) : 48848-48860.
[4]Miao HQ,Lee P,Lin H,et al.Neuropilin-1 expression by tumor cells promotes tumor angiogenesis and progression[J].FASEB J,2000,14(15) : 2532-2539.
[5]Kitsukawa T,Shimizu M,Sanbo M,et al.Neuropilin-semaphorin III/D-mediated chemorepulsive signals play a crucial role in peripheral nerve projection in mice[J].Neuron,1997,19 (5) : 995-1005.
[6]Gray MJ,Wey JS,Belcheva A,et al.Neuropilin-1 suppresses tumorigenic properties in a human pancreatic adenocarcinoma cell line lacking neuropilin-1 coreceptors[J].Cancer Res,2005,65 (9) : 3664-3670.
[7]Duff SE,Saunders M,McCredie V,et al.Pre-operative plasma levels of vascular endothelial growth factor A,C and D in patients with colorectal cancer[J].Clin Oncol (R Coll Radiol),2005,17 (5) : 367-371.
[8]Xu T,Chen D.Serum vascular endothelial growth factor-C and vascular endothelial growth factor level in patients with colorectal carcinoma and clinical significance[J].J Huazhong Univ Sci Technolog Med Sci,2006,26(3) : 329-331,355.
[9]Alabi AA,Suppiah A,Madden LA,et al.Preoperative serum levels of serum VEGF-C is associated with distant metastasis in colorectal cancer Patients[J].Int J Colorectal Dis,2009,24(3) : 269-274.
[10]Abe A,Fukui H,Fujii S,et al.Involvement of cyclooxygenase-2 and vascular endothelial growth factor in vascularization and lymph node metastasis of colorectal cancers with submucosal invasion[J].J Gastroenterol Hepatol,2007,22(7) : 1071-1077.
[11]Miller K,Wang M,Gralow J,et al.Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer[J].N Engl J Med,2007,357(26) : 2666-2676.
[12]Bachelder RE,Crago A,Chung J,et al.Vascular endothelial growth factor is an autocrine survival factor for neuropilin-expressing breast carcinoma cells[J].Cancer Res,2001,61 (15) : 5736-5740.
[13]Ghosh S,Sullivan CA,Zerkowski MP,et al.High levels of vascular endothelial growth factor and its receptors (VEGFR-1,VEGFR-2,neuropilin-1) are associated with worse outcome in breast cancer[J].Hum Pathol,2008,39(12) : 1835-1843.
[收稿2014-12-20修回2015-08-21]
(编辑倪鹏)
doi:10.3969/j.issn.1000-484X.2015.10.016
作者简介:韩正祥(1974年-),男,博士,教授,硕士生导师,主要从事肿瘤方面研究,E-mail: cnhzxyq@ 163.com。
文章编号1000-484X(2015) 10-1370-05
文献标志码A
中图分类号R73