靶向阻断STAT3增强肝癌细胞H22对化疗药物阿霉素的敏感性①
王亚群 韩秋菊 庞 敏 张 建(山东大学药学院免疫药理与免疫治疗学研究所,济南250012)
靶向阻断STAT3增强肝癌细胞H22对化疗药物阿霉素的敏感性①
王亚群韩秋菊庞敏张建
(山东大学药学院免疫药理与免疫治疗学研究所,济南250012)
[摘要]目的:探讨STAT3阻断剂Decoy ODN与临床常用肝癌化疗药阿霉素(Doxorubicin)、5-氟尿嘧啶(5-Fu)和顺铂(cisplatin)联合使用对肝癌的治疗效果及其对免疫系统的影响。方法:肝癌细胞转染Decoy ODN后用化疗药处理,以MTT法检测肝癌细胞的增殖能力,Annexin-V/7AAD双染法检测细胞凋亡率;对H22荷瘤小鼠进行Decoy ODN和阿霉素联合治疗,观察小鼠肿瘤生长情况以及生存期;流式细胞术检测治疗后小鼠PBMC的细胞分群和活化水平,以及阿霉素或阿霉素处理的肿瘤细胞对小鼠脾脏淋巴细胞体外活化作用。结果:转染Decoy ODN以后,阿霉素对H22细胞的抑制作用显著增强,H22细胞凋亡率也明显升高。Decoy ODN和阿霉素联合治疗可明显降低小鼠肿瘤生长速度并延长荷瘤小鼠的生存期;低剂量阿霉素增加了PBMC中T细胞的比例和CD69分子的表达,以及NK细胞CD107a和IFN-γ的表达;阿霉素处理的H22细胞可促进T细胞比例的升高。结论: Decoy ODN阻断肝癌细胞STAT3后可以增强肝癌细胞H22对阿霉素的敏感性,提高化疗效果,降低化疗毒副作用,改善机体免疫功能。
[关键词]STAT3; Decoy;阿霉素;肝癌
①本文为国家自然科学基金(81373222)资助项目。
Targeted blocking STAT3 enhances sensitivity of liver cancer cell H22 to chemotherapy drug doxorubicin
WANG Ya-Qun,HAN Qiu-Ju,PANG Min,ZHANG Jian.Institute of Immunopharmacology and Immunotherapy,School of Pharmaceutical Sciences,Shandong University,Jinan 250012,China
[Abstract]Objective: To investigate the theraputic effect of STAT3 Decoy-ODN combined with chemotherapy drugs for HCC commonly used in clinical,include doxorubicin (DOX),5-fluorouracil (5-Fu) and cisplatin; and,analyzing the impact of combination therapy on the immune system.Methods: MTT assay was used to detect cell proliferation,and Annexin-V /7AAD double staining assay was used to detect the apoptosis of Decoy ODN transfected-hepatoma cells treated with chemotherapy drugs.The tumor growth and survival rate of H22 tumor-bearing mice treated with DOX combined with STAT3 Decoy-ODN or not were observed.FACS was applied to analyze the subpopulation and activation of PBMCs from tumor-bearing mice treated as above,and to evaluate the influence of DOX or DOX-treated tumor cells on spleen lymphocyte activation.Results: DOX-induced the suppression and the apoptosis of H22 were significantly increased by Decoy ODN transfection.The combination treatment of Decoy ODN and DOX significantly reduced H22 tumor growth and extended the survival of tumor-bearing mice.Low-dose DOX could increase the proportion of T cells and CD69+T cells in PBMCs,as well as the expression of CD107a and IFN-γ in NK cells.DOX-treated H22 cells increased the proportion of T cells.Conclusion: Targeted blocking STAT3 could enhance the sensitivity of liver cancer cells to doxorubicin.So,combination therapy may improve DOX therapeutic effect and reduce DOX-mediated side effects.Furthermore,low dose of DOX can promote the activation of host immune system by acting on tumor cells.
[Key words]STAT3; Decoy; Doxorubicin; HCC
肝癌是世界上常见的癌症之一,其发病率和死亡率均位居前列。由于饮食以及慢性肝炎等致癌风险因素,我国在肝癌的防治方面仍面临着极大的挑战。目前临床上治疗肝癌多采用传统的手术治疗以及辅助化疗的方式。由于化疗过程中肝癌细胞容易产生耐药性,并且化疗药物通常靶向性低,对正常细胞有着不可逆的损伤作用,从而导致相当大的毒副作用。因此,发现新的化疗药物、调整治疗策略(如联合治疗)是解决这一问题的关键。
信号转录活化因子3(STAT3)是细胞内重要的信号传递和基因调控因子,其调控的下游基因主要包括细胞周期控制基因Cyclin D1、抗凋亡基因Bclxl和Mcl-1,以及肿瘤恶性转移相关基因等[1-6]。许多研究证实,STAT3在多种癌症细胞中持续过度表达[7],如肝癌细胞、肺癌细胞等,导致肿瘤细胞异常增殖;另外,STAT3的高度表达还会诱导肿瘤免疫耐受相关细胞因子的表达,如细胞因子TGF-β和IL-10,抑制机体抗肿瘤免疫应答[8]。因此,靶向STAT3的抗肿瘤治疗成为近年的研究热点。
靶向STAT3诱骗寡核苷酸(Decoy ODN)是人工合成的与STAT3有高度亲和力的双链DNA,将其导入靶细胞中后,能够竞争性阻断STAT3与靶基因启动子结合,进而抑制STAT3下游基因的表达,抑制肿瘤细胞的恶性增殖和转移[2,9]。本研究利用Decoy ODN阻断肝癌细胞STAT3信号通路,观察其与临床常用化疗药联合应用对肝癌的治疗效果,为改善临床化疗策略提供新的思路和实验依据。
1 材料与方法
1.1材料
1.1.1细胞系小鼠肝癌细胞系H22,来源于山东省医学科学院。
1.1.2实验动物BALB/c小鼠,雄性,6~8周龄,购于北京华阜康生物科技有限公司。
1.1.3试剂阿霉素(Doxorubicin)购自北京华奉联博科技有限公司; 5-氟尿嘧啶(5-Fu)和顺铂(cisplatin)购自北京百灵威科技有限公司;阳离子脂质体LipofectamineTM-2000购自Invitrogen公司; MTT购自Sigma公司; DMSO购自上海生工生物工程有限公司; PMA和离子霉素购自上海碧云天生物技术有限公司; RPMI1640购于Gibco公司;胎牛血清购自杭州四季青公司; Annexin V-FITC/7-AAD凋亡检测试剂盒购自南京凯基生物有限公司。流式抗体: FITC标记的Anti-Murine CD49b(clone DX5)、Anti-Murine CD19,PE标记的Anti-Murine CD107a、Anti-Murine IFN-γ、Percp-cy5.5标记的Anti-Murine CD3e、APC标记的Anti-Murine CD69和Anti-Murine TNF-α,均购自Ebioscience公司。其他试剂均为国产分析纯。
1.1.4 STAT3 decoy ODN参照Leong等[10]报道的方法设计,两条互补序列分别为5'-CATTTCCCGTAAATC-3'和5'-GATTTACGGGAAATG-3',所有碱基硫代修饰,由大连宝生物有限公司合成。
1.2方法
1.2.1细胞培养及细胞转染H22细胞复苏后腹腔注射于昆明小鼠,一周后抽取小鼠腹水,PBS洗两遍后,以含有10%胎牛血清的RPMI1640培养基培养于37℃、5% CO2的条件下。将细胞接种于六孔板中,于无血清培养基的条件下进行Decoy-ODN (100 nmol/L)转染8 h,然后补充胎牛血清至10%终止转染,继续培养12 h。
1.2.2 MTT检测细胞增殖收集转染Decoy-ODN的细胞接种于96孔板,分别加入阿霉素(10 μg/ml,5 μg/ml,2.5 μg/ml)、5-Fu(200 μg/ml,100 μg/ml,50 μg/ml)和顺铂(10 μg/ml,5 μg/ml,2.5 μg/ml)作用24 h或48 h,然后每孔加入5 mg/ml的MTT 20 μl继续培养4 h; 2 500 r/min离板20 min,弃上清,每孔加入200 μl DMSO充分溶解沉淀,10 min内于酶标仪检测490nm波长下吸光度。以未转染Decoy-ODN的细胞为对照。
1.2.3 Annexin V/7-AAD双染法检测细胞凋亡收集转染Decoy-ODN的细胞接种于12孔板,分别加入阿霉素(5 μg/ml)、5-Fu(100 μg/ml)和顺铂(5 μg/ml)作用24 h;收集细胞于流式管中,以PBS清洗两遍,并加入200 μl Annexin V结合液重悬细胞,混匀,每管加入2.5 μl FITC-AnnexinV,4℃避光孵育15min;然后,每管再加入3 μl 7-AAD,4℃避光孵育5 min,最后以流式细胞仪检测。以未转染Decoy-ODN的细胞为对照。
1.2.4实验动物分组及治疗30只BALB/c小鼠进行腋下皮下荷瘤,2×106个H22细胞/只。一周后,肿瘤可见时将其随机分为五组: control组,PBS治疗; 1 mg组,腹腔注射阿霉素1 mg/kg; Decoy+1 mg组,腹腔注射阿霉素1 mg/kg,并且瘤内注射Decoy-ODN 100 μl(Decoy-ODN和lipo 2000按照质量/体积=1/2溶于PBS中静置20 min) ; 3 mg组,腹腔注射阿霉素3 mg/kg; Decoy组:瘤内注射100 μl Decoy-ODN。给药时间: Decoy-ODN给药时间为小鼠荷瘤后第7、10、13、16天,阿霉素给药时间为小鼠荷瘤后第8、11、14、17天。给药开始后每2~3 d记录一次小鼠肿瘤最长直径a和最短直径b,肿瘤体积按照公式V=ab2/2计算。
1.2.5小鼠外周血淋巴细胞亚群和活化水平检测
小鼠荷瘤后第20天尾静脉取血150 μl,以1 ml红细胞裂解液破除红细胞,然后加入400 μl PBS悬起细胞并加入10 μl大鼠血清封闭30 min;将细胞平分于两支流式管中,其中一管加入抗DX5、CD107a、CD3e和CD69抗体各0.5 μl,混匀,4℃避光放置1 h;然后,PBS洗一遍并加入100 μl PBS悬起细胞,于流式细胞仪进行检测。另一管加入抗DX5和CD3e抗体各0.5 μl,混匀,4℃避光放置1 h;然后,PBS洗一遍并加入1%多聚甲醛100 μl,混匀,4℃放置30 min; PBS洗一遍后加入100 μl穿膜液和10 μl大鼠血清封闭30 min,再加入抗IFN-γ和TNF-α抗体各0.5 μl,混匀,4℃避光放置1 h; PBS洗一遍后加入100 μl PBS悬起细胞,于流式细胞仪进行检测。所得流式数据采用FCS Express V3软件进行分析。
1.2.6小鼠脾脏淋巴细胞的获取取健康BALB/ c小鼠,无菌取脾脏,剪碎后通过200目筛网研磨过滤,于1 200 r/min离心10 min,弃上清,加入2 ml红细胞裂解液,混匀后于4℃放置10 min; PBS洗两遍,加入含有10%胎牛血清的RPMI1640在37℃、5%CO2条件下培养。
1.2.7小鼠脾脏淋巴细胞体外增殖实验将1.2.6中所得的细胞接种于96孔板中,同时加入PMA(10 ng/ml)和离子霉素(200 ng/ml),并分别加入阿霉素(10、5、2.5 μg/ml)、5-Fu(200、100、50 μg/ ml)和顺铂(10、5、2.5 μg/ml)作用24 h,同1.2.2中的MTT方法检测细胞增殖。
1.2.8小鼠脾淋巴细胞活化检测将1.2.6中所得的细胞接种于12孔板中,分别加阿霉素(10、5、2.5 μg/ml)、5-Fu(200、100、50 μg/ml)和顺铂(10、5、2.5 μg/ml)作用24 h;然后收集细胞于流式管中,PBS清洗两遍,加入200 μl PBS悬起细胞,同1.2.5中的方法进行抗体标记和流式细胞仪检测。
1.2.9肝癌细胞与小鼠脾脏淋巴细胞体外共培养将H22细胞接种于6孔板中,分别加阿霉素(10、5、2.5 μg/ml)作用24 h,收集细胞于1 200 r/min离心5 min,弃上清。将1.2.6中所得的小鼠脾淋巴细胞接种于12孔板,然后将阿霉素处理的H22细胞按照H22细胞:淋巴细胞为1∶20的比例加入到脾淋巴细胞培养体系中,孵育24 h后收集细胞,并以
1.2.8中的方法进行流式检测。
1.3统计学分析所有数据采用GraphPad Prism5进行分析。各组数据间差异通过t检验,P<0.05认为具有统计学差异。
2 结果
2.1阻断STAT3可以增强阿霉素对H22细胞增殖的抑制效果首先利用MTT法检测H22细胞转染Decoy-ODN后,三种化疗药对其增殖的影响。从图1A中可以观察到,转染Decoy-ODN后,H22细胞对三种化疗药的敏感性均有所增强。但是,与未转染Decoy-ODN组相比,转染Decoy-ODN后,阿霉素对H22细胞的抑制率明显高于未转染组(P<0.01),而5-Fu和顺铂组则没有明显差异(图1B)。这一结果提示,阻断STAT3可以提高H22细胞对阿霉素的敏感性。
2.2阻断STAT3可以促进阿霉素诱导H22细胞凋亡如图2所示,三种化疗药均能不同程度地诱导H22细胞凋亡;但是,转染Decoy-ODN后,阿霉素诱导细胞凋亡数由转染前的(9.14±1.78) %增加到(23.48±2.00) %,而5-Fu和顺铂诱导H22细胞凋亡水平在Decoy-ODN转染组与为转染组之间没有显著差异。这一结果提示,阻断STAT3可以提高阿霉素诱导H22细胞凋亡的能力。
2.3阻断STAT3可以提高阿霉素抑制H22在小鼠体内的生长为了研究Decoy-ODN与阿霉素联合作用是否在体内也有效,我们利用BALB/c荷瘤小鼠模型进行体内联合治疗实验,治疗方式见图3A。结果显示,经过四次治疗后,Decoy-ODN与低剂量阿霉素(1 mg/kg)联合治疗组的肿瘤增长速度明显低于control组(P<0.001)和单独阿霉素用药组(P<0.01) (见图3B),其生存期也明显长于其他组包括阿霉素高剂量组(3 mg/kg) (图3C)。同时,在荷瘤后第20天,各组小鼠的体重如图3D所示,高剂量组(3 mg)小鼠体重明显轻于control组(P<0.01),而联合用药组与control组相比则没有显著性差异(P>0.05)。这一结果提示,联合用药在提高肿瘤治疗效果的同时,还可以降低阿霉素对小鼠的毒副作用。
2.4低剂量阿霉素治疗可促进小鼠免疫系统的活化在对小鼠进行治疗的过程中,我们利用流式技术分析了小鼠PBMC中细胞亚群及其活化水平。从图3A可以看到,阿霉素组治疗可以升高小鼠PBMC中T细胞比例(P<0.05) ;同时,低剂量阿霉素组和联合用药组的T细胞表面活化分子CD69表达明显高于control组(P<0.05) (图3B) ;与control组相比,虽然各治疗组不影响NK细胞的比例,但是低剂量组和联合用药组的NK细胞脱颗粒相关分子CD107a(图3C)以及胞内细胞因子IFN-γ(图3D)的表达水平均明显升高(P<0.05)。这一结果说明,利用低剂量的阿霉素治疗肝癌不仅可以避免其对免疫细胞的副作用,并且有利于提高荷瘤小鼠免疫系统的活化。
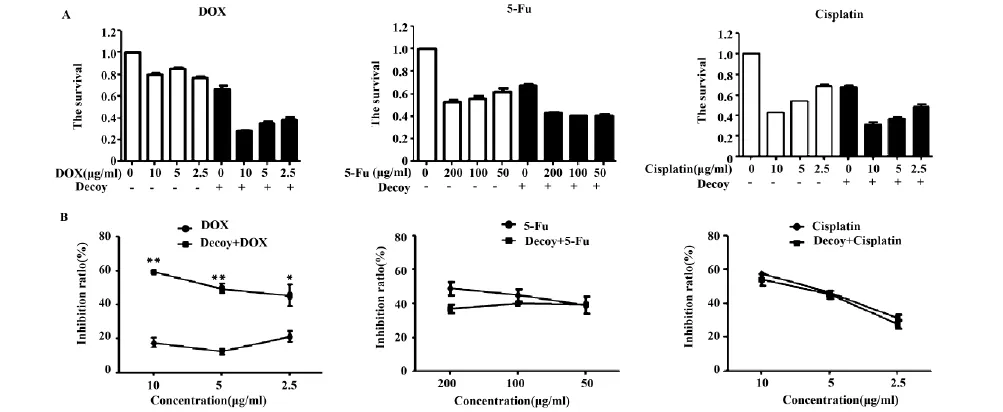
Note: A.MTT assay for the proliferation of H22 cells after treated with three chemotherapy drugs in different concentrations (24 h) ; B.The comparison of cell proliferation inhibition rate by three chemotherapeutic drugs (24 h).**.P<0.001.* .P<0.01.

图2 阻断STAT3可以促进阿霉素诱导H22细胞凋亡Fig.2 Blocking STAT3 promotes H22 cell apoptosis induced by doxorubicin
2.5低剂量阿霉素作用于肿瘤细胞后有利于免疫系统的活化为了探讨阿霉素对免疫系统活化的机制,我们首先检测了阿霉素对小鼠脾淋巴细胞体外增殖的影响。如图5A所示,阿霉素和5-Fu对脾淋巴细胞的增殖均表现出明显的抑制作用(P<0.001),顺铂对脾淋巴细胞增殖则没有明显影响;同时,阿霉素处理脾淋巴细胞24 h后,T细胞(CD3+DX5-)表面活化分子CD69的表达随着阿霉素剂量的增高而降低(图5B),表明阿霉素本身对淋巴细胞活化发挥抑制作用。接下来,我们用阿霉素预先处理24 h的H22细胞与脾淋巴细胞共同培养,结果发现,低剂量阿霉素处理的H22细胞可促进脾淋巴细胞中T细胞比例升高,但对T细胞和NK细胞的活化没有显著影响(结果未显示) ;而高剂量阿霉素(10 μg/ml)处理的H22细胞则对脾淋巴细胞中T细胞的增殖表现出抑制作用(图5C)。这些数据表明,低剂量阿霉素通过作用于肝癌细胞有利于荷瘤小鼠机体免疫系统的活化,同时削弱了阿霉素对免疫系统的直接毒副作用。

图3 阻断STAT3可以提高阿霉素抑制H22在小鼠体内生长的能力Fig.3 Blocking STAT3 can enhance the inhibitory effect of doxorubicin on H22 growth in vivo
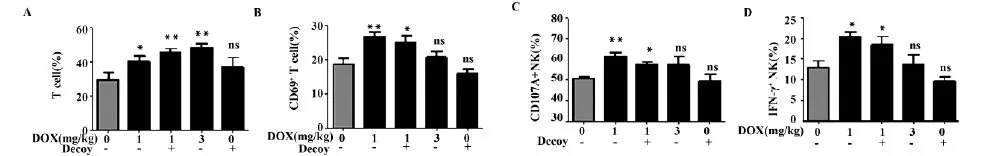
图4 低剂量阿霉素治疗可促进小鼠免疫系统的活化Fig.4 Low dose of doxorubicin therapy can promote activation of immune system in mice FACS detect the T cell

图5 低剂量阿霉素作用于肿瘤细胞后有利于免疫系统的活化Fig.5 Low dose of doxorubicin is benefit to activation of immune system by acting on tumor cells
3 讨论
由于肝癌易转移的特点以及肝脏器官的特殊性,临床上难以通过手术切除的方式对其进行治疗,因此化疗在肝癌的治疗中占有重要地位。但是,肝癌并不属于化疗敏感的癌症,临床上化疗的有效剂量多伴有明显的毒副作用。为了提高治疗效果同时降低化疗药物的毒副作用,我们利用靶向阻断STAT3的Decoy ODN与临床常用肝癌化疗药阿霉素、5-Fu和顺铂联和应用,发现阻断STAT3信号可以明显增加肝癌细胞对阿霉素的化疗敏感性,有效抑制H22细胞体外增殖能力,诱导H22细胞凋亡;体内实验进一步证明,二者联用后小鼠肿瘤增长速度明显减慢,且荷瘤小鼠生存期延长。
对机体免疫系统的损伤是化疗的突出毒副作用之一。多数化疗药对免疫系统有抑制作用,因此有些化疗药物如环磷酰胺可作为免疫抑制剂应用于自身性疾病的治疗[11]。另外,传统观念认为,细胞毒药物诱导的细胞死亡大多是通过凋亡途径实现的,而凋亡是一种程序性、生理性的过程,即非免疫原性死亡,不会激发免疫系统反应[12],这也可能是化疗药诱导机体免疫耐受的原因之一。但是,最近一些研究报道,化疗药可以通过诱导肿瘤细胞免疫原性死亡,从而激发免疫应答。如5-Fu能诱导肿瘤细胞死亡,增加肿瘤相关抗原的释放,从而提高DC细胞的抗原提呈功能[13]。另外,有些化疗药可以直接作用于免疫系统,起到免疫调节作用。例如,紫杉醇与小鼠TLR4结合,通过模拟细菌LPS作用激活小鼠巨噬细胞和DC细胞[14]。有研究发现,对发生转移的实体肿瘤患者反复给予低剂量环磷酰胺后,宿主Treg细胞数量明显减少,并且DC细胞对肿瘤抗原的敏感性增加[15,16]。本研究中我们发现高剂量和低剂量的阿霉素治疗荷瘤小鼠后均能增加T细胞的比例,但是只有低剂量阿霉素和联合用药组才能诱导T细胞活化;同时,低剂量阿霉素和联合用药组促进了NK细胞CD107a和IFN-γ的表达。进一步通过体外实验证明,阿霉素本身对淋巴细胞的增殖和活化发挥抑制作用,但是低剂量阿霉素处理的肿瘤细胞则能促进淋巴细胞(T细胞)增殖,提示阿霉素可能通过诱导肿瘤细胞免疫原性死亡,从而对免疫系统发挥活化作用,其具体的机制还有待进一步研究。
综上所述,本研究证明STAT3信号通路阻断与阿霉素联合应用,在提高抗肿瘤治疗效果的同时减少化疗剂量,从而降低化疗药对机体的副作用,特别是对免疫系统的抑制作用,并且提高了机体的免疫功能,有利于促进机体抗肿瘤效应。因此,合理利用化疗药物的作用机制,并结合适当的治疗策略如联合用药,将有利于临床上对肝癌的协同治疗作用。
参考文献:
[1]Aoki Y,Feldman GM,Tosato G.Inhibition of STAT3 signaling induces apoptosis and decreases survivin expression in primary effusion lymphoma[J].Blood,2003,101(4) : 1535-1542.
[2]Sun X,Sui Q,Zhang C,et al.Targeting blockage of STAT3 in hepatocellular carcinoma cells augments NK cell functions via reverse hepatocellular carcinoma-induced immune suppression[J].Mol Cancer Therapeutics,2013,12(12) : 2885-2896.
[3]Dechow TN,Pedranzini L,Leitch A,et al.Requirement of matrix metalloproteinase-9 for the transformation of human mammary epithelial cells by Stat3-C[J].Proc Natl Acad Sci USA,2004,101 (29) : 10602-10607.
[4]Haura EB,Turkson J,Jove R.Mechanisms of disease: Insights into the emerging role of signal transducers and activators of transcription in cancer[J].Nat Clin Pract Oncol,2005,2(6) : 315-324.
[5]Haura EB,Zheng Z,Song L,et al.Activated epidermal growth factor receptor-Stat-3 signaling promotes tumor survival in vivo in non-small cell lung cancer[J].Clin Cancer Res,2005,11(23) : 8288-8294.
[6]Masuda M,Suzui M,Yasumatu R,et al.Constitutive activation of signal transducers and activators of transcription 3 correlates with cyclin D1 overexpression and may provide a novel prognostic marker in head and neck squamous cell carcinoma[J].Cancer Res,2002,62(12) : 3351-3355.
[7]Germain D,Frank DA.Targeting the cytoplasmic and nuclear functions of signal transducers and activators of transcription 3 for cancer therapy[J].Clin Cancer Res,2007,13(19) : 5665-5669.
[8]Yu H,Kortylewski M,Pardoll D.Crosstalk between cancer and immune cells: role of STAT3 in the tumour microenvironment[J].Nat Rev Immunol,2007,7(1) : 41-51.
[9]Sui Q,Zhang J,Sun X,et al.NK cells are the crucial antitumor mediators when STAT3-mediated immunosuppression is blocked in hepatocellular carcinoma[J].J Immunol,2014,193 (4 ) : 2016-2023.
[10]Leong PL,Andrews GA,Johnson DE,et al.Targeted inhibition of Stat3 with a decoy oligonucleotide abrogates head and neck cancer cell growth[J].Proc Natl Acad Sci USA,2003,100 (7) : 4138-4143.
[11]Schiavoni G,Sistigu A,Valentini M,et al.Cyclophosphamide synergizes with type I interferons through systemic dendritic cell reactivation and induction of immunogenic tumor apoptosis[J].Cancer Res,2011,71(3) : 768-778.
[12]Bhardwaj N.Harnessing the immune system to treat cancer[J].J Clin Invest,2007,117(5) : 1130-1136.
[13]Akbulut H,Tang Y,Akbulut KG,et al.Chemotherapy targeted to cancer tissue potentiates antigen-specific immune response induced by vaccine for in vivo antigen loading and activation of dendritic cells[J].Mol Ther,2008,16(10) : 1753-1760.
[14]Kubo M,Morisaki T,Matsumoto K,et al.Paclitaxel probably enhances cytotoxicity of natural killer cells against breast carcinoma cells by increasing perforin production[J].Cancer Immunol Immunother,2005,54(5) : 468-476.
[15]Ghiringhelli F,Larmonier N,Schmitt E,et al.CD4+CD25+regulatory T cells suppress tumor immunity but are sensitive to cyclophosphamide which allows immunotherapy of established tumors to be curative[J].Eur J Immunol,2004,34(2) : 336-344.
[16]Greten TF,Ormandy LA,Fikuart A,et al.Low-dose cyclophosphamide treatment impairs regulatory T cells and unmasks AFP-specific CD4+T-cell responses in patients with advanced HCC[J].J Immunother,2010,33(2) : 211-218 .
[收稿2015-01-14修回2015-04-03]
(编辑张晓舟)
doi:10.3969/j.issn.1000-484X.2015.10.002
通讯作者及指导教师:张建(1965年-),女,教授,博士生导师,主要从事免疫药理与免疫治疗学研究,E-mail: zhangj65@ sdu.edu.cn。
作者简介:王亚群(1989年-),男,主要从事免疫药理与免疫治疗方向的研究,E-mail: wyq890512@ 163.com。
文章编号1000-484X(2015) 10-1304-07
文献标志码A
中图分类号R446.61