B细胞免疫突触在抗原捕获、加工和递呈过程中的作用①
B细胞免疫突触在抗原捕获、加工和递呈过程中的作用①
王倩杨桂连王春凤
(吉林农业大学动物科学技术学院吉林省动物微生态制剂工程研究中心,长春130118)
①本文受国家“863”计划项目(2013AA102806,2011AA10A215)、国家自然科学基金项目(31272552,31272541,81170358)、教育部新世纪优秀人才支持计划项目(NCET-10-0175)、吉林省科技发展计划项目(20111816)和吉林省世行贷款农产品质量安全项目(2011-Y07)资助。
B细胞具有捕获外部抗原的能力,B细胞将其捕获的外部抗原在抗原加工区室中降解成肽段,然后抗原肽与进入区室的MHCⅡ类分子结合,表达于B细胞表面并提呈给CD4+T细胞,这是适应性免疫反应过程的一个关键性步骤。B细胞与T细胞之间的这种联系被称为T、B细胞的合作[1],这个过程B细胞形成生发中心,并且分化为能够产生亲和力更高的的浆细胞,同时发展成为记忆性B细胞亚群。B细胞通过MHCⅡ类分子对抗原进行递呈的过程是十分复杂的,主要涉及以下几个阶段:第一,B细胞可通过B细胞抗原受体(BCR)识别并捕获外部抗原;第二,捕获后的抗原在B细胞的抗原加工室中被降解为肽段,然后被降解的肽段与MHCⅡ类分子结合;第三,MHCⅡ类分子与肽段的复合物将表达于B细胞表面并提呈给CD4+T细胞,见图1。
如上所述,被B细胞识别的抗原经过特殊的抗原递呈细胞处理后将其表达于细胞表面,形成一个免疫突触[2]。这个动态平台坐标信号与抗原的摄取和加工处理对于B细胞的完全活化过程是至关重要的。在本文中,我们将介绍B细胞突触在抗原捕获、加工处理与抗原递呈的过程中所发挥的关键性作用。特别强调的是免疫突触的形成保证了B细胞对侵入抗原反应的同时完成它们的免疫效应功能[3]。
1 B细胞突触在捕获抗原过程中所发挥的重要作用
1.1 B细胞与抗原的相遇过程在哺乳动物中,B细胞产生于哺乳动物的骨髓,随后经历一系列的发育再转移至脾脏,它们在脾脏开始分化为成熟的B细胞和不成熟的B细胞[4]。然后成熟的B细胞通过血液再循环迁移至脾脏和淋巴结等次级淋巴器官,次级淋巴器官能够为B细胞捕获抗原和B细胞的完全活化过程提供其所需的结构和化学微环境[5],见图2。
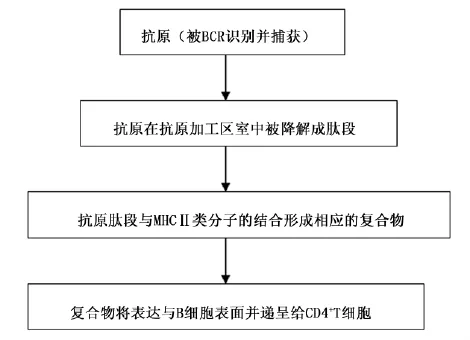
图1 B细胞通过MHCⅡ类分子对抗原进行递呈的过程Fig.1 B cells through MHCⅡmolecules on antigen presenting presess
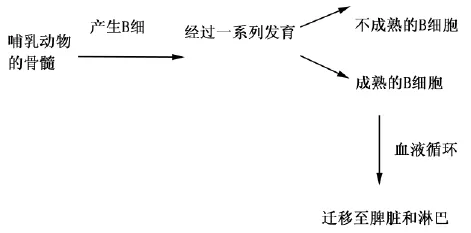
图2 B细胞的来源及分化Fig.2 Sources of B cells
当B细胞遇到可溶性抗原或颗粒性抗原时,它们通常吸附于邻近的细胞表面,如巨噬细胞、滤泡树突状细胞或者树突状细胞[6,7]。小的可溶性抗原可以通过输入淋巴管进入淋巴结,并且可能直接获得进入B细胞滤泡的机会从而对细胞的抗原递呈起到调节作用[8,9]。
尽管可溶性抗原具有迅速进入滤泡B细胞的能力,在体内研究结果表明病毒团聚体,免疫复合物或抗原包被的微球体等大分子抗原只能有限地进入滤泡,到达B细胞区并触动B细胞的活化[10]。此外,B细胞滤泡包含滤泡树突状细胞,而滤泡树突状细胞也具有向B细胞递呈抗原的能力。与B细胞相互作用后的抗原将表达于邻近细胞的次级淋巴器官表面,从而触发免疫突触的形成,免疫突触的形成能够促进膜抗原的高效捕获和递呈。
1.2 B细胞免疫突触的形成B细胞在BCR与抗原衔接时能够形成免疫突触,并且这些抗原必须是结合在专职性抗原递呈细胞的表面。B细胞所形成的这种动态结构反映了免疫突触的经典特征,它是由BCR形成一个被一群黏附分子所包围的中枢簇,其中包括淋巴细胞功能相关抗原1[11]。整合素能够提高B细胞与抗原递呈细胞的黏附力,并且当抗原亲和力较低时,与整合素结合能够降低B细胞活化的阈值[12]。BCR是由血浆膜免疫球蛋白与传递抗原信号的Igα和Igβ形成的二聚体,内含免疫受体酪氨酸活化基序(ITAMs)的酪氨酸残基在与抗原结合后,会被SRC家族磷酸激酶迅速磷酸化[13,14]。这会导致酪氨酸激酶的活化与募集,随后是钙信号诱导,钙信号诱导与B细胞功能相关基因的转录过程是相关联的[15]。B细胞活化的早期,能在抗原接触位点处快速诱导一个肌动蛋白依赖型膜扩散反应,这能促使与BCR相遇的抗原数量增加,同时也是形成信号微团簇的必要过程之一[16]。在此之后,抗原都被聚集到B细胞活化辅助受体中[17],这些B细胞活化辅助受体包括CD19、CD21、CD81、CD225[18],以及胞浆信号组件如LYN、SYK和VAV1[19],它们都被募集到一起以形成小信号体。紧随其后的就是一个收缩阶段,也就是说抗原与B细胞抗原受体的复合物汇集成一个生发中心[20]。这种收缩是在ERM蛋白(ezrin/radixin/moesin,埃兹蛋白/根蛋白/膜突蛋白)和微管运动蛋白的共同介导下完成的,ERM蛋白是连接细胞皮质层肌动蛋白细胞骨架与质膜上整合膜蛋白的桥梁分子,整个过程下ERM蛋白和微管运动蛋白的介导下肌动蛋白重新分布,细胞骨架再建[21],调节紧密连接功能和聚集,导致空泡样结构的形成。这能够直接作用于突触位点所聚集的大量抗原,因此,这对高效摄取抗原的过程来讲是十分重要的。这些结果表明在突触形成的过程中各信号之间是紧密协调工作的,并且这对B细胞活化过程来讲也是十分重要的。
1.3 B细胞突触中肌动蛋白细胞骨架的作用B细胞通过其内部的肌动蛋白细胞骨架的动态改变来诱导细胞扩散,从而促进突触的形成以及膜结合抗原的聚集和提取。一些位于下游的B细胞抗原受体效应蛋白能够调节肌动蛋白的重新分布和细胞骨架的再建。其中包括鸟苷三磷酸激酶RAC1和RAC2,它们能够促进激动蛋白的聚合,并且对细胞扩散反应也起着十分重要的作用[22]。特别是RAC2,它能够与RAP1鸟苷三磷酸激酶共同发挥作用,并且RAC2在突触形成过程中淋巴细胞功能相关抗原-1所调节的膜扩散反应来说是十分重要的。但是,RAP1鸟苷三磷酸激酶也能在淋巴细胞功能相关抗原-1缺席的情况下促进B细胞的扩散反应[22],它能够通过切断肌动蛋白纤丝的活动使肌动蛋白细胞骨架迅速的发生重排反应从而促进B细胞的扩散反应[23]。事实上,起初我们认为B细胞抗原受体能够快速地诱导肌动蛋白细胞骨架发生解聚反应,随后通过极化作用重新聚合[23]。
总之,通过肌动蛋白骨架的重排反应对受体扩散动力学进行控制对B细胞来说是十分重要的[24,25],它能够协调B细胞抗原受体信号,并在突触形成过程中促进抗原的摄取。
1.4在B细胞突触形成过程中微管依赖性分子运输的重要作用只有B细胞抗原受体的流动性在分子马达定向运动的作用下增强时,才会形成突触[26,27]。最近的研究结果表明微管网对B细胞突触的形成起着突出的重要作用。研究结果表明动力蛋白是一种向微管负端运输的马达蛋白,它与细胞内的物质运输密切相关,并且动力蛋白是突触聚集抗原受体微团簇的必要条件。此外,我们最初在自然杀伤细胞和细胞毒性T细胞所建立的免疫突触也得到了相似的结果[28],我们发现B细胞能够快速调动它们的微管组织中心至抗原位点与其相遇[29]。在B细胞中,位于免疫突触的微管组织中心重新定位,同时因为MHCⅡ类分子内含有溶酶体,溶酶体能够根据递呈摄入抗原所需的MHCⅡ类分子量来控制MHCⅡ类分子的局部浓度[29]。此外,在突触处含有溶酶体的MHCⅡ类分子的分泌是十分必要的,因为它能够促进结合抗原的摄取和递呈[30]。
有相关研究应用激光消融技术对微管组织中心进行处理,并分析对比了处理前后的溶酶体分布情况,从而对微管组织中心的极化和溶酶体向B细胞突触运输的状况进行了判定。结果表明,经处理后溶酶体仍然保持分散的分布状态,并且当微管组织中心被中断时溶酶体没有在免疫突触聚集成簇[31]。这个结果表明,微管网会指挥溶酶体向突触处运输,而运输形式由B细胞抗原受体所结合的固定抗原决定。
2 B细胞免疫突触在的抗原加工所发挥的重要作用
2.1 B细胞免疫突触所分泌的溶酶体的重要作用
免疫突触是内吞和胞吐过程发生的一个动态平台。事实上,辅助性T细胞和细胞毒性T细胞都能够分泌一些效应分子,如细胞因子和溶酶颗粒,这些效应分子在经过免疫突触时,能够有选择的进行激
活或摧毁相互作用的靶细胞[32,33]。研究发现T细胞内发生的胞吐作用往往发生在肌动蛋白聚合水平较低的子域[34],这些子域能够促进分子的局部分泌过程[35]。皮质肌动蛋白能够起到聚合屏障的作用,从而阻碍上皮细胞细胞膜胞吐进程[36]。已有研究利用全内反射荧光显微镜(TIRFM)来观察B细胞内溶酶体在突触表面的募集过程。招募到的溶酶体逐渐趋于稳固,这表明细胞膜上的囊泡对接过程已经完成。此外,我们可以测量细胞外突触间隙的局部酸化情况并且可以通过全内反射荧光显微镜(TIRFM)来监视细胞外的胞吐情况,这些研究结果表明突触能够分泌溶酶体。
2.2 B细胞免疫突触所分泌的蛋白酶的重要作用
溶酶体被运输到抗原相遇位置,并在该抗原相遇位点进行胞吐过程。这也表明,游离细胞膜栓系抗原与抗原递呈细胞作用时免疫突触局部释放胞外蛋白酶的活性是必需的。有趣的是,巨噬细胞也涉及类似的细胞机制,巨噬细胞的溶酶体分泌是在一个封闭的酸性胞外区,这和酸性胞外区的作用主要是能够利用酯酶和蛋白酶促进聚合脂蛋白的消化[37]。但是B细胞突触在与膜栓系抗原结合时是否会在B细胞突触形成一个紧密封闭的区域还是未知的。此外,目前尚未进行一些关于B细胞生物学方面的调查,也就是可能免疫突触所分泌的溶酶体酶能够提高膜结合抗原的能力。另外,B细胞能够在细胞间进行信息交流的过程中摄取膜结合抗原[38,39]。很有可能的是,这种机制也需要依靠于细胞支架的重排反应产生的力,从而促进摄取抗原以及水解酶和脂肪酶的分泌。
分泌溶酶体的区域和分泌蛋白酶的区域位置是不同的,B细胞突触所分泌的蛋白酶的种类和数量能够决定T细胞所递呈的抗原肽片段的太小。此外,细胞外所产生的抗原肽片段可能也能够直接装载到MHC-II类分子的细胞表面。由于B细胞内的溶酶体蛋白酶含量要远远低于巨噬细胞内的溶酶体蛋白酶含量[40],这样就能通过限制肽决定因素的完全破坏来促进MHC-II类分子表面的抗原肽片段的递呈[41]。
3 B细胞免疫突触在抗原递呈过程中所发挥的重要作用
B细胞活化的一个关键步骤就是将已经处理过的抗原递呈给CD4+T细胞,该过程保证了B细胞能够完全活化。在遇到抗原后,B细胞必须迁移至T细胞的边缘,在T细胞边缘时B细胞能够与同源辅助性T细胞发生接触[42]。重要的是,B细胞和T细胞之间的相互作用形成了免疫突触,在免疫突触处各细胞间能够进行信号交换。研究表明免疫突触局部分泌能够促进细胞产生极化表型和微管组织中心的重新定位。
4 结语
为了更好地了解B细胞突触的重要作用,我们对最近研究结果进行分析整理,从而对B细胞突触的重要性提供了一些新见解。综上所述我们可以了解B细胞突触在B细胞搜索查找抗原过程以及抗原的摄取、加工和递呈过程所发挥的重要作用。目前关于微管组织中心重新定位的分子机制还没有完全弄清楚,但是微管组织中心重新定位依赖于T细胞突触相关动力蛋白所产生的作用力已经被阐明。动力蛋白能否对B细胞突触处的微管组织中心的极化过程起到促进作用,以及微管组织中心的极化是否伴随着核运动,这些问题将会是一些比较有意思的研究课题。
参考文献:
[1]Mitchison NA.T cell-B cell cooperation[J].Nat Rev Immunol,2004,4(4) : 308-312.
[2]Batista,Facundo D,Dagmar Iber,et al.B cells acquire antigen from target cells after synapse formation[J].Nature,2001,411(6836) : 489-494.
[3]Dustin ML.What counts in the immunological synapse?[J].Mol Cell,2014,54(2) : 255-262.
[4]Bertrand FE,Eckfeldt CE,Fink JR,et al.Microenvironmental influences on human B cell development[J].Immunol Rev,2000,175 (1) : 175-186.
[5]von Andrian UH,Mempel TR.Homing and cellular traffic in lymph nodes[J].Nat Rev Immunol,2003,3(11) : 867-878.
[6]Carrasco,Yolanda R,Batista FD.B cells acquire particulate antigen in a macrophage-rich area at the boundary between the follicle and the subcapsular sinus of the lymph node[J].Immunity,2007,27(1) : 160-171.
[7]Tobias Junt,Moseman A,Iannacone M,et al.Subcapsular sinus macrophages in lymph nodes clear lymph-borne viruses and present them to antiviral B cells[J].Nature,2007,450(7166) : 110-114.
[8]Pape KA,Catron DM,Itano AA,et al.The humoral immune response is initiated in lymph nodes by B cells that acquire soluble antigen directly in the follicles[J].Immunity,2007,26 (4) : 491-502.
[9]Clark SL.The reticulum of lymph nodes in mice studied with the electron microscope[J].Am J Anat,1962,110(3) : 217-257.
[10]Batista,Facundo D,Harwood NE.The who,how and where of antigen presentation to B cells[J].Nature Rev Immunol,2009,9 (1) : 15-27.
[11]Yuseff MI,Lankar D,Lennon-Dumenil AM.Dynamics of membrane trafficking downstream of B and T cell receptor engagement: impact on immune synapses[J].Trraffic,2009,10(6) : 629-636.
[12]Carrasco YR,Fleire SJ,Thomas Cameron,et al.LFA 1/ICAM 1 interaction lowers the threshold of B cell activation by facilitating B cell adhesion and synapse formation[J].Immunity,2004,20 (5) : 589-599.
[13]Cambier JC,Pleiman CM,Clark MR.Signal transduction by the B cell antigen receptor and its coreceptors[J].Annu Rev Immunol,1994,12(1) : 457-486.
[14]Michael R,Wienands J.Initiation and processing of signals from the B cell antigen receptor[J].Annu Rev Immunol,1997,15 (1) : 453-479.
[15]Yoshihiro Baba,Tomohiro Kurosaki.Impact of Ca2+signaling on B cell function[J].Trends Immunol,2011,32(12) : 589-594.
[16]Harwood NE,Facundo DB.Early events in B cell activation[J].Annu Rev Immunol,2010,28: 185-210.
[17]David Depoil,Sebastian Fleire,Teranor BL,et al.CD19 is essential for B cell activation by promoting B cell receptor-antigen microcluster formation in response to membrane-bound ligand [J].Nat Immunol,2007,9(1) : 63-72.
[18]Depoil D.Early events of B cell activation by antigen[J].Sci Signal,2009,2(63) : pt1.
[19]Pavel Tolar,Hea Won Sohn,Pierce SK.Viewing the antigen-induced initiation of B cell activation in living cells[J].Immunol Rev,2008,221(1) : 64-76.
[20]Ramsbottom KM,Hawkins E,Shimoni R.Cutting edge: DNAX accessory molecule 1-deficient CD8+T cells display immunol-ogical synapse defects that impair antitumor immunity[J].J Immunol,2014,192(2) : 553-557.
[21]Tim Schnyder,Angelo Castello,Christoph Feest,et al.B cell receptor-mediated antigen gathering requires ubiquitin ligase Cbl and adaptors Grb2 and Dok 3 to recruit dynein to the signaling microcluster[J].Immunity,2011,34(6) : 905-918.
[22]John AH III,Janis KB.Controversy and consensus regarding myosin II function at the immunological synapse[J].Curr Opin Immunol,2013,25(3) : 300-306.
[23]Kevin BL,Lin S,Freeman A,et al.The rap GTPases regulate B cell morphology,immune-synapse formation,and signaling by particulate B cell receptor ligands[J].Immunity,2008,28 (1) : 75-87.
[24]Freeman SA,Victor Lei,May Dang-Lawson,et al.Cofilin-mediated F actin severing is regulated by the Rap GTPase and controls the cytoskeletal dynamics that drive lymphocyte spreading and BCR microcluster formation[J].J Immunol,2011,187 (11 ) : 5887-5900.
[25]Bebhinn Treanor,David Depoil,Patricia Barral,et al.The membrane skeleton controls diffusion dynamics and signaling through the B cell receptor[J].Immunity,2010,32 (2) : 187-199.
[26]Meyer-Bahlburg A,Becker-Herman S,Humblet-Baron S,et al.Wiskott-Aldrich syndrome protein deficiency in B cells results in impaired peripheral homeostasis[J].Blood,2008,112 (10) : 4158-4169.
[27]Tsourkas PK,Baumgarth N,Simon SI,et al.Mechanisms of B cell synapse formation predicted by Monte Carlo stimulation[J].Biophys J,2007,92(12) : 4196-4208.
[28]Tsourkas PK,Longo ML,Raychaudhuri S.Monte Carlo study of single molecule diffusion can elucidate the mechanism of B cell synapse formation[J].Biophys J,2008,95(3) : 1118-1125.
[29]Stinchcombe JC,Salio M,Cerundolo V,et al.Centriole polarisation to the immunological synapse directs secretion from cytolytic cells of both the innate and adaptive immune systems [J].BMC Biol,2011,9(1) : 45.
[30]MARIA-Isabel Yuseff,Anne Reversat,Danielle Lankar,et al.Polarized secretion of lysosomes at the B cell synapse couples antigen extraction to processing and presentation[J].Immunity,2011,35(3) : 361-374.
[31]Noa Beatriz Martin-Cofreces,Francesc Baixauli,Francisco Sanchez-Madrid.Immune synapse: conductor of orchestrated organelle movement[J].Cell,2014,24(1) : 61-72.
[32]Stinchcombe JC,Giovanna Bossi,Sarah Booth,et al.The immunological synapse of CTL contains a secretory domain and membrane bridges[J].Immunity,2001,15(5) : 751-761.
[33]Wen-Jen Poo,Lisa Conrad,Janewy IR.Receptor-directed focusing of lymphokine release by helper T cells[J].Nature,1988,332 (6162) : 378-380.
[34]Stinchcombe JC,Endre Majorovits,Giovanna Bossi,et al.Centrosome polarization delivers secretory granules to the immunological synapse[J].Nature,2006,443(7110) : 462-465.
[35]Karine Chemin,Armelle Bohineust,Marie Tourret,et al.Cytokine secretion by CD4+T cells at the immunological synapse requires Cdc42 dependent local actin remodeling but not microtubule organizing center polarity[J].Immunol,2012,189 (5 ) : 2159-2168.
[36]Jin Xu,Toops KA,Fernando Diaz,et al.Mechanism of polarized lysosome exocytosis in epithelial cells[J].J Cell Sci,2012,125 (24) : 5937-5943.
[37]Abigail S Haka,Inna Grosheva,Ethan Chiang,et al.Macrophages create an acidic extracellular hydrolytic compartment to digest aggregated lipoproteins[J].Mol Biol Cell,2009,20 (23 ) : 4932-4940.
[38]Anne Aucher,Eddy Magdeleine,Etienne Joly,et al.Capture of plasma membrane fragments from target cells by trogocytosis requires signaling in T cells but not in B cells[J].Blood,2008,111(12) : 5621-5628.
[39]Etienne Joly,Denis Hudrisier.What is trogocytosis and what is its purpose?[J].NAT Immunol,2003,4(9) : 815.
[40]Kelia Delamarre,Margiit Pack,Henry Chang,et al.Differential lysosomal proteolysis in antigen-presenting cells determines antigen fate[J].Science,2005,307(5715) : 1630-1634.
[41]Lennon-Dumenil AM,Bakker AH,Maehr R,et al.Analysis of protease activity in live antigen-presenting cells shows regulation of the phagosomal proteolytic contents during dendritic cell activation[J].J Exp Med,2002,196(4) : 529-540.
[42]Pereira JP,Kelly LM,Cyster JG.Finding the right niche: B cell migration in the early phases of T dependent antibody responses [J].Int Immunol,2010,22(6) : 413-419.
[收稿2014-07-25修回2014-08-29]
(编辑许四平)
doi:10.3969/j.issn.1000-484X.2015.10.028
通讯作者及指导教师:杨桂连(1978年-),男,博士,副教授,硕士生导师,主要从事动物寄生虫免疫学研究,E-mail: yangguilian@ jlau.edu.cn。王春凤(1972年-),女,博士,教授,博士生导师,主要从事动物微生态与黏膜免疫的研究,E-mail: wangchunfeng@ jlau.edu.cn。
作者简介:王倩(1989年-),女,主要从事动物微生态与黏膜免疫的研究,E-mail: xiaowangqian1314@ 163.com。
文章编号1000-484X(2015) 10-1418-05
文献标志码A
中图分类号Q952.5
——水芹主要害虫识别与为害症状