可诱导共刺激分子配体上调Graves病动物免疫应答
余毅恺 冯业晨 张木勋 叶 丛 涂 巍(华中科技大学同济医学院附属同济医院风湿免疫科,武汉430030)
可诱导共刺激分子配体上调Graves病动物免疫应答
余毅恺冯业晨张木勋叶丛涂巍
(华中科技大学同济医学院附属同济医院风湿免疫科,武汉430030)
[摘要]目的:研究可诱导共刺激分子及配体(ICOS/ICOSL)在Graves病(以下简称甲亢,GD)中的病理生理机制。方法: 45只远交系BALB/c小鼠随机分成三组各15只,用基因枪将不同质粒注射。A组采用表达pCDNA3.0-mICOSL和pCDNA3.0-hTSHR的质粒免疫; B组用表达pCDNA3.0-hTSHR的质粒免疫,C组采用空质粒pcDNA3.0免疫作为对照组。放免法测定小鼠血清游离甲状腺素(FT4)、脾脏细胞上清液IFN-γ度,ELISA法血清促甲状腺素受体抗体(TRAb),小鼠血清和转染人hTSHR-CHO细胞共同孵育后检测cAMP浓度判断TRAb自身抗体活性。结果:质粒注射后A组小鼠血清FT4水平(0.49± 0.25) pg/ml高于C组(q= 6.571,P=0.023) ;成模达标率(10/15例)高于B、C两组(χ2= 14.47,P= 0.005)。A组小鼠脾脏原代培养上清液IFN-γ的产量(1.88±0.41) pmol/L明显高于B、C两组(F= 17.85,P= 0.003)。A组小鼠血清TRAb活性188.3 (179.7~260.2) %高于B、C组(P= 0.027)。结论:外源性导入pCDNA3.0-mICOSL到GD小鼠,能刺激其脾脏淋巴细胞分泌IFN-γ,增加自身抗体TRAb活性,从而上调GD动物体内免疫应答。
[关键词]ICOSL; Graves病; TSHR抗体;基因枪
①本文为2012年武汉科技局青年晨光计划资助项目(No.201 271031432)。
ICOSL could upregulate immune response in Graves's disease animal models
YU Yi-Kai,FENG Ye-Chen,ZHANG Mu-Xun,YE Cong,TU Wei.Department of Rheumatology and Immunology Tongji Hospital,Tongji Medical College of Huazhong University of Science and Technology,Wuhan 430030,China
[Abstract]Objective: To study the pathological mechanism of the inducible co-stimulator molecular and ligand (ICOS/ ICOSL) in Graves disease animal.Methods: 45 out-bred BALB/c mice were randomly divided into three groups with 15 rats in each group; using gene gun to deliver different plasmid injection.Group A was delivered with pCDNA3.0-mICOSL and pCDNA3.0-hTSHR,Group B with pCDNA3.0-hTSHR and null pCDNA3.0 with Group C for immunization as the control group.The concentration of serum free thyroxine immunization was deter mined with immunoassay and serum thyrotropin receptor antibody (TRAb) with ELISA,supernatant of IFN-γ concentration in mouse spleen cells was measured with radioimmunoassay,and hTSHR transected CHO cells were incubated to detect the concentration of cAMP to deter mine autoantibody TRAb activity.Results: After plasmid injection serum FT4 level in Group A (0.49±0.25) pg/ml (q= 6.571,P=0.023) was higher than that in Group C,the standard rate was higher than Group B and C (χ2= 14.47,P = 0.005) .IFN-γ concentration of mice spleen cultured supernatant in Group A (1.88±0.41) pmol/L was significantly higher than the other two groups.The activity of autoantibody TRAb in Group A 188.3 (179.7-260.2) % was higher than that in the other two groups(P=0.027) .Conclusion: Exogenous delivery of pCDNA3.0-mICOSL plasmid in GD mice could stimulate the spleen lymphocytes to secrete more IFN-γ,increase the activity of TRAb autoantibodies and might lead to upregulation of immune response in Graves animal model in vivo.
[Key words]ICOSL; Graves disease; TSHR autoantibody; Gene gun
GD是一种伴有甲状腺激素增高的自身免疫性疾病,发病机制为甲状腺细胞表面促甲状腺素受体(TSHR)部分脱落被外周血APC(抗原呈递细胞)摄取,降解为短肽和MHCⅡ分子结合于APC表面,形成第一信号(MHC-Ag肽信号)由TCR识别。共刺激分子和APC表面受体结合,形成第二信号[1]。经过上述“双信号和双识别”激活后,特异性T细胞活化并导致B细胞激活,产生促甲状腺激素受体抗体(TRAb)和TSHR结合,导致甲状腺激素水平增高和相应临床症状。新近发现一种属于B7分子超家族的可诱导共刺激分子(ICOS),其配体(ICOSL)表达在APC表面呈可诱导性。ICOS仅在活化和记忆性T细胞上表达和自身免疫性疾病关系密切。Yoshinaga[2]报道ICOSL-Fc过度表达的转基因小鼠可表现为人类Crohn病和高球蛋白血症的临床综合征。Hamel等[3]发现在ICOSL(-/-)的BALB/c模型小鼠,使用免疫佐剂诱导的类风湿关节炎症明显减轻。Her[4]报道在系统性红斑狼疮患者外周单核细胞ICOSL表达明显增高且和狼疮活动SLEDAI评分呈正相关。近来研究发现GD患者甲状腺组织ICOSL表达也明显增高[5,6]。
本研究分别用表达hTSHR和mICOSL的质粒免疫小鼠,检测自身抗体和脾脏细胞因子水平,试图评价增加ICOSL表达对GD动物免疫应答过程的影响。
1 材料与方法
1.1动物分组和造模4~6周远交系幼年雌性BALB/c鼠共45只购自华中科技大学同济医学院动物实验中心[SCXK(鄂) 2004-0007]。按照体重依次给每个动物编号,采用随机数字法分成3组每组15只: (1) ICOSL组(A组)同时注射pcDNA3.0-hTSHR和pcDNA3.0-mICOSL质粒; (2) TSHR组(B 组)注射pcDNA3.0-hTSHR质粒; (3) CLT组(C组)注射质粒pcDNA3.0作为空白对照。前期预试验发现,小鼠频繁取血后血清白蛋白可明显下降导致甲状腺素结合率降低影响血清FT4检测,故CTL组15只小鼠基线期即采血测定血清FT4。
1.2方法
1.2.1大量扩增制备质粒并制造基因枪子弹上述质粒大量扩增后,运用Tiangene公司质粒大提试剂盒提取并纯化。XbaⅠ和HindⅢ双酶切鉴定后测定纯度和浓度。其中金颗粒和Helios基因枪购自Biorad公司Biolistic PDS-1000/He,驱动类型高压氦气。包被DNA微粒制作具体步骤见参考文献。后腹部皮肤备皮后注射,剂量为10 μg质粒DNA/次/小鼠/子弹,基因枪压力为400 psi。
1.2.2测定小鼠血清FT4免疫动物后第2周肝素抗凝处理的毛细玻管于小鼠内眦静脉取全血。放射免疫法测定FT4,于核医学科采用DFM-96型10管放射免疫γ计数仪测定。血清室温放置后离心(15 min 3 500 r/min),弃上清液测定各管沉淀的放射性计数cpm。以S0(cpm数)为B0,各标准管(cpm数)为Bi,求各管的百分结合率(Bi/B0)。计算各标准点的结果在半对数坐标纸上,以标准品浓度为横坐标,以Bi/B0为纵坐标,绘制Bi/B0-Log图,从标准曲线上查出未知样品浓度,超过C组小鼠FT4均数+3倍标准差确认为甲亢造模成功[7]。
1.2.3测定小鼠脾脏匀浆液IFN-γ质粒免疫2周后将小鼠脾脏组织剪成1 mm3左右小块。分离后的脾脏原代细胞放置于24孔培养板中培养。培养条件为RPMI1640培养基+10%热灭活胎牛血清,2 mmol/L谷氨酰胺,1 mmol/L丙酮酸钠,50 μg/ml庆大霉素,50 μmmol/L β-硫氢基乙醇和100 U/ml青霉素。给予5 μg/ml刀豆素A(ConA IV Sigma公司,批号C2010,作为有丝分裂原可以刺激T淋巴细胞的增殖)和TSHR抗原(0.2 mU/ml)共同培养72 h后取培养上清液,5 000 r/min的速度下离心去除细胞沉渣。放射免疫法测定IFN-γ浓度。
1.2.4测定小鼠血清TRAb抗体滴度ELISA试剂盒购自德国EuroImmune公司(批号03051986 190)由我院内分泌实验室专职人员完成。试验步骤概括如下,以浓度为0~40 U/I的标准血清IgG为定标品,酶标仪于450nm测定样品吸光值,样本血清待测品TRAb浓度A(%) = (1-样品吸光值/阴性对照吸光值)×100,其中每个定标品样本均设复孔。A>25%判断抗体为阳性。
1.2.5测定小鼠血清TRAb抗体活性将转染hTSH的中国仓鼠卵巢细胞(以下简称hTSH-CHO)和小鼠血清共同培养72 h候收集上清,放免法测定cAMP浓度。试剂盒购至北京东亚医学研究所,于核医学科采用DFM-96型10管放射免疫γ计数仪测定。测定hTSHR-CHO细胞分泌上清液中cAMP浓度较正常对照血清的增幅来判断抗体的活性。计算公式= (实验cAMP浓度-对照cAMP浓度) /对照cAMP浓度×100%。
1.3统计学处理所有计量数据资料经正态分布和方差齐性检验后,采用单因素方差分析(ANOVA)比较组间有无显著性差异,随后两两样本均数间的比较采用Newman-Kelus分析。Kruskal-Wallis秩和检验比较非正态分布数据组有无间显著性差异,随后两两比较采用Dunn's多重检验。TRAb阳性率比较采用行×列表的卡方检验,如有统计学意义再行分割进行两两比较。P<0.05定义为统计显著性水准。所有统计分析采用SAS8.0软件。
2 结果
2.1小鼠血清FT4水平质粒注射后三组小鼠血清FT4浓度有差异(F=12.03,P=0.011),Newman-Keuls多重检验进行组间两两比较,ICOSL组(0.49±0.25) pg/ml和TSHR组(0.43±0.17) pg/ml明显高于CTL组(0.18±0.08) pg/ml(q= 6.571,P= 0.023; q= 5.211,P=0.034)。但是ICOSL和TSHR两组无显著性差异(q = 1.359,P = 0.460)。根据参考文献[7]GD动物造模成功标准为血清FT4浓度超过0.42 pg/ml (即CTL值+3倍标准差=0.18+0.08 ×3),ICOSL组和TSHR组达标分别10例和6例而CTL组为0。行×列表χ2检验显示ICOSL组高于其他两组(χ2=14.47,P=0.005),见图1。
2.2小鼠脾脏IFN-γ产量ANONA显示小鼠免疫2周后,脾脏细胞原代培养上清液IFN-γ浓度(F = 17.85,P=0.003)。D'Agostino&Pearson正态分布检验,IFN-γ呈正态分布ANOVA进行均数的组间比较。Newman-Kelus两两比较显示,ICOSL组浓度为(1.88 ±0.41) pmol/L明显高于TSHR组(1.54±0.28) pmol/ L(q=3.972,P=0.041)和CTL组(1.13±0.31) pmol/L (q=8.446,P=0.012)。见图2。
泪水盈满了我的双眸,这世界上最痛苦的事,莫过于知道了结局,却无法改变。我只有眺望远方,看看这江南最后的繁华。

图1 三组小鼠血清FT4水平比较Fig.1 Comparison of serum FT4 among three groups

图2 质粒免疫后脾脏组织匀浆IFN-γ浓度Fig.2 IFN-γ concentration of spleen homogenate after plasmid immunization
2.3小鼠自身抗体TRAb阳性率和活性比较ELISA法检测ICOSL和TSHR两组TRAb阳性例数分别为11和4,CTL组为0。Fiseher精确概率法显示ICOSL组阳性率高于TSHR组但无统计学差异(χ2=3.394,P=0.065)。
质粒免疫2周后取小鼠血清和hTSHR-CHO细胞培养后测定分泌上清液中cAMP浓度计算TRAb活性。Dunn's多重检验进行两两比较ICOSL组TRAb活性188.3(179.7,260.2) %明显高于TSHR 组162.2(60.7,170.5) %和CTL组88.6[(66.1,87.9) %,P=0.027],见图3。
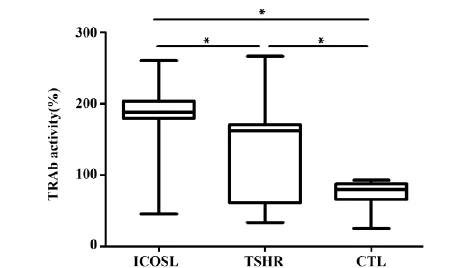
Note: The horizontal ordinate represents different groups and the longitudinal ordinate represents relative activity of serum auto-antibody TRAb.* .P<0.05.
3 讨论
Wang等[5]利用11C4、12B11和MIH12三种针对不同表位的ICOSL单抗进行组织学和流式细胞学检测时,发现在甲功正常和腺瘤患者甲状腺组织ICOSL表达极低,而在GD患者ICOSL表达明显增高。动物实验证实,ICOS/ICOSL系统过度活化可以导致免疫应答和自身抗体产生异常增强。抑制T细胞和APC之间的共刺激分子信号通路,能抑制GD小鼠体内免疫应答过程[8]。
本课题组在随访96例GD患者时发现,共刺激分子CD80 mRNA高表达和TRAb抗体持续阳性,都是GD预后不良危险因素(P = 0.034,OR = 3.089)。Logistic回归分析显示:影响GD预后的诸多危险因素中,CD80高表达仅次于TRAb,相关性高达0.79。
基因枪将外源基因,击中并高速穿透真空室中受体细胞膜,将吸附于微弹上的外源DNA导细胞导入机体,被惰性金属金颗粒包裹,缓慢释放获得整合与表达。在GD动物模型制备中,质粒DNA非外源蛋白质或减毒活疫苗注入,极少引起超敏反应(无一例动物注射质粒后死亡),可被皮下APC细胞摄取[9,10]。ICOSL表达质粒的加入能增加抗原呈递中“MHC-多肽双信号-双识别”的作用。
伍丽萍报道造模后GD小鼠50% TRAb水平增高,21.4%血清TT4增高且TT4增高的小鼠有不同程度的体重降低。我们已成功利用TSHR质粒诱导GD动物模型[11],本研究进一步发现增加GD小鼠ICOSL表达,2周后血清FT4为(0.49±0.25) pg/ml高于CTL组(0.18±0.08) pg/ml。虽然较TSHR组(0.43±0.17) pg/ml无显著性差异,但ICOSL组血清FT4水平超过CTL组3倍标准差例数为10例,明显高于TSHR组6例。
IFN-γ是一种促炎因子在自身免疫性疾病中起重要作用。Minelli[10]报道慢性丙型病毒性肝炎患者运用人重组干扰素治疗时,包括甲亢等多种自身免疫性甲状腺疾病发病率增高。ICOSL组小鼠脾脏细胞受到TSHR抗原刺激,上清液分泌INF-γ(1.88± 0.41) pmol/L明显高于TSHR组(1.54±0.28) pmol/ L和CTL组(1.13±0.31) pmol/L,说明在增加GD小鼠ICOSL表达后,能增强体内免疫应答过程。
未经治疗的GD患者TRAb阳性可高达91.7%,是临床评价疾病预后指标之[12]。虽然ICOSL和TSHR组的小鼠TRAb阳性率无显著性差异,但ICOSL组TRAb抗体活性188.3 (179.7,260.2) %明显高于CTL组88.6(66.1,87.9) %和TSHR组162.2(60.7,170.5) %。
质粒导入增加外源性ICOSL表达,增强GD小鼠免疫应答,表现TRAb自身抗体活性增高和脾脏分泌IFN-γ增多。若能阻断ICOS/ICOSL交联产生的共刺激信号,能否为治疗自身免疫性疾病特别是GD提供新的药物靶点,值得深入研究。本研究不足之处在于,未进一步观察Anti-ICOSL抗体注射后小鼠免疫应答下调的影响。由于Anti-ICOSL抗体价格昂贵,仅在预实验中应用了Anti-ICOSL(Protein Group Inc,Cat: 14922-1-AP,24 μg/150 ml)部分小鼠出现超敏反应导致死亡,故抗体种类和注射时机的选择还需要进一步摸索。
致谢:质粒pCDNA3.0-mICOSL和pCDNA3.0-hTSHR日本长歧大学Nagayama教授提供。
参考文献:
[1]Saverino D,Brizzolara R,Simone R,et al.Soluble CTLA-4 in autoimmune thyroid diseases: relationship with clinical status and possible role in the immune response dysregulation[J].Clin Immunol,2007,123(2) : 190-198.
[2]Yoshinaga SK,Whoriskey JS,Khare SD,et al.T-cell co-stimulation through B7RP-1 and ICOS[J].Nature,1999,402 (6763 ) : 827-832.
[3]Hamel KM,Cao Y,Olalekan SA,et al.B cell-specific expression of inducible costimulator ligand is necessary for the induction of arthritis in mice[J].Arthritis Rheumatol,2014,66(1) : 60-67.
[4]Her M,Kim D,Oh M,et al.Increased expression of soluble inducible costimulator ligand (ICOSL) in patients with systemic lupus erythematosus[J].Lupus,2009,18(6) : 501-507.
[5]Wang F,Zhu W,Liu T,et al.The expression analysis of ICOS-L on activated T cells and immature dendritic cells as well as malignant B cells and Grave's-disease-derived thyroid tissues by two novel mAbs against human ICOS-L[J].Tissue Antigens,2007,69(1) : 62-72.
[6]Wang F,Yan T,Chen L,et al.Involvement of inducible costimulator ligand (ICOSL) expression in thyroid tissue in hyperthyroidism of Graves' disease patients[J].J Clin Immunol,2012,32(6) : 1253-1261.
[7]Saitoh O,Mizutori Y,Takamura N,et al.Adenovirus-mediated gene delivery of interleukin-10,but not transfor ming growth factor beta,ameliorates the induction of Graves' hyperthyroidism in BALB/c mice[J].Clin Exp Immunol,2005,141(3) : 405-411.
[8]Chen CR,Aliesky HA,Guo J,et al.Blockade of costimulation between T cells and antigen-presenting cells: an approach to suppress murine Graves' disease induced using thyrotropin receptorexpressing adenovirus[J].Thyroid,2006,16(5) : 427-434.
[9]Flynn JC,Rao PV,Gora M,et al.Graves' hyperthyroidism and thyroiditis in HLA-DRB1* 0301 (DR3) transgenic mice after immunization with thyrotropin receptor DNA[J].Clin Exp Immunol,2004,135(1) : 35-40.
[10]Minelli R,Coiro V,Valli MA,et al.Graves' disease in interferonalpha-treated and untreated patients with chronic hepatitis C virus infection[J].J Investig Med,2005,53(1) : 26-30.
[11]余毅恺,张木勋,胡蜀红,等.基因枪注射Balb/c小鼠制备Graves模型[J].中国免疫学杂志,2008,24(8) : 737-739.
[12]Wall JR.Thyroid function.Pathogenesis of Graves ophthalm-opathy--a role for TSH-R[J].Nat Rev Endocrinol,2014,10(5) : 256-258.
[收稿2015-04-20修回2015-06-01]
(编辑许四平)
doi:10.3969/j.issn.1000-484X.2015.10.005
作者简介:余毅恺(1980年-),男,医学博士,主治医师,主要从事自身免疫性疾病的研究。
文章编号1000-484X(2015) 10-1320-04
文献标志码A
中图分类号R392