NF-κB P65 siRNA对IL-17诱导下MCP-1表达的影响作用
马 莉 沈 燕 (郑州大学第一附属医院检验科,郑州450052)
NF-κB P65 siRNA对IL-17诱导下MCP-1表达的影响作用
马莉沈燕(郑州大学第一附属医院检验科,郑州450052)
[摘要]目的:研究NF-κB P65 siRNA对IL-17诱导下心肌细胞MCP-1表达的影响作用。方法:差速贴壁法分离乳鼠心肌细胞进行原代培养。利用阳离子脂质体将NF-κB P65 siRNA瞬时转染入小鼠心肌细胞,荧光定量RT-PCR和酶联免疫吸附法(ELISA)分别检测NF-κB P65 siRNA对IL-17诱导下MCP-1 mRNA和蛋白的含量变化。荧光定量RT-PCR和Western blot检测IL-17作用下P-P65和P65 mRNA和蛋白含量变化。结果:与转染阴性对照siRNA组相比,转染阴性对照siRNA+IL-17组MCP-1 mRNA和蛋白表达水平明显增加(P<0.05)。与转染阴性对照siRNA组相比,转染NF-κB P65 siRNA组MCP-1 mRNA和蛋白表达水平明显降低(P<0.05)。与转染阴性对照siRNA+IL-17组相比,转染NF-κB P65 siRNA+IL-17组MCP-1 mRNA和蛋白表达水平明显降低(P<0.05)。NF-κB P65 siRNA转染24 h后,NF-κB P65在基因及蛋白水平表达均被明显抑制(P<0.05)。IL-17作用心肌细胞不同时间后,检测发现随时间增加P-P65蛋白含量逐渐增加,15 min到达高峰,随后逐渐下降,各作用时间与空白对照组比较,差异有统计学意义(P<0.05),而P65蛋白含量变化不大,各作用时间与空白对照组比较,差异无统计学意义(P>0.05)。结论: IL-17可以通过促进心肌细胞内NF-κB P65磷酸化上调MCP-1的表达,而NF-κB P65 siRNA能够通过沉默P65基因表达有效抑制IL-17对MCP-1的上调作用。
[关键词]白介素17;单核细胞趋化蛋白1;病毒性心肌炎;核转录因子kappa B ;小干扰RNA
Role of NF-κB siRNA in MCP-1 levels induced by IL-17 stimulation in cardiac myocytes
MA Li,SHEN Yan.Department of Clinical Laboratory Medicine,the First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
[Abstract]Objective: To investigate the effect of NF-κB p65siRNA of IL-17 inducing the expression of MCP-1 in the primary cultured cardiac myocytes.Methods: The cardiac myocytes were isolated from neonatal mice by different adhesion method.NF-κB P65 siRNA was transfected into cardiac myocytes and the rates of transcription and translation of MCP-1 were detected by RT-PCR and enzyme-linked immunosorbent assay(ELISA),the rates of transcription and translation of P-P65 and P65 were detected by RT-PCR and Western blot.Results: Compared with negative siRNA group,the expression of the MCP-1 at mRNA and protein levels were increased in negative siRNA +IL-17 group(P<0.05) .Compared with negative siRNA group,the expression of the MCP-1 at mRNA and protein levels were decreased in NF-κB P65 siRNA group(P<0.05) .Compared with negative siRNA+IL-17 group,the expression of the MCP-1 at mRNA and protein levels were decreased in NF-κB P65 siRNA+IL-17 group(P<0.05) .The expression of the NF-κB P65 at mRNA and protein levels in cardiac myocytes were specifically and extensively suppressed by NF-κB P65 siRNA(P<0.05) .After stimulated by IL-17,the amount of P-P65 in the cardiac myocytes was significantly increased in time-dependent manner compared with that of black group(P<0.05),but the levels of P65 changed little(P>0.05) .Conclusion: IL-17 stimulates MCP-1 expression in cardiac myocytes via NF-κB activation,and NF-κB P65 siRNA can effectively inhibit the upregulation of IL-17 on MCP-1.
[Key words]IL-17 ; MCP-1; VMC; NF-κB ; Small interfering RNA
IL-17是一种重要的促炎细胞因子,可以通过与相应的受体(IL-17R)结合,激活靶细胞产生各种炎症细胞因子,从而介导炎症细胞到达局部引起组织损伤[1]。我们前期研究发现单核细胞趋化因子-1 (Monocyte chemoattractant protein1,MCP-1)在病毒性心肌炎(Viral myocarditis,VMC)心肌组织单个核细胞浸润中起重要作用[2,3],并发现IL-17能够上调心肌细胞中MCP-1的表达[4],但是IL-17通过哪种转录因子及信号通路上调心肌细胞中MCP-1的表达目前尚不清楚。NF-κB是调控炎症反应的关键核转录因子[5],Chen等[6]研究发现IL-17可以激活巨噬细胞中NF-κB,Wang等[7]研究发现抑制大鼠系膜细胞中NF-κB的表达或激活可以抑制MCP-1的表达。但关于IL-17是否通过NF-κB上调心肌细胞中MCP-1表达尚未见文献报道。本研究通过利用RNA干扰技术特异性的抑制心肌细胞中NF-κB的表达,研究NF-κB siRNA对IL-17诱导心肌细胞中MCP-1表达的抑制作用,研究心肌细胞IL-17上调MCP-1中可能的转录因子,为病毒性心肌炎的防治提供一种新的生物治疗方法。
1 材料与方法
1.1材料
1.1.1动物1~3 d龄BALB/c乳鼠,SPF级实验动物,购于河南省实验动物中心。
1.1.2主要试剂胎牛血清、DMEM/F12培养基(Hyclone公司) ;胰酶、D-hank' s液、双抗溶液(Solarbio公司) ; 5-溴脱氧尿苷(Sigma公司) ;重组小鼠IL-17(Peprotech公司) ;小鼠MCP-1 ELISA检测试剂盒、核蛋白提取试剂盒、总蛋白提取试剂盒(武汉博士德公司) ; P65、P-P65和GAPDH抗体及二抗(Santa Cruz) ; Trizol试剂、PrimeScript逆转录试剂盒(日本TaKaRa公司) ;荧光定量PCR试剂(北京康为世纪生物科技有限公司) ; siRNA-MateTM转染试剂(上海吉玛基因生物) ;细胞培养瓶、细胞培养板(耐思生物科技有限公司) ; DEPC水、PCR一次性耗材(上海生工公司) ; PCR引物由上海生工生物工程有限公司合成。
1.2方法
1.2.1心肌细胞的分离与培养无菌条件下取3 d以内BALB/c乳鼠心脏,放入预冷的D-Hank's液平皿中冲洗,剪成1 mm3左右碎片后冲洗并移入内置磁性搅拌子的50 ml三角瓶中,瓶内加入10 ml 0.08%胰蛋白酶37℃80 r/min搅动10 min。首次悬液弃去以后所得细胞悬液用等量含20%胎牛血清的培养基中止消化,200目筛网过滤后1 000 r/ min 10 min后重悬,接种于培养瓶,5%CO2,37℃培养90 min进行差速贴壁。收集含有未贴壁的心肌细胞培养液,细胞计数,将细胞密度调整为(2×104~3×104) ml-1后接种于24孔培养板,培养3 d即可用于实验。
1.2.2 siRNA序列的设计合成siRNA由锐博生物科技有限公司设计合成,包括目的基因NF-κBP65 siRNA:正义链5-GGAGUACCCUGAAGCUAUATT-3,反义链5-UAUAGCUUCAGGGUACUCCAT-3阴性对照siRNA:正义链5-UUCUCCGAACGUGUCACGUTT-3,反义链5-ACGUGACACGUUCGGAGAATT-3。
1.2.3 siRNA-MateTM转染siRNA于原代心肌细胞
取3 μl 1 mol/L的siRNA oligo溶液加入到100 μl无血清DMEM/F12,孵育5 min后,加入2 μl siRNAMateTM形成siRNA oligo-siRNA-Mate复合物。将复合物滴加到更换过培养基的24孔板内37℃,CO2培养箱孵育24~48 h。
1.2.4实时荧光定量RT-PCR检测心肌细胞MCP-1和P65 mRNA含量按Trizol说明书操作方法提取心肌细胞总RNA,Nano-Drop2000紫外分光光度计检测RNA浓度和纯度。按照PrimeScript逆转录试剂盒操作说明书进行操作,以Olig(dt)为引物将总RNA逆转录为cDNA,以逆转录合成的cDNA为模板,进行PCR扩增。PCR反应条件: 94℃预变性5 min,94℃变性45 s,58℃退火45 s,72℃延伸1 min,30个循环,72℃延伸10 min。LightCycler 480检测并计算Ct值。扩增结束后,进行溶解曲线分析。采用相对定量的方法(2-△△Ct)来表示MCP-1 和P65的相对表达量。NF-κB-P65:上游引物5-TGATGTGCATCGGCAAGTG-3,下游引物5-AGAAGTTGAGTTTCGGGTAG-3; MCP-1:上游引物5-CGGAATTCGCCACCATGCAGGTCCCTGTCAT-3,下游引物5-GCTCTAGACTAGTTCACTGTCACACT-3; GAPDH:上游引物5-CTGCACCACCAACTGCTTAG-3,下游引物5-GTCTGGGATGGAAATTGTGA-3。
1.2.5 ELISA检测心肌细胞培养上清中MCP-1蛋白含量收集细胞培养上清,2 000 r /min离心15 min,-80℃保存待测。根据小鼠MCP-1 ELISA检测试剂盒操作说明书将标准品进行系列稀释,绘制标准曲线。将待测标本室温平衡,经加样,温育,洗板,显色等步骤后终止反应。用酶标仪450nm处测定各孔A值,通过标准曲线计算出待测标本中MCP-1的浓度。
1.2.6 Western blot检测P-P65和P65蛋白含量收集各组细胞,按试剂盒说明提取总蛋白和核蛋白后进行蛋白定量(BCA法)。取各样品30 μg加入上样缓冲液,95℃变性5 min,10%的变性聚丙烯酰胺凝胶电泳后转移到硝酸纤维素膜上,5%脱脂奶粉室温封闭2 h,一抗4℃孵育过夜后,加相应二抗孵育2 h,TBST洗涤10 min×3次后ECL法发光,暗室曝光、显影、洗片,软件分析条带灰度值。
1.3统计学方法用SSPS13.0统计软件建立数据库,计量资料结果用x ±s表示,组间比较用单因素方差分析及LSD-t检验,检测结果P<0.05为差异有统计学意义。
2 结果
2.1 NF-κB P65 siRNA转染心肌细胞后对IL-17诱导下MCP-1表达的影响作用与空白对照组相比,转染阴性对照siRNA组MCP-1 mRNA和蛋白表达水平无明显差异(P>0.05)。与转染阴性对照siRNA组相比,转染NF-κB P65 siRNA组MCP-1 mRNA和蛋白表达水平明显降低,差异有统计学意义(P<0.05)。与转染阴性对照siRNA组相比,转染阴性对照siRNA+IL-17组MCP-1 mRNA和蛋白表达水平明显增加,差异有统计学意义(P<0.05)。与转染阴性对

表1 ELISA检测心肌细胞MCP-1蛋白表达(x ±s,n=3)Tab.1 MCP-1 protein expression in cardiac myocytes detected by ELISA(x±s,n=3)

图1 逆转录荧光定量PCR检测心肌细胞MCP-1 mRNA表达Fig.1 MCP-1 mRNA expression in cardiac myocytes detected by FQ-RT-PCR

Note: 1.Blank group; 2.Negative siRNA group; 3.NF-κB P65 siRNA group; 4.Negative siRNA+IL-17 group; 5.NF-κB P65 siRNA+IL-17 group.Compared with Blank group,* .P>0.05; compared with Negative siRNA group,#.P<0.05; compared with NF-κB P65 siRNA group,Δ.P<0.05.
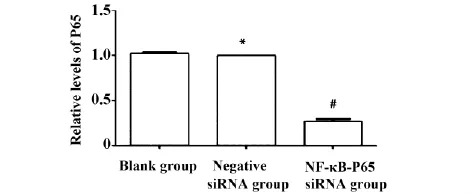
图3 荧光定量RT-PCR检测心肌细胞P65 mRNA表达Fig.3 P65 mRNA expression in cardiac myocytes detected by FQ-RT-PCR

图4 Western blot检测心肌细胞P65蛋白表达Fig.4 P65 protein expression in cardiac myocytes detected by Western blot
照siRNA+IL-17组相比,转染NF-κB P65 siRNA+IL-17组MCP-1 mRNA和蛋白表达水平明显降低,差异有统计学意义(P<0.05),详见表1、图1、2。
2.2 NF-κB P65 siRNA转染心肌细胞后对P65 mRNA和蛋白表达的影响作用与空白对照相比,转染阴性对照siRNA组P65 mRNA和蛋白表达水平无明显差异(P>0.05)。与转染阴性对照siRNA组相比,转染NF-κB P65 siRNA组P65 mRNA和蛋白表达水平明显降低,差异有统计学意义(P<0.05),见图3、4。
2.3心肌细胞中IL-17作用不同时间对P-P65和P65蛋白含量变化的影响P-P65蛋白含量随时间增加而逐渐增加,15 min到达高峰,随后逐渐下降,各作用时间与空白对照组相比,差异有统计学意义(P<0.05)。P65蛋白含量随时间增加变化不大,差异无统计学差异(P>0.05),见图5。
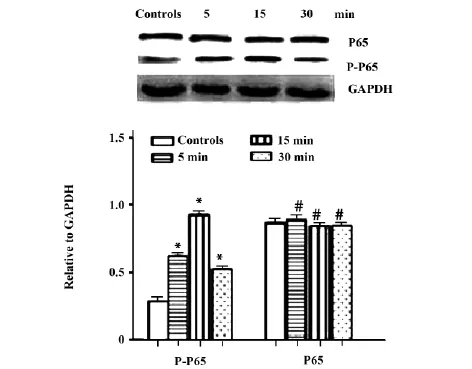
Note: Compared with controls,* .P<0.05; compared with controls,#.P>0.05.
3 讨论
VMC是病毒感染引起的弥漫性或局限性心肌炎性病变,由于其发病机制还不完全清楚,目前仍没有非常有效的治疗方式。通常认为在病毒感染初期,病毒可直接侵害心肌[8,9],但严重的持久的心肌病变却是由心肌细胞自身免疫介导的[10,11]。目前,在抗炎治疗的研究中细胞因子受到普遍关注,但单纯的拮抗炎性细胞因子效果并不佳,因此对其炎症信号通路进行研究,寻找可能的转录因子作为干预靶点极为重要。NF-κB在调控炎症反应相关基因转录中起关键作用,是目前研究的热点。静息状态下NF-κB与IκB结合,以无活性状态存在于胞浆内。当细胞受细胞外信号刺激后,IκB激酶复合体(IκB kinase,IKK)活化将IκB磷酸化使NF-κB暴露核定位位点。游离的NF-κB磷酸化后进入细胞核,与特异性DNA序列结合,诱导相关基因转录,只有激活的NF-κB才能参与炎症的基因调控。Gui等[12]研究证实,抑制NF-κB信号可明显缓解CVB3诱导的心肌炎。但关于IL-17是否通过NF-κB上调心肌细胞中MCP-1表达尚未见文献报道。
为了研究NF-κB在IL-17上调MCP-1中的作用,我们将小鼠心肌细胞中NF-κB P65沉默处理后再予以IL-17诱导,发现MCP-1在基因及蛋白水平均受到明显抑制,说明IL-17对MCP-1的上调作用能够被NF-κB P65 siRNA所抑制。同时利用RTPCR和Western blot分别检测NF-κB P65 siRNA干扰作用下P65的变化情况及与对照组的差异,发现NF-κB P65 siRNA的导入使小鼠心肌细胞中NF-κB P65在基因及蛋白水平均受到明显抑制,表明NF-κB P65 siRNA可以有效沉默P65基因的表达。为了研究IL-17对心肌细胞中NF-κB的激活作用,我们将小鼠心肌细胞用IL-17作用不同时间后分别检测P65和P-P65蛋白含量变化,发现P-P65蛋白含量随时间增加而逐渐增加,15 min到达高峰,随后逐渐下降,而P65蛋白含量无明显改变,表明IL-17是通过促进P65磷酸化而不是通过诱导P65表达来上调MCP-1表达的。综上我们推测在VMC炎症反应中NF-κB的活化对于调节IL-17诱导下MCP-1对心肌细胞的炎症损伤起关键作用,NF-κB P65 siRNA能够有效地抑制MCP-1的表达从而减轻心肌细胞的损伤,为VMC免疫性损伤的治疗提供了新的思路。
有研究报道IL-17可以通过多条信号传导途径激活NF-κB[13,14],我们推测ACT1/TRAF6/TAK1信号传导途径是IL-17上调MCP-1表达的最可能的信号传导通路,而具体实际情况尚需更深入的研究。总之,研究IL-17上调心肌细胞MCP-1表达的信号通路,可以为我们进一步揭示VMC的发病机制提供重要依据,为临床治疗提供新的思路。
参考文献:
[1]Yang J,Sundrud MS,Skepner J,et al.Targeting Th17 cells in autoimmune diseases[J].Trends Pharmacol Sci,2014,35 (10) : 493-500.
[2]沈燕,陈瑞珍,储以微,等.CVB3感染通过MCP-1介导病毒性心肌炎小鼠单个核细胞迁移[J].中国免疫学杂志,2005,21 (5) : 325-328.
[3]Shen Y,Zhang FQ,Wei X.Truncated monocyte chemoattractant protein-1 can alleviate cardiac injury in mice with viral myocarditis via infiltration of mononuclear cells[J].Microbiol Immunol,2014,58(3) : 195-201.
[4]刘艳月,李燕燕,王珊珊,等.IL-17对心肌细胞单核细胞趋化蛋白-1表达的影响[J].细胞与分子免疫学杂志,2012,28(2) : 163-166.
[5]Bhatt D,Ghosh S.Regulation of the NF-κB-mediated transcription of inflammatory genes[J].Front Immunol,2014,5(71) : 1-9.
[6]Chen J,Liao M,Gao X,et al.IL-17A induces pro-inflammatory cytokines production in macrophages via MAPKinases,NF-κB and AP-1[J].Cell Physiol Biochem,2013,32(5) : 1265-1274.
[7]Wang J,Zhao Y,Chen S,et al.AOPPs induce MCP-1 expression by increasing ROS-mediated activation of the NF-κB pathway in rat mesangial cells: inhibition by sesquiterpene lactones[J].Cell Physiol Biochem,2013,32(6) : 1867-1877.
[8]Huber M,Watson KA,Selinka HC,et al.Cleavage of RasGAP and phosphorylation of mitogen-activated protein kinase in the course of coxsackievirus B3 replication[J].J Virol,1999,73 (5 ) : 3587-3594.
[9]Luo H,Yanagawa B,Zhang J,et al.Coxsackievirus B3 replication is reduced by inhibition of the extracellular signal-regulated kinase (ERK) signaling pathway[J].J Virol,2002,76(7) : 3365-3373.
[10]Castellano G,Affuso F,Di Conza P,et al.Myocarditis and dilated cardiomyopathy: possible connections and treatments[J].J Cardiovasc Med(Hagerstown),2008,9(7) : 666-671.
[11]Rose NR.Myocarditis: infection versus autoimmunity[J].J Clin Immunol,2009,29(6) : 730-737.
[12]Gui J,Yue Y,Chen R,et al.A20(TNFAIP3) alleviates CVB3-induced myocarditis via inhibiting NF-kappaB signaling[J].PLoS One,2012,7(9) : e46515.
[13]Cortez DM,Feldman MD,Mummidi S,et al.IL-17 stimulates MMP-1 expression in primary human cardiac fibroblasts via p38 MAPK-and ERK1/2-dependent C/EBP-beta,NF-kappaB,and AP-1 activation[J].Am J Physiol Heart Circ Physiol,2007,293 (6) : H3356-H3365.
[14]Huang F,Kao CY,Wachi S,et al.Requirement for both JAK-mediated PI3K signaling and ACT1/TRAF6/TAK1-dependent NF-kappaB activation by IL-17A in enhancing cytokine expression in human airway epithelial cells[J].J Immunol,2007,179(10) : 6504-6513.
[收稿2015-04-02修回2015-05-14]
(编辑倪鹏)
doi:10.3969/j.issn.1000-484X.2015.10.008
通讯作者及指导教师:沈燕(1966年-),女,教授,硕士生导师,主要从事临床分子诊断与免疫学方面研究,E-mail: shenyan62687@ 163.com。
作者简介:马莉(1990年-),女,主要从事临床分子诊断与免疫学方面研究,E-mail: 18446940@ qq.com。
文章编号1000-484X(2015) 10-1333-05
文献标志码A
中图分类号R392.11