维生素C对DC细胞功能调控影响研究①
贾 原 李文丽 李 芳 赵 晴 张俊萍(山西医学科学院山西大医院肿瘤内二科(生物治疗),太原030032)
维生素C对DC细胞功能调控影响研究①
贾原李文丽李芳赵晴张俊萍②
(山西医学科学院山西大医院肿瘤内二科(生物治疗),太原030032)
[摘要]目的:探讨维生素C(VC)对树突状细胞(DC)的影响,并检测DC细胞成熟情况,为快速制备DC疫苗提供一种可行方法及思路。方法:采集健康志愿者外周血50 ml,用淋巴细胞分离液分离外周血PBMC,贴壁后获得单核细胞。用不同浓度VC对DC进行孵育(24 h),后经PBS洗涤,并设立空白对照组(V0)。流式细胞仪检测DC表面共刺激分子CD80/86及HLA-DR,CD40表达情况。通过设置VC浓度梯度及时间梯度,考察VC对DC刺激的最佳浓度及最佳成熟时间,同时分析VC促进DC成熟的原因。结果: VC可显著刺激DC细胞成熟,其CD80/86表达较未添加VC组有明显提升。且本研究显示VC刺激DC的最佳浓度为1 mmol/L,当DC培养至第三天时,VC组CD80/86表达率为(78.6±4.6) %,而空白对照组V0仅为(34.1±5.7) %; DC表面HLA-DR表达: VC(56.8±4.4) %,空白对照组V0为(25.4±4.7) %,两组差异有统计学意义,P<0.05;进而我们考察了VC对DC细胞CD40、CD40L表达情况,结果显示,VC 2.5 mmol/L组CD40表达率最高可达(59.3±3.7) %,V0组仅为(11.1±2.4) %,说明VC可显著调节DC表面CD40的表达。而CD40L表达调节并未体现。荧光显微镜结果显示VC-DC抗原捕获能力显著提升。结论: VC可显著调控DC成熟,并可能通过上调CD40进而促进CD80/86及HLA-DR的表达,当VC浓度为1 mmol/L时,对DC调控作用最强。
[关键词]维生素C;树突状细胞;表面共刺激分子; CD40
①本文受山西省生物治疗示范平台项目资助(No.2014091105-0101)。
Regulation impact of vitamin C in DC function
JIA Yuan,LI Wen-Li,LI Fang,ZHAO Qing,ZHANG Jun-Ping.Department of Medical Oncology(Cancer Bio-Therapy),Shanxi Academy of Medical Sciences,Taiyuan 030032,China
[Abstract]Objective: To study the influence of vitamin C (VC) on dendritic cells (DC),and detect DC maturation,to provide a feasible method and thought for quickly preparating DC vaccines.Methods: Collected the peripheral blood (about 50 ml) from healthy volunteers,and isolated peripheral blood mononuclear cells with lymphocyte separation medium and obtain DC.With stimulating with different concentrations of VC for (24 h),then washed with PBS,and set up blank control group (V0) .The expression of DC surface costimulating molecules CD80/86 and HLA-DR,CD40 was detected by flow cytometry.By setting the concentration gradient and time gradient,exciting optimal concentration and stimulating time of VC on DC,and analyzed the reasons of VC promoting DC maturation.Results: VC could effectively stimulate DC,CD80/86 expression had significantly increased contrast to the blank control group(V0) .And the experiments show that VC’s best stimulating concentration was 1 mmol/L,and on the third day,the CD80/86 expression rate of VC group was (78.6±4.6) %,and blank control group V0 was (34.1±5.7) %.DC surface HLA-DR expression: VC (56.8±4.4) %,blank control group V0 (25.4±4.7) %,the difference between two groups was statistically significant,P<0.05.CD40 and CD40L expression and results show that VC 2.5 mmol/L group of CD40 expression rate up to (59.3±3.7) %,while V0 group was only (11.1±2.4) %,that illustrate VC could significantly regulate CD40 expression on DC surface,but CD40L not reflect.Fluorescence microscope results showed that DC’s antigen catching ability was also significantly promoted.Conclusion: VC can significantly regulate DC maturity,and may up regulate CD40,thus promoting the express of CD80/86 and HLA-DR.When the concentration is 1 mmol/L,VC expresses the strongest regulation function on DC.
[Key words]Vitamin C; Dendritic cell (DC) ; Co-stimulating molecular; CD40
维生素C是人体所必需的一类小分子营养物质,它可确保机体功能正常发挥及免疫功能稳定。研究显示[1],高浓度的维生素C富集于多种免疫细胞中,包括:嗜中性粒细胞、巨噬细胞、B淋巴细胞和T淋巴细胞等,扮演“抗氧化剂”作用以对抗机体氧自由基[2],且因感染及炎症而快速消耗,表明VC可能是维持自发免疫及获得性免疫稳定的一个重要因素。另外,VC还可提升淋巴细胞的增殖能力及NK细胞的自然杀伤活性[3,4]。而May等[5]另一项研究显示,VC也可增加嗜中性粒细胞及巨噬细胞抗菌活性,但对于T淋巴细胞数量却未见影响。Noh[6]另据报道显示,迟发型超敏反应(DTH)发生会因VC含量缺乏而减弱,而对VC进行补充后,DTH反应又会恢复至正常水平。
另有细胞免疫研究显示,对于Gulo(-/-)基因缺陷型小鼠(L-古洛糖酸内酯氧化酶基因缺陷型小鼠,突变可能导致部分动物无法合成Vc)[7],VC可促进免疫反应向Th1细胞分化,进而促进IFN-γ、TNF-α的产生,当VC缺乏时可能导致小鼠炎症的发生。而随着VC的持续补充,Th1型免疫反应显著提升,同时小鼠体内IgG1、IgE以及Th2型免疫细胞抗体明显下降,而一种Th1型免疫相关抗体IgG2C含量也会显著提高,并且会提升DTH反应强度[7,8],表明VC会显著影响CD4+细胞亚群分化。另据Hwang[4]报道,VC还可促进外周血CD8+记忆性T细胞增殖[4]。但VC如何对免疫进行调控,其机制目前尚不明了。
树突状细胞(DC)是功能最强的抗原提呈细胞(APC)。当免疫共刺激分子,如CD80、CD86等在DC细胞表面高表达时,DC细胞可快速提呈抗原信息,发挥免疫功能,刺激T淋巴细胞成熟[9,10]。同时,DC的成熟与分化还与细胞天然免疫Toll样受体(TLR)密切相关。研究报道,作为氧化剂的H2O2可显著刺激DC细胞成熟、分化,并上调CD4+免疫反应[11,12]。那么作为抗氧化剂的VC(抗坏血酸)对DC细胞成熟与分化是否有影响? VC如何调控DC细胞发挥免疫调控作用?其细胞表面共刺激分子如何表达?本文将就此展开研究。
1 材料与方法
1.1试剂耗材维生素C(VC)购自Sigma,rhGMCSF、rhIL-4、rhTNF-α(Peprotech公司),10%胎牛血清(杭州四季青),RPMI1640(Scientific公司),FITC标记CD86mAb,PE标记CD80mAb,APC标记MHCⅡDR,FITC标记CD40mAb,PE标记CD40L(CD154) mAb,Ficoll分离液(天津市灏洋生物制品科技有限责任公司)。
1.2仪器设备倒置显微镜(奥林巴斯),CO2细胞培养箱(Thermo),台式冷冻离心机(湖南湘智),台式高速离心机(Eppondorf),流式细胞仪(BD公司),生物安全柜(新加坡ESCO)。
1.3主要方法
1.3.1细胞分离采集健康志愿者外周血与PBS按照1∶4混合均匀,将稀释后的血液以1∶1比例缓慢加入淋巴细胞分离液上方,4℃2 000 r/min离心15 min。小心吸取单个核细胞层,加入另一离心管中,并用4倍体积PBS洗涤1 000 r/min离心5 min,离心去除淋巴细胞分离液。PBS洗涤两次后,即获得外周血单核细胞。
1.3.2 DC细胞培养外周血单核细胞悬浮于1640培养基中,调整浓度为108ml-1,于48孔细胞培养板上贴壁。在37℃、5%CO2培养箱中贴壁培养3~6 h后,收集悬浮细胞,贴壁细胞PBS荡洗两次后为DC前体细胞,于显微镜下观察计数,加入1640培养基: GM-CSF(800 U/ml)和IL-4(1 000 U/ml),细胞浓度约为106ml-1并继续培养。
1.3.3实验组设置于48孔板细胞培养液中加入不同浓度VC,浓度梯度为0 μmol/L、100 μmol/L、250 μmol/L、500 μmol/L,1 mmol/L、2.5 mmol/L。贴壁的DC前体细胞洗涤后,加入上述浓度VC(RPMI1640,10%FBS,GM-CSF 800 U/ml和IL-4 1 000 U/ml)孵育24 h,洗涤,之后培养液RPMI1640,10%FBS,GM-CSF 800 U/ml和IL-4 1 000 U/ml培养。
1.3.4 CD80、CD86、CD40、CD40L (CD154)以及HLA-DR表达分析DC细胞经吹洗后悬浮,用FITCCD86mAb、PE-CD80mAb、APC-HLA-DR、FITCCD40mAb、PE-CD40L(CD154) mAb标记DC 30 min之后上流式细胞检测仪进行检测分析。
1.3.5荧光倒置显微镜观察VC-DC抗原捕获能力
NY-ESO-1是目前证实最具免疫原性的肿瘤-睾丸抗原(CT-Antigen)之一,其155~167位点是其发挥免疫原性的核心抗原决定簇。本项目组将NY-ESO-1155-167与荧光素FITC共价合成,与VC-DC孵育2 h后洗涤(10 ng/ml),并在荧光显微镜下观察。通过荧光灰度检测,对比未加VC培养的DC细胞荧光强度。
1.4统计学分析应用SPSS21系统分析软件进行分析。数据均以x ±s表示,两样本均数的比较采用配对的t检验,多样本均数的比较采用方差分析,方差不齐用秩和检验,检验水准α=0.05。P<0.05为差异有统计学意义。
2 结果
2.1形态学观察较之未添加VC实验组,DC培养过程中加入VC可显著提升DC的成熟速度及分化程度。细胞形态学观察显示,随着培养时间的延长,DC表现为细胞悬浮生长,体积变大,树突状分化显著(第三天) (如图1A~D),同时呈现出对VC的浓度依赖性。2.2 VC可上调DC表面CD80、CD86表达氧化还原(Redox)调节反应是细胞内一种普遍的调节方式。研究显示,在H2O2存在情况下,可刺激DC细胞表面共刺激分子CD80、CD86表达[11]。而在本研究中,我们对比了不加VC(空白对照)及不同浓度VC下DC细胞表面二类共刺激分子标志CD80、CD86表达情况影响。结果显示,VC可显著促进DC表面二类分子CD80、CD86表达(图2A、B),并呈现浓度依赖正相关性。同时本实验还显示,VC对DC细胞CD80/86调节最佳浓度约为1 mmol/L,作用时间约为3 d,成熟度CD80/86可达(78.6±4.6) %(图2C)。
2.3 VC可刺激APC细胞表面MHCⅡ分子DR表达
在机体的抗肿瘤免疫反应中,细胞免疫发挥主要的效应。CD8+的细胞毒性T细胞(CTL)是有效抗肿瘤细胞免疫的核心[4],而这与DC息息相关。未成熟的DC能通过内吞作用高效的捕捉抗原,胞内加工处理后与MHCⅠ、MHCⅡ形成复合体,再提呈于DC表面,为激活抗原特异性的T淋巴细胞提供必需的第一信号[8-10]。因此我们考察了VC对DC细胞表面MHCⅡ类分子DR表达影响。结果显示,VC可显著刺激MHCⅡ分子DR表达(P<0.05) (图3A、B),并呈现VC浓度依赖性及作用时间依赖性,当VC浓度达到1 mmol/L(处理24 h),培养3 d后DC表达MHCⅡDR达到(56.8±4.4) %(图3B、C)。
2.3 VC可上调DC表面CD40表达进而我们做了CD40及CD154表达情况,结果显示(图4),DC细胞表面CD40表达随着VC作用浓度增加而呈现梯度依赖性,而CD154并没有显示此特性(P<0.05),说明VC促进DC细胞成熟可能通过上调CD40表达进而刺激B7-1(CD80)、B7-2(CD86)及MHCⅡDR表达。
2.4 VC-DC抗原捕获能力显著提升将1 mmol/ L VC培养3 d的DC与未加VC培养的DC抗原捕获能力相比较,利用FITC标记的NY-ESO-1155-167与DC细胞共孵育2 h,洗涤两次后经荧光倒置显微镜观察,发现VC-DC其荧光强度显著高于未经VC刺激的DC(图5A~D) (细胞浓度106ml-1)。通过荧光灰度检测显示,VC-DC捕获抗原能力显著高于未经刺激的DC(图5E),说明VC不仅可促进DC细胞成熟,同时也可促进DC细胞的抗原捕获及提呈能力。
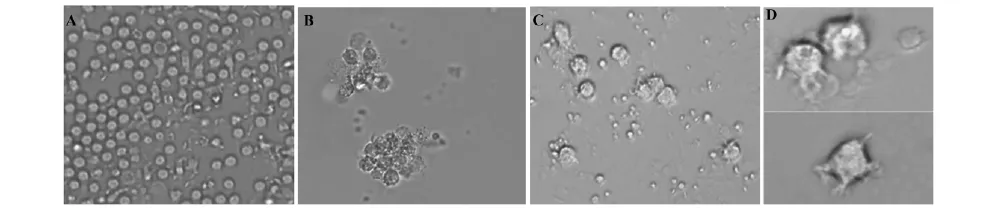
图1 DC细胞形态观察(×200)Fig.1 DC cell morphological observation(×200)

图2 VC对DC细胞共刺激分子CD80/86调控影响Fig.2 Regulation effect of VC to stimulation molecules CD80/86 on DC
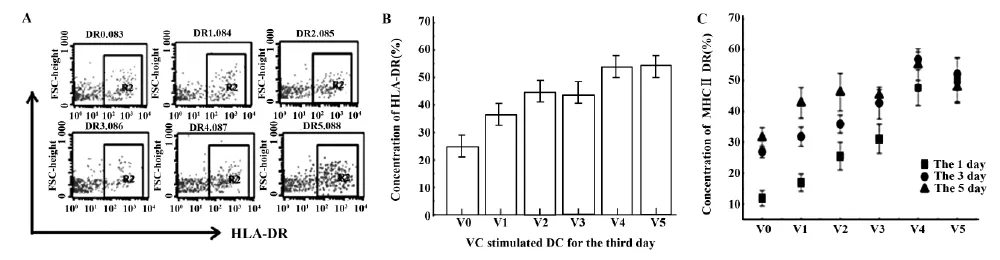
图3 VC对DC细胞表面HLA-DR调控影响Fig.3 Regulation effect of VC to HLA-DR on DC
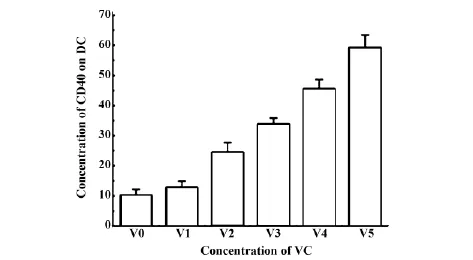
图4 VC对DC表面CD40调控影响Fig.4 Regulation effect of VC to CD40 on DC
3 讨论

Note: A.DC cells on microscope; B.DC cells on fluorescence microscope with no peptides; C.The antigen capturing ability of VC-DC to FITC-peptide; D.The antigen capturing ability of DC with none VC to FITC-peptides; E.The detection of Fluoresent gray level on DC of Fig.C and D.VC= 1 mmol/L,peptides= 10 ng/ml,2 h.
维生素C是一种有效防止氧化损伤的抗氧化剂,可清除细胞内氧化自由基(O2-)[4]。生理范围下,维生素C在血清中含量一般在70~100 μmol/L。研究显示,静脉注射3 g维生素C,其受注者血清中VC的含量可达到1 700 μmol/L,但是如果患者口服相同剂量,血液中VC含量仅达220 μmol/L[6]。本实验证明在高浓度VC(2.5 mmol/L)影响下DC细胞依然可保持生理活性,较之生理浓度要显著高出很多,因此我们认为高剂量的VC(如文中1 mmol/ L)对于联合放化疗治疗癌症是一种途径。
据研究显示VC可作为一种抗肿瘤前体物质调控肿瘤细胞凋亡及抑制生长,大剂量的VC(约5 mmol/L)可引起肿瘤细胞的凋亡,当黑色素瘤细胞B16F10暴露在VC中时[13,14],VC可引起细胞色素C释放进而引起线粒体酶减少。又有研究显示,VC可通过下调CD71(转铁蛋白)的表达进而降低细胞对金属离子(铁离子)的摄入,后者被认为是维持肿瘤细胞活性的必要因素之一[15];而低剂量的VC(小于1 mmol/L),又可通过调节Chk2-p53-p21Waf1/ Cip1途径以及影响细胞膜上受体生长因子,如胰岛素样生长因子(IGF) -1等来抑制肿瘤细胞增殖[16]。且对于VC的抗肿瘤机制又有了新的发现,VC可以通过抑制血管内皮生长因子(VEGF)的表达而抑制肿瘤血管生成[16]。而另据Chen等[17]研究认为VC抗肿瘤机制可能是VC会释放游离过氧化氢,直接作用于肿瘤细胞DNA干扰肿瘤细胞周期,诱导肿瘤细胞凋亡。但VC作为免疫调控物质的研究却鲜有报道。
CD80、CD86是DC细胞表面共刺激分子,作为重要的第二信使可刺激T淋巴细胞发挥功能,因此CD80、CD86的上调意味着DC功能的成熟[12]。研究显示CD80、CD86受CD40-CD40L调控,并成正相关[9]。本文证明VC可有效调控DC细胞成熟,当浓度为1 mmol/L时,对DC表面共刺激分子CD80、CD86,MHCⅡDR及CD40表达有显著上调作用,很可能VC通过上调CD40的表达进而刺激CD80、CD86及MHCⅡ表达,以增强DC抗原捕捉、提呈等功能。同时本研究证明VC处理最佳浓度为1 mmol/L时,DC最佳培养时间为3 d,较之传统DC培养方法7 d显著缩短时间,可用于快速制备DC疫苗。
而另一方面,H2O2等氧化剂可显著上调DC细胞的分化程度,那么作为抗氧化剂的VC为何也能上调DC分化及活性?就VC而言,存在两种形式,还原态(抗坏血酸)及氧化态(脱氢抗坏血酸,DHA),并且能在二者之间快速循环,这个过程中可能产生大量的游离O2-自由基,进而上调DC活性。但对于VC调控DC细胞的分子机制以及VC的免疫反应,特别是对T淋巴细胞的调控机制还需进一步详细的研究。
参考文献:
[2]Hartel C,Puzik A,Schultz C,et al.Immunomodulatory effect of vita min C on intracytoplasmic cytokine production in neonatal cord blood cell[J].Neonatology,2007,91(11) : 54-60.
[3]Bergsten PG,Amitai M,Levine,et al.Millimolar concentrations of ascorbic acid in purified human mononuclear leukocytes.Depletion and reaccumulation[J].Biol Chem,1990,265(3) : 2584-2587.
[4]Young-Joo Jeong,Jin-Hee Kim,Young-il Hwang,et al.Vita min C treatment of mouse bone marrow-derived dendritic cells enhanced CD8+memory T cell production capacity of these cells in vivo[J].Immunobiology,2014,219(7) : 554-564.
[5]May JM,Huang J,Qu ZC,et al.Macrophage uptake and recycling of ascorbic acid: response to activation by lipopolysaccharide[J].Free Radic Biol Med,2005,39(11) : 1449-1459.
[6]Noh K,Lim H,Hwang YI,et al.Mega-dose Vita min C modulates T cell functions in Balb/c mice only when ad ministered during T cell activation[J].Immunol Lett,2005,98(10) : 63-72.
[7]Kim H,Bae S,Lee WJ,et al.The analysis of vita min C concentration in organs of gulo(-/-) mice upon vita min C withdrawal[J].Immune Netw,2012,12(10) : 18-26.
[8]Singh UP,Parthasarathy,Mohan G.In-vitro antioxidant and antihyperlipidemic activities of Blumea eriantha DC[J].Pak J Pharm Sci,2014,27(6) : 1961-1965.
[9]Ma DY,Clark EA.The role of CD40 and CD40L in dendritic cells [J].Semin Immunol,2009,21(5) : 265-272.
[10]Banchereau J,Briere F,Palucka K,et al.Immunobiology of dendritic cells[J].Annu Rev Immunol,2000,18(8) 18: 767-811.
[11]Olivier Preynat-Seauve,Sylvia Coudurier,Christian Villiers,et al.Oxidative stress impairs intracellular events involved in antigen processing and resentation to T cells[J].Cell Stress and Chaperones,2003,8(2) : 162-171.
[12]Thorén FB,Betten A,Romero AI,et al.Antioxidative properties of myeloid dendritic cells: protection of T cells and NK cells from oxygen radical-induced inactivation and apoptosis[J].Immunology,2007,12(179) : 179: 21-25.
[13]Levine MY,Wang J,Morrow,et al.A new recommended dietary allowance of vita min C for healthy young women[J].Proc Natl Acad Sci USA,2001,98(5) : 9842-9846.
[14]Cho D,Hahm E,Lee WJ,et al.Vitamin C downregulates interleukin-18 production by increasing reactive oxygen intermediate and mitogen-activated protein kinase signalling in B16F10 murine melanoma cells[J].Melanoma Res,2003,13(41) : 549-554.
[15]Padayatty SJ,Sun HY,Wang SM,et al.Vitamin C pharmacokinetics: implications for oral and intravenous use[J].Ann Intern Med,2004,140(15) : 533-537.
[16]Kang JS,Cho D,Hwang WJ,et al.Sodium ascorbate (vitamin C) induces apoptosis in melanoma cells via the down-regulation of transferring receptor dependent iron uptake[J].Cell Physiol,2005,204(11) : 192-197.
[17]Chen Q,Espey MG,Sun AY,et al.Aseorbate in pharmacologic concentrations selectively generates aseorbate radical and hydrogen peroxide in extracellular fluid in vivo[J].Proc Natl Acad Sci USA,2007,104(21) : 8749-8754.
[收稿2015-04-20修回2015-06-24]
(编辑倪鹏)
doi:10.3969/j.issn.1000-484X.2015.10.006
作者简介:贾原(1983年-),男,技师,主要从事肿瘤免疫治疗方面研究,E-mail: john83629@ sina.com。
通讯作者②,E-mail: junpingzhang_118@163.com。
文章编号1000-484X(2015) 10-1324-05
文献标志码A
中图分类号R392-3