体外溶栓试验确定急性脑梗死治疗中rt-PA用量的研究
赵惠荣 元小冬 王秀艳 韩富红 郑秀芬 邓红亮 张 健河北联合大学附属开滦总医院 唐山 063000 河北唐山工人医院 唐山 063000
体外溶栓试验确定急性脑梗死治疗中rt-PA用量的研究
赵惠荣1)元小冬1)王秀艳1)韩富红2)郑秀芬1)邓红亮1)张 健1)
1)河北联合大学附属开滦总医院 唐山 063000 2)河北唐山工人医院 唐山 063000
目的 应用体外溶栓试验确定急性脑梗死重组组织型纤溶酶原激活剂(rt-PA)溶栓剂量,了解个体化rt-PA治疗的有效性及安全性。方法 对发病6h内的急性脑梗死(ACI)患者,根据体外溶栓试验中处于溶栓状态的rt-PA剂量作为个体化溶栓治疗剂量,进行溶栓治疗,监测患者溶栓前及溶栓后24h自然状态体外血栓长度、湿质量,并于溶栓前和溶栓后2h、24h、10d进行临床神经功能缺损评分,监测并发症,并与非溶栓组比较。结果 不同患者应用rt-PA溶栓治疗剂量不同,介于0.6~0.8mg;不同浓度rt-PA状态下体外血栓长度不同,随浓度增加呈逐渐缩短趋势(P<0.05);溶栓后24h体外血栓长度、湿质量与溶栓前相比均降低(P<0.05);2组患者治疗前NIHSS评分差异无统计学意义(P>0.05),治疗后NIHSS评分均呈下降趋势,溶栓组溶栓后各时间点NIHSS评分均低于非溶栓组(P<0.05);全部病例均无出血并发症发生。结论 应用体外溶栓试验确定rt-PA用量行急性脑梗死个体化溶栓治疗安全有效。
急性脑梗死;rt-PA;体外溶栓试验
重组组织型纤溶酶原激活剂(rt-PA)静脉溶栓是急性脑梗死最有效的治疗方法之一。但对于溶栓药的剂量尚存争议,目前国内外研究多集中在人为设定药物剂量进行溶栓,其安全性、有效性报道不一,且rt-PA价格昂贵,3h有限的时间窗,限制了其在临床的广泛应用。体外溶栓试验是进行溶栓药物的量效关系体外监测的一项简单易行的敏感方法。有研究报道应用体外溶栓试验指导急性脑梗死尿激酶静脉溶栓治疗安全有效[1],但尚无应用体外溶栓试验指导rt-PA静脉溶栓治疗的报告。本研究旨在通过体外溶栓试验来确定急性脑梗死个体化rt-PA溶栓剂量,并观察临床神经功能缺损程度变化,以期为临床制定急性脑梗死的rt-PA个体化溶栓治疗方案提供理论依据。
1 对象与方法
1.1 研究对象 选择2011-01-2011-12在我院神经内科住院,符合入选标准及排除标准的40例急性脑梗死患者,根据家人知情同意与否,随机将患者分为溶栓组与非溶栓组。(1)溶栓组20例,男18例,女2例;年龄43~65岁,平均55.80岁。(2)非溶栓组20例,男16例,女4例;年龄35~70岁;平均58.20岁。2组年龄、性别比较差异无统计学意义(P>0.05)。入选标准:(1)年龄18~70岁;(2)发病时间在6h内急性脑梗死;(3)无昏迷等严重意识障碍者;(4)脑CT扫描已排除颅内出血,且无早期脑梗死低密度改变及其他明显早期脑梗死改变;(5)患者或家属签署知情同意书。排除标准:(1)既往有颅内出血;(2)心房纤颤,可疑脑栓塞者;(3)近3个月内有头颅外伤、脑梗死或心肌梗死;(4)近期有消化道出血、手术、创伤等;(5)严重心、肾、肝功能不全或严重糖尿病;(6)有出血倾向或出血性疾病史;(7)收缩压>180mmHg(1mmHg=0.133kPa)或舒张压>110mmHg;(8)正在使用抗凝剂;(9)血小板计数<100×109/L;(10)妊娠。
1.2 研究方法
1.2.1 体外溶栓实验方法:患者入院后即刻抽取静脉血6mL分别注入6个专用体外血栓测定硅胶管(每个注入1mL),分别为:①不加任何药物和溶液;②加入生理盐水0.1mL;③按患者体质量计算的rt-PA浓度为0.5mg/kg的溶液0.1mL;④按患者体质量计算的rt-PA浓度为0.6mg/kg的溶液0.1mL;⑤按患者体质量计算的rt-PA浓度为0.7mg/kg的溶液0.1mL;⑥按患者体质量计算的rt-PA浓度为0.8mg/kg的溶液0.1mL。血栓测定仪测定上述6种状态的体外血栓模型形态学指标:湿质量、血栓长度,同时记录体外血栓处于溶栓状态(呈絮状,无成形的血栓形成)时,所加入rt-PA浓度值(即0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg)。
1.2.2 治疗方法:rt-PA剂量=体外溶栓试验rt-PA浓度(mg/kg)×患者体质量(kg)。依据此剂量将rt-PA加入至等比例(1mg:1mL)的专用溶液中行静脉溶栓治疗,其中10%静脉推注>1min,其余90%加生理盐水100mL,静滴1h以上。在rt-PA治疗过程中及治疗后24h内必须严密监测生命体征和意识水平。患者如出现严重头痛、恶心和呕吐,停止使用rt-PA,即刻复查头CT。
1.2.3 观察指标:①溶栓前行体外溶栓试验,分别测定6个管中血栓的长度、湿质量。②溶栓后24h对自然状态下的体外血栓长度、湿质量进行测量。③溶栓组与非溶栓组分别于治疗前、治疗后2h、24h、10d进行神经功能缺损(NIHSS)评分。
1.3 统计学方法 使用SPSS 13.0软件包进行统计分析,计量资料以均数±标准差表示,采用t检验,计数资料以百分率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 rt-PA体外溶栓试验各种状态时的体外血栓形态学特征 自然状态组与生理盐水组体外血栓湿质量、长度比较,差异无统计学意义(P>0.05),而不同rt-PA浓度组随rt-PA浓度增加,其血栓湿质量、长度逐渐减小(P<0.05)。见表1、图1。
表1 溶栓治疗组rt-PA体外溶栓试验结果 (±s)

表1 溶栓治疗组rt-PA体外溶栓试验结果 (±s)
血栓指标 自然状态 生理盐水 0.5mg/kg 0.6mg/kg 0.7mg/kg 0.8mg/kg湿质量(mg) 40.98±8.46 36.88±14.76 10.00±5.80 5.15±3.88 2.60±3.23 0.78±1.87长度(mm) 10.60±3.37 11.50±4.63 4.83±1.92 2.98±1.92 1.81±1.36 0.49±0.91

图1 体外模拟血栓大体结构
2.2 溶栓组溶栓前和溶栓后24h体外血栓测量结果 溶栓组溶栓后24h的体外血栓长度、湿质量均明显低于溶栓前(P<0.05),见表2。
表2 溶栓组溶栓前和溶栓后24h体外溶栓试验测量结果 (±s)
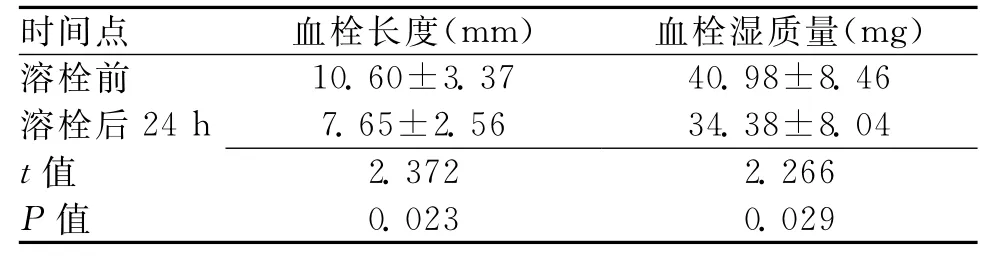
表2 溶栓组溶栓前和溶栓后24h体外溶栓试验测量结果 (±s)
时间点 血栓长度(mm) 血栓湿质量(mg)溶栓前10.60±3.37 40.98±8.46溶栓后24h 7.65±2.56 34.38±8.04 t值2.372 2.266 P值0.023 0.029
2.3 溶栓组和非溶栓组不同时间点NIHSS评分情况 2组患者治疗前NIHSS评分差异无统计学意义(P>0.05),溶栓组在治疗后2h、24h、10dNIHSS评分呈明显下降趋势,与溶栓前NIHSS评分比较,差异均有统计学意义(P<0.05)。对照组在治疗后2h、24h、10dNIHSS评分呈逐渐下降趋势,与治疗前比较,治疗后10dNIHSS评分差异有统计学意义(P<0.05),溶栓组与对照组NIHSS评分在治疗后不同时间点差异均有统计学意义(P<0.05或P<0.01)。见表3。
表3 2组治疗前后不同时间点NIHSS评分情况 (±s)

表3 2组治疗前后不同时间点NIHSS评分情况 (±s)
组别 溶栓前 溶栓后2h溶检后24h溶检后10d溶栓组9.85±4.04 7.80±3.96 6.80±40.2 4.20±3.07非溶栓组 10.25±3.93 10.50±4.19 10.24±4.29 8.00±5.02 t值0.317 2.097 2.624 2.890 P值0.753 0.043 0.012 0.007
2.4 并发症 溶栓组和非溶栓组均未发生颅内出血、再梗死及死亡病例。
3 讨论
急性脑梗死严重危害人类健康,给社会和家庭带来了沉重的负担,循证医学指南A级推荐缺血性脑卒中首选治疗措施为发病3h内应用rt-PA静脉溶栓治疗,但其溶栓药物剂量尚存争议,北美和欧洲国家多采用rt-PA 0.9mg/kg的溶栓剂量。日本的J-ATCⅡ试验尝试将rt-PA溶栓剂量减少到0.6mg/kg[2]。国内研究以rt-PA 0.9mg/kg和0.7mg/kg进行溶栓治疗,结果差异无统计学意义[3];静脉应用不同剂量rt-PA 0.6~0.8mg/kg和0.9mg/kg,对预后的影响无显著学差异[4]。另有研究以rt-PA 50mg/例剂量进行溶栓治疗,结果证实相对安全有效[5]。目前国内外大多学者应用溶栓药物时人为设定药物剂量,不考虑脑梗死的诸多病因、病变部位及大小、复杂的病理生理改变及影响预后的各种因素[1],因此rt-PA溶栓治疗的安全性和有效性大打折扣。本研究应用体外溶栓试验可以直观不同rt-PA浓度时体外血栓的溶解情况,寻找到血栓恰好溶解的浓度来确定rt-PA个体化溶栓剂量,结果显示,不同患者应用rt-PA溶栓治疗剂量不同,介于0.6~0.8mg,与黄勇[6]研究结果相似。
研究表明,高纤维蛋白原血症是脑梗死发病的主要危险因素[7]。rt-PA的溶栓机制为其单链分子在靠近纤维蛋白-纤溶酶原相结合的部位结合于纤维蛋白上,使纤溶酶原转化为纤溶酶,促使局部的纤维蛋白溶解,从而达到溶栓目的[8]。对于急性脑梗死患者溶栓治疗时,进行溶栓药物的体外溶栓试验是一项简单易行的敏感方法。其在自然状态下的体外血栓长度和湿质量是反映人体血液形成血栓危险性的综合性指标,同时后者又是临床进行血液稀释和溶栓治疗时的一项较灵敏的监测指标[9]。本研究中溶栓后24h自然状态下体外血栓湿质量、长度均明显低于溶栓前(P<0.05),以上结果表明溶栓后血液形成血栓危险性降低,证实体外溶栓试验指导下的rt-PA溶栓是有效的,与体外溶栓试验可以用于临床指导急性脑梗死动态溶栓治疗报道相一致[10]。可见应用体外溶栓试验确定rt-PA用量进行急性脑梗死溶栓治疗安全有效。
[1]邓红亮,元小冬,王广增,等.体外溶栓试验确定急性脑梗死治疗中尿激酶用量的研究[J].临床神经病学杂志,2005,18(5):341-343.
[2]Mori E,Minematsu K,Nakaqawara J,et al.Effects of 0.6 mg/kg intravenous alteplase on vascular and clinical outcomes in middle cerebral artery occlusion:Japan Alteplase Clinical TrialⅡ(J-ACTⅡ)[J].Stroke,2010,41(3):461-465.
[3]王雪里红,曾红,樊琨,等.重组组织型纤溶酶原激活剂早期静脉溶栓对急性脑梗死的疗效[J].中华神经科杂志,2006,39(10):678-683.
[4]闫立荣,孙玉衡.不同剂量重组组织型纤溶酶原激活剂静脉溶栓治疗对超早期急性脑梗死预后的影响[J].中国卒中杂志,2008,3(11):808-813.
[5]王克英,王雪里红,左鹰,等.急性脑梗死早期静脉溶栓治疗的临床研究[J].中国急救医学,2004,24(10):734-735.
[6]黄勇.超早期脑梗死不同溶栓药物剂量疗效差异[J].中外医学研究,2011,9(23):28-29.
[7]吴峰,马西.纤维蛋白单体聚合反应的光学检测方法[J].中华血液学杂志,1994,15(1):42.
[8]李家秦主编.临床药理学[M].2版.北京:人民卫生出版社,1998:984.
[9]元小冬,米振洲,刘秀荣,等.急性脑梗死溶栓治疗药物量效关系体外监测试验[J].华北煤炭医学院学报,2000,2(1):4-7.
[10]范云,元小冬.急性脑梗死体外溶栓试验血栓超微结构研究[J].脑与神经疾病杂志,2008,16(4):317-319.
(收稿2014-07-18)
Study of vitro thrombolytic test on the consumption of rt-PA in thrombolytic therapy of acute cerebral infarction
Zhao Huirong*,Yuan Xiaodong,Wang Xiuyan,Han Fuhong,Zheng Xiufen,Deng Hongliang,Zhang Jian
*Kailuan Affiliated General Hospital of Hebei United University,Tangshan063000,China
Objective To study the effect of vitro thrombolytic test on the consumptions of rt-PA in thrombolytic therapy of acute cerebral infarction and to understand the effectiveness and safety of the clinical individual thrombolytic therapy.Methods The patients with acute cerebral infarction within 6honset were treated with rt-PA at the dose determined by rt-PA under thrombolytic activity via vitro thrombolytic test.The wet-weight and length in natural state were monitored before thrombolysis and after 24hthrombolysis.The Neural function defect(NIHSS)was assessed before and after 2h,24h,10dthrombolytisis.Results The rt-PA dose was different in different patients,normally between 0.6-0.8mg;vitro thrombus length was different in different rt-PA concentrations;the length of vitro thrombus gradually reduced with the concentration increasing(P<0 05).The length and wet-weight of vitro thrombus after 24hthrombolysis became lower than that before therapy.There was no significant difference between two groups in NIHSS scores before treatment(P>0.05).The NIHSS scores became lower compared with pretreatment.At each time point after thrombolysis,NIHSS scores of thrombolysis group were lower than the non-thrombolysis group(P<0.05).All patients had no bleeding complications.Conclusion It is safe and effective of vitro thrombolytic test to confirm the consumption of rt-PA for thrombolytic therapy in acute cerebral infarction patients.
Acute cerebral infarction;rt-PA;Vitro thrombolytic test
R743.33
A
1673-5110(2015)13-0015-02

