黑龙江省不同纬度耕作土壤中可培养细菌群落结构解析
王 淼,王继华,张雪萍,周小倩 (哈尔滨师范大学生命科学与技术学院,黑龙江哈尔滨 150025)
土壤是微生物的大本营,是其生长繁殖的天然培养基。土壤中存活着种类极其丰富的微生物类群,主要分为土壤细菌、土壤放线菌和土壤真菌。土壤中以群落形式存在的微生物不仅是土壤养分、有机质循环和转化的动力,而且影响着土壤的结构、肥力以及地上植物的健康[1]等。土壤微生物群落结构组成及活性变化是衡量土壤质量、维持土壤肥力和作物生产力的重要指标之一。它是土壤生物区系中最重要的功能组分。土壤微生物对环境变化的敏感性也决定它可能首先受到环境变化影响的群体,使其与土壤微生物相关的一系列过程受到影响[2-4]。
黑龙江省作为全国粮食生产大省,农业生产具有举足轻重的地位。对于耕作土壤的研究更为有意义。该研究样地土壤类型均为暗棕壤。暗棕壤作为东北地区主要土壤类型之一,其生物活性指标、肥力指标等变化对于指导耕作及提高耕作土壤肥力具有重要意义。
1 材料与方法
1.1 研究区域与样地概况 黑龙江省位于我国最北部,属温带、寒温带大陆性季风气候,南北纵跨中温带与寒温带两个温度带。塔河位于黑龙江省北部(123°19~125°48'E,52°9'~53°23'N),属寒温带大陆性气候,年平均气温 -5℃,年均降雨量428 mm。带岭地处黑龙江省伊春市(128°48'~128°55'E,47°57'~47°14'N),处于欧亚大陆东缘,深受海洋气候的影响,具有明显的温带大陆性季风气候特征,年平均气温-0.3℃,年均降雨量676 mm。帽儿山位于黑龙江省尚志市境内(127°30'~127°34'E,45°20'~45°25'N),气候属于大陆性季风气候,年平均气温2.7℃。供试耕作土壤类型均属暗棕壤(图1)。
1.2 样品的采集与处理 2012年9月,在上述3个地区的耕地土壤中设置4个样方(10 m×10 m)。在每个样方内随机设6个采样点,采集0~15 cm土壤,混合,去除植物残体和石子,过2 mm筛,均匀分成3份:一份置于4℃冰箱冷藏保存,并尽快进行微生物群落特征分析;一份置于-20℃冰箱,冷冻(备用);第3份置于室内自然条件风干,磨碎,过100目孔径筛,用于土壤理化性质的测定。黑龙江省3个地区耕地土壤的基本性质见表1。
1.3 测定方法
1.3.1 土壤理化性质的测定。对各采样点土样,采用常规土壤理化性质分析法[5-6]测定土壤有机质、全氮、全磷、速效钾、速效磷含量和pH。
1.3.2 土壤微生物的分离、纯化与鉴定。采用传统稀释涂平板法对12个土样中细菌进行分离,并对其数量进行测定。分离培养基为LB培养基[7]。对所得细菌进行个体形态观察及生理生化试验,依据经典微生物学分类方法,结合细菌的形态学、生理学及生态学特征,并且参照《伯杰细菌手册》(第八版)[8]进行鉴定。
1.3.3 数据处理。通过Shannon多样性指数(H')、Pielou均匀度指数(J)、Margalef丰富度指数(R)和Simpson优势度指数(C)[9],对细菌种群多样性水平进行分析。
式中,Pi为第i种的个体数占总个体数的比例,可以用Pi=Ni/N求出;Ni为第i种物种个体数;N为总个体数;S为每个样品中的物种总数。
1.3.4 统计分析。数据的方差、标准误差和相关性分析均采用SPSS 17.0软件进行,显著性水平设置为P<0.05。聚类分析树形图应用PRIMER 5软件进行分析绘制。
典型对应分析主要按照以下步骤进行:①由除趋势对应分析(Detrended correspondence analysis,DCA)得出种属的单峰响应值(梯度长度SD),当SD的数值大于2时即可进行CCA分析;②测试各环境变量的边界效应,每次只包含一个环境变量的CCA分析,研究单个环境变量对可培养细菌种类的影响,即所谓的边界效应;③环境变量的重要性按照其单独解释属种数据的方差值大小排序,解释的显著性由Monte Carlo 测试来检验[10-12]。
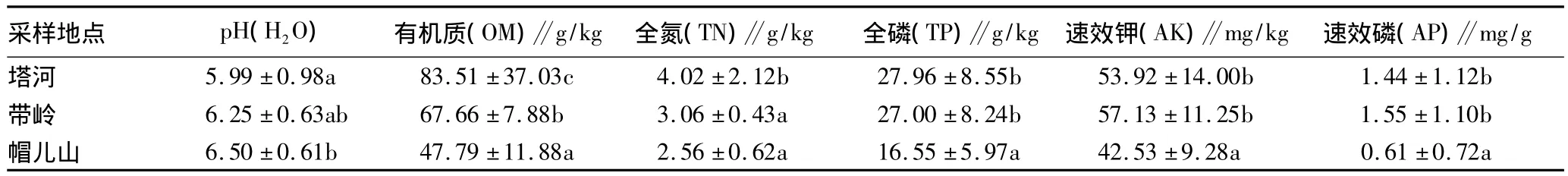
表1 黑龙江省3个地区耕地土壤的基本理化性质
2 结果与分析
2.1 黑龙江省耕作土壤中可培养细菌的种类与数量组成特点 由图2可知,随纬度的降低,塔河、带岭、帽儿山3个样地耕地土壤中可培养细菌数量降低,塔河耕地土壤中可培养细菌显著高于带岭与帽儿山样地(P<0.05),分别比带岭和帽儿山高30.53%和52.67%。
通过对黑龙江省3个地区的12个样地土壤细菌的分离、纯化,并经生理生化试验鉴定,发现所得细菌分属于29个种属(图3)。不同地区耕作土壤可培养细菌的种群组成和结构存在一定的差异。各可培养细菌属种在不同地区耕作土壤中的优势度也有所不同。
塔河样地耕地土壤中可培养细菌分属15个种属。固氮菌属(Azotobacte)、芽孢杆菌属(Bacillus)与芽孢八叠球菌属(Sporosarcina)是塔河供试土壤类群中数量最多的类群,分别占可培养细菌总数的28.97%、16.27%和11.90%,是该土壤中的优势种群;而微球菌属(Micrococcus)、假单胞菌属(Pseudomomas)、葡萄球菌属(Staphylococcus)、土壤杆菌属(Agrobacterium)、动性球菌属(Planococcus)、气球菌属(Aerococcus)、片球菌属(Pediococcus)、不动杆菌属(Acinetobacter)分别占供试土壤可培养细菌总数的9.13%、8.33%、7.54%、5.75%、4.76%、1.59%、1.59%和 1.59%,是该土壤中的亚优势种群;其他菌属(副球菌属(Paracoccus)、氮单胞菌属(Azomonas)、链球菌属(Streptococcus)及利斯特氏菌属(Liste-ria))是塔河供试土壤中的稀有种群。
带岭耕地土壤中可培养细菌分属于20个种属。芽孢杆菌属、固氮菌属、不动杆菌属、副球菌属是带岭供试土壤类群中数量最多的类群,分别占可培养细菌总数的30.97%、16.54%、11.93%和 10.22%,是该土壤中的优势种群;而芽孢八叠球菌属、微球菌属、葡萄球菌属、土壤杆菌属、假单胞菌属、黄杆菌属(Flavobacterium)、短状杆菌属(Brachybacterium)和气微菌属(Aeromicrobium)分别占供试土壤可培养细菌总数的 7.54%、4.14%、3.16%、3.16%、2.92%、2.19%、1.95% 和1.22%,是该供试土壤中的亚优势种群;其他菌属(变形菌属(Proteus)、葡糖杆菌属(Gluconobacter)、放线杆菌属(Actinobacillus)、气单胞菌属(Aeromonas)、发光杆菌属(Photobacterium)、利斯特氏菌属、黄单胞菌属(Xanthomonas)和柠檬酸细菌属(Citrobacter))是带岭供试土壤中的稀有种群。
帽儿山耕地土壤中可培养细菌分属于18个种属。芽孢杆菌属、微球菌属、假单胞菌属、固氮菌属是帽儿山供试土壤类群中数量最多的类群,分别占可培养细菌总数的34.45%、13.01% 、12.48% 和 11.60%,是该供试土壤中的优势种群;而芽孢八叠球菌属、黄单胞菌属、不动杆菌属、气单胞菌属、利斯特氏菌属、动性球菌属、动胶菌属(Zoogioea)和微杆菌属(Microbacterium)分别占供试土壤可培养细菌总数的 6.85%、5.80%、3.51%、2.28%、2.11%、2.11%、1.05%和1.05%,是该供试土壤中的亚优势种群;其他菌属(副球菌属、变形菌属、片球菌属、土壤杆菌属、短杆菌属(Brevibacterium)和短小杆菌属(Curtobacterium))是帽儿山供试土壤中的稀有种群。
2.2 黑龙江省不同地区耕作土壤中可培养细菌组成的相似性 由图4可知,3个样地土壤样品可培养细菌种群的相似性系数为61.11% ~70.59%,表明土壤样品之间存在差异性。当相似性系数为61.11%时,供试的3个样地土壤可明显分为2组。其中,组1包括帽儿山和塔河土样,组2为带岭土样。这说明帽儿山耕作土壤可培养细菌与塔河土样之间的亲缘关系最近,而与带岭耕作土壤中可培养细菌种群差异较大,同源性较低。帽儿山样地与塔河样地土壤中可培养细菌组成的相似性较高,相似系数为70.59%,而带岭样地土壤中可培养细菌组成与之相似性则较低,与帽儿山和塔河样地的相似性分别为63.16%和61.11%。
2.3 不同地区耕作土壤可培养细菌多样性特点 不同的多样性指数可反映土壤微生物群落多样性的不同方面。Shannon多样性指数是反映群落物种及其个体数与分布均匀度的指标;均匀度指数是群落物种均一性的指标[13-15]。由表2可知,不同地区耕作土壤可培养细菌的多样性水平存在差异。帽儿山样地土壤可培养细菌的多样性与丰富度指数均最高,分别为1.84和1.86,在0.05水平显著高于塔河样地与带岭样地。3个样地土壤可培养细菌的均匀度指数和优势度指数均无显著性差异。均匀度指数趋势为塔河>带岭=帽儿山,优势度指数趋势为带岭>塔河>帽儿山。

表2 黑龙江省不同地区耕作土壤可培养细菌种群的多样性指数
2.4 土壤可培养细菌种类与环境因子对应关系的CCA分析 DCA分析显示,塔河、带岭和帽儿山土壤可培养细菌群落梯度长度分别为2.332、3.998和2.862,表明黑龙江省这3个地区耕地土壤可培养细菌群落对生态梯度的响应是非线性的,因此利用非线性响应模型(CCA)来分析环境因子对土壤可培养细菌群落的影响是比较适宜的。
塔河样地CCA分析的前两轴特征值分别为0.46和0.38,种类与环境因子排序轴的相关系数均达到1.00,说明排序图很好地反映土壤可培养细菌与环境因子之间的关系。该排序图的前两轴解释了塔河耕作土壤可培养细菌群落变异程度的76.3%。由此可知,排序轴的前两轴能够真实地反映环境因子对细菌种属分布的影响程度,且与环境因子的相关性轴1 大于轴2。轴1 与 AK、TP、AP、TN、OM 呈0.05 水平显著负相关,而轴2只与OM呈0.05水平显著负相关,与pH呈现0.05水平显著正相关。从箭头的长度可以看出,环境因子对可培养细菌分布的相关性大小为AP>OM>TN>TP>AK>pH。从箭头与轴1的夹角可以看出,环境因子与可培养细菌种属相关性的大小为OM>TN>TP>AP>AK>pH。物种之间的线段距离长短代表了物种之间的亲缘关系。由图5可知,固氮菌属和链球菌属,葡萄球菌属和不动杆菌属,固氮菌属和芽孢杆菌属,利斯特氏菌属和土壤杆菌属,链球菌属、动性球菌属和气球菌属分布差异较小。
带岭样地CCA分析的前两轴特征值分别为0.69和0.58,种类与环境因子排序轴的相关系数均达到1.00。该排序图的前两轴解释了带岭耕作土壤可培养细菌群落变异程度的71.8%,能够真实地反映环境因子对细菌种属分布的影响程度,与环境因子的相关性轴1大于轴2。轴1与AK、TP、AP、TN呈0.05水平显著正相关,而轴2与AK、AP呈0.05水平显著负相关,与TN呈0.05水平显著正相关。环境因子对可培养细菌分布的相关性大小为TN>AK>TP>AP>pH>OM,环境因子与可培养细菌种属相关性的大小为AP>AK>OM>pH>TP>TN。由图6可知,葡糖杆菌属、黄杆菌属和气微菌属、固氮菌属和不动杆菌属,短状杆菌属、葡萄球菌属、黄单胞菌属和利斯特氏菌属,副球菌属和土壤杆菌属,以及芽孢八叠球菌属、微球菌属、假单胞菌属、发光杆菌属、放线杆菌属、变形菌属、柠檬酸细菌属、气微菌属之间的亲缘关系较远。
帽儿山样地CCA分析的前两轴特征值分别为0.43和0.17,种类与环境因子排序轴的相关系数均达到1.00。该排序图的前两轴解释了带岭耕作土壤可培养细菌群落变异程度的89.9%,细菌种属分布与环境因子的相关性轴1大于轴2。轴1与AK呈0.05水平显著负相关,而与TN呈0.05水平显著正相关,而轴2与AK、AP、OM、pH值呈0.05水平显著负相关。环境因子对可培养细菌分布的相关性大小为TN>AK>OM>pH>AP>TP,环境因子与可培养细菌种属相关性的大小为TN>AK>OM>pH>AP>TP。由图7可知,芽孢杆菌属、微球菌属、假单胞菌属和黄单胞菌属,固氮菌属和利斯特氏菌属,以及变形菌属、片球菌属、短小杆菌属、短杆菌属、土壤杆菌属和微杆菌属之间的亲缘关系较远。
3 结论与讨论
3.1 耕作土壤可培养细菌群落组成特征 通过对塔河、带岭和帽儿山3个地区耕作土壤可培养细菌的分离,发现固氮菌属和芽孢杆菌属是3个样地耕作土壤中可培养细菌的共同优势类群,表现出对环境普适性。不同地区耕作土壤中的可培养细菌种类组成、数量和分布具有较大的差异,气球菌属、氮单胞菌属和链球菌属是从塔河样地耕作土壤中分离得到的特有的可培养细菌种属,黄杆菌属、短状杆菌属、气微菌属、葡糖杆菌属、放线杆菌属、发光杆菌属、柠檬酸细菌属是带岭样地所分离得到的特有细菌种属,帽儿山样地所特有的可培养细菌为短小杆菌属、短杆菌属、微杆菌属与动胶菌属。特有类群对环境因子的耐受性较小。由于环境的异质性使其分布于不同的地区,因此3个不同地区耕作土壤中均有各自特有的可培养细菌类群。这与慕乐艳等[9]对黑龙江省药用植物根际土壤真菌的种群结构各区系分布特点研究结果基本一致。特有类群生态适应性弱,只有在一定环境条件下才能生存,因此能够反映环境的差异,对环境的变化具有一定的指示作用。由此可见,对于不同地区耕地土壤可培养细菌的研究,应着重分析特有类群,进行土壤特有种群与环境关系的研究,从而更好地对耕作土壤肥力变化趋势进行评价。
虽然塔河、带岭与帽儿山纬度相差较大,但三者耕作土壤可培养细菌组成的相似性较高,分别为70.59%、63.16%和61.11%。这可能是由于3个样地土壤类型均为暗棕壤,而土壤类型是决定土壤微生物群落结构的主要因素,相同土壤类型的土壤微生物群落结构也相似[16-19]。
3.2 耕作土壤可培养细菌多样性特点 多样性指数是土壤微生物群落多样性的重要指标,由物种的丰富度和物种的均匀度两个部分组成[20]。Shannon多样性指数、Evenness均匀度指数、Margalef丰富度指数和Simpson优势度指数是研究生物多样性的重要指标。它们与土壤环境影响密切相关。该研究对4项多样性指数进行分析,发现不同理化性质的耕作土壤可培养细菌的多样性存在差异。通过相关性分析,发现多样性指数、丰富度指数和均匀度指数有着密切的关系,对物种群落特征具有一致性的反映。塔河样地耕作土壤有机质含量最高,可培养细菌数量也最高。这与胡亚林等[21]研究结果一致。塔河样地土壤可培养细菌的丰富度指数为0.81,高于带岭、帽儿山样地。这也是由于塔河样地耕作土壤有机质含量较高,而土壤对微生物的缓冲能力较强,均匀度指数随土壤有机质含量的增加而增加[22]。土壤中微生物群落越复杂、越丰富,则土壤生态系统越稳定,系统的生态功能越高,对外界环境变化的缓冲能力效应越强。研究中,帽儿山样地耕作土壤可培养细菌的多样性指数与丰富度指数均最高,分别为1.84与1.86,表明帽儿山样地耕作土壤生态系统稳定且有利于农业的可持续发展。
3.3 土壤可培养细菌群落与环境因子的相关性 土壤微生物是土壤有机体与无机体相互转化的作用者、土壤营养物质循环的参与者以及构成土壤肥力的重要因素。土壤微生物本身也是活性的营养库。它可分解有机物质形成腐殖质,并且释放养分,参与土壤C、N、P和S等元素的循环过程及土壤矿物的矿化过程[23]。土壤 pH、盐分、总氮[24-27]、有机质含量[28]等均对土壤微生物群落结构具有十分重要的影响。CCA结果显示,土壤中微生物群落是由各土壤理化性质共同作用的结果,塔河、带岭和帽儿山样地CCA排序轴1均与总氮显著相关(相关系数分别达 -0.89、0.74 和0.99)。这可能与土壤中参与氮转化的微生物功能群有关。生物限制因子——氮元素在土壤中的含量变化会引起土壤微生物生物量、活性和群落组成的变化[29-31]。
[1]刘国华,叶正芳,吴为中.土壤微生物群落多样性解析法:从培养到非培养[J].生态学报,2012,32(14):4421 -4433.
[2]SMITH J,PAUL E.The significance of soil microbial biomass estimations[M]//BOLLAG S G.Soil biochemistry.NY:Marcel Dekker,1990:357 -396.
[3]XU Z H,WARD S,CHEN C R,et al.Soil carbon and nutrient pools,microbial properties and gross nitrogen transformations in adjacent natural forest and hoop pine plantations of subtropical Australia[J].Soil Sediments,2008,8:99 -105.
[4]XU Z H,CHEN C R,HE J,et al.Trends and challenges in soil research 2009:Linking global climate change to local long-team forest productivity[J].Soil Sediments,2009,9:83 -88.
[5]陈春瑜,和树庄,胡斌,等.土地利用方式对滇池流域土壤养分时空分布的影响[J].应用生态学报,2012,23(10):2677 -2684.
[6]杨帆,董燕,徐明岗,等.南方地区秸秆还田对土壤综合肥力和作物产量的影响[J].应用生态学报,2012,23(11):3040 -3044.
[7]ERIC S,PAULA L,KAREL W.Detection of shifts in microbial community structure and diversity in soil caused by copper contamination using amplified ribosomal DNA restruction analysis[J].FEMS Microbiology Ecology,1997,23:249 -261.
[8]R·E·布坎南,N·E·吉本斯.伯杰细菌鉴定手册(中文版)[M].8版.北京:科学出版社,2000.
[9]慕东艳,吕国忠,孙晓东,等.黑龙江省药用植物根际土壤真菌多样性[J].生态学报,2013,33(1):229 -237.
[10]董旭辉,羊向东,王荣.长江中下游地区湖泊富营养化的硅藻指示性属种[J].中国环境科学,2006,26(5):570 -574.
[11]TER BRAAK C J F.Canonical correspondence analysis:A new eigenvector method for multivariate direct gradient analysis[J].Ecology,1986,67(5):1167-1179.
[12]孙春梅,范亚文.黑龙江黑河江段藻类植物群落与环境因子的典型对应分析[J].湖泊科学,2009,21(6):839 -844.
[13]MAGURRAN A E.Ecological diversity and its measuremen[M].New Jersey:Princeton University Press,1988:141 -162.
[14]姬艳艳,张贵龙,张瑞,等.耕作方式对农田土壤微生物功能多样性的影响[J].中国农学通报,2013,29(6):117 -123.
[15]罗世琼,杨雪鸥,林俊青.施肥对烤烟土壤微生物群落结构多样性及蔗糖酶活性的影响[J].贵州农业科学,2013,41(7):124 -128.
[16]CHIARINI L,BEVIVINO A,DALMASTRI C,et al.Influence of plant development cultivar and soil type on microbial colonization of maize root[J].Soil Ecol,1998,8:11 -18.
[17]DA SILVA K R A,SALLES J F,SELDIN L,et al.Application of a novel Paenibacillus specific PCR-DGGE method and sequence analysis to assess the diversity of Paenibacillus sp.in the maize rhizosphere[J].Microbiol Meth,2003,54:213 -231.
[18]GELSOMINO A,KEIJZER-WOLTERS A C,CACCO G,et al.Assessment of bacterial community structure in soil by polymerase chain reaction and denaturing gradient gel electrophoresis[J].Microbiol Meth,1999,38:1 -15.
[19]LATOUR X,CORBERAND T,LAGUERRE G,et al.The composition of fluorescent Pseudomonas population associated with roots is influenced by plant and soil type[J].Environ Microbiol,1996,62:2449 -2456.
[20]曾希柏,王亚男,王玉忠,等.不同施肥模式对设施菜地细菌群落结构及丰度的影响[J].中国农业科学,2013,46(1):69 -79.
[21]胡亚林,汪思龙,颜绍馗.影响土壤微生物活性与群落结构因素研究进展[J].土壤通报,2006,37(1):170 -176.
[22]MARSCHNER P,KANDELER E,MARSCHER B.Structure and function of the soil microbial community in a long-team fertilizer experiment[J].Soil Biology and Biochemistry,2003,35:453 -461.
[23]孟庆英,于忠和,贾绘彬,等不同施肥处理对大豆根际土壤微生物及土壤肥力影响[J].大豆科学,2011,30(3):471 -474.
[24]李晨华,贾仲君,唐立松,等.不同施肥模式对绿洲农田土壤微生物群落丰度与酶活性的影响[J].土壤学报,2012,49(3):567 -574.
[25]MARTENS-HABBENA W,BERUBE P M,URAKAWA H,et al.Ammonia oxidation kinetics determine niche separation of nitrifying archaea and bacteria[J].Nature,2009,61:976 -979.
[26]NICOL G W,LEININGER S,SCHLEPER C,et al.The influence of soil pH on the diversity abundance and transcriptional activity of ammonia oxidizing archaea and bacteria[J].Environmental Microbiology,2008,10(11):2966 -2978.
[27]ERGUDER T H,BOON N,WITTEBOLLE L,et al.Environmental factors shaping the ecological niches of ammonia-oxidizing archaea[J].FEMS Microbiology Reviews,2009,33(5):855 -869.
[28]ZHANG Q C,SHAMSI I H,XU D T,et al.Chemical fertilizer and organic manure inputs in soil exhibit a vice versa pattern of microbial community structure[J].Applied Soil Ecology,2012,57:1 -8.
[29]SARATHCHANDRA S U,GHANI A,YEATES G W,et al.Effect of nitrogen and phosphate fertilizers on microbial and nematode diversity in pasture soils[J].Soil Biology and Biochemistry,2001,33(7/8):953 -964.
[30]刘丽,徐明恺,汪思龙,等.杉木人工林土壤质量演变过程中土壤微生物群落结构变化[J].生态学报,2013,33(15):4692 -4706.
[31]王卫霞,罗达,史作民,等.岷江干旱河谷造林对土壤微生物群落结构的影响[J].生态学报,2014,34(4):890 -898.

