不同施硅方式对土壤化学性状及土壤酶活性的影响
沈彦辉 周新刚 吴凤芝
(东北农业大学园艺学院,黑龙江哈尔滨 150030)
不同施硅方式对土壤化学性状及土壤酶活性的影响
沈彦辉 周新刚 吴凤芝*
(东北农业大学园艺学院,黑龙江哈尔滨 150030)
选取北方大田黑土,以黄瓜品种津研4号为试材,采用盆栽试验,研究无苗土壤加硅、种苗硅灌根、种苗硅叶面喷施等不同施硅方式对土壤化学性状及土壤酶活性的影响。结果表明:与无苗土壤不加硅对照相比,无苗土壤加硅处理后第20、30天,显著提高了土壤pH值、EC值及土壤脲酶、转化酶活性,显著降低了土壤速效钾含量;与种苗不加硅对照相比,种苗硅灌根处理后第20、30天显著增加了土壤有效磷含量、pH值、EC值及土壤脲酶、转化酶活性,降低或显著降低了土壤有机质和速效钾含量;与种苗不加硅对照相比,种苗硅叶面喷施处理后第20天显著提高了土壤pH值、有效磷含量及土壤脲酶活性,显著降低了土壤有机质含量。综上,不同施硅方式均能在一定程度上影响土壤化学性状和土壤酶活性,硅灌根处理对土壤化学性状和土壤酶活性影响最大,无苗土壤加硅处理对土壤化学性状和土壤酶活性的影响次之,硅叶面喷施对土壤化学性状和土壤酶活性影响最小。
硅;灌根;叶面喷施;土壤化学性状;土壤酶活性
硅是地壳中含量最丰富的矿质元素之一,但由于土壤中硅广泛存在(Vakalounakis,1996),且植物缺硅症状表现不明显,硅在植物生长过程中的生理功能长期被忽视。但随着研究的深入,大量研究表明硅对许多植物的生长发育都有一定的生理效应,硅元素已被列为“有益元素”(饶立华 等,1986)。硅肥已成为继氮、磷、钾肥之后的第四大元素肥料(Huang et al.,2011)。
土壤肥力是作物生长发育的供给源,直接影响着作物的产量和品质(陈秀芳 等,2005;刘慧霞和郭正刚,2011)。随着作物的生长发育,土壤中的矿质养分不断被消耗,且不同元素间的相互作用也会改变其存在的形态,进而影响植物的吸收利用。土壤酶作为土壤生态系统中土壤生物活性和土壤肥力的重要组成部分(Marx et al.,2011),在催化土壤物质循环和能量转化过程中发挥着重要作用(Zhou et al.,2011),其活性不仅能够反映土壤微生物活性的高低,还能表征土壤养分转化的速率和转移能力的大小,对土壤肥力的演化产生重要影响(Boerner et al.,2005)。目前国内外关于硅对土壤肥力影响的研究大多集中在单子叶植物上,尤其是水稻(Chen et al.,2011)、甘蔗(Huang et al.,2011)、小麦(董敬娜 等,2011)等喜硅作物。关于硅对双子叶植物尤其是对种植黄瓜的土壤矿质营养元素氮、磷、钾的影响多集中在矿质元素间的互作效应及矿质元素生态因子间的部分替代功能,而将土壤化学性状和土壤酶活性有机结合起来的研究相对较少。本试验以黄瓜(Cucumis sativus L.)为试材,研究无苗土壤加硅、种苗硅灌根、种苗硅叶面喷施处理对土壤化学性状及土壤酶活性的影响,旨在探明不同施硅方式对土壤性状和土壤酶活性影响的差异,以期为在农业生产中采取合理的施硅肥方式提供理论依据。
1 材料与方法
1.1 试验材料
供试黄瓜品种为津研4号(沈阳市新民联闻蔬菜种苗中心);供试硅源为Na2SiO3·9H2O(天津市巴斯夫化工有限公司);供试土壤为东北农业大学园艺试验实习基地中未种植过黄瓜的大田黑土,其基本理化性质为:有机质含量73.58 g·kg-1、速效钾123.75 mg·kg-1、有效磷47.92 mg·kg-1、碱解氮100.68 mg·kg-1、有效硅32.25 mg·kg-1、电导率402.76 μS·cm-1(土∶水=1.0 m∶2.5 V)、pH值5.85(土∶水=1.0 m∶2.5 V)。
1.2 试验设计
试验于2014年9~11月在东北农业大学园艺试验站温室大棚和园艺学院蔬菜生理生态研究室进行。
采取盆栽方法,将供试土壤混合均匀后装入规格为14 cm×16 cm的塑料盆中,每盆1 kg。根据施硅方式的不同设置5个处理:无苗土壤不加硅对照(KB)、无苗土壤加硅处理(KB+Si)、种苗不加硅对照(WK)、种苗硅灌根处理(Si+R)、种苗硅叶面喷施处理(Si+L),为防止试验过程中叶面喷施硅处理时溅落到塑料盆中影响试验结果,所有处理均用塑料薄膜将盆口覆盖但留一定的缝隙。每处理3次重复,每重复15盆,完全随机排列,小区周围设置保护行,常规管理。黄瓜种子常规浸种、催芽、播种,子叶展开后定植到塑料盆中,种苗处理每个塑料盆中定植2株,待缓苗后进行间苗,每盆留取1株长势基本一致的幼苗。在幼苗第1片真叶完全展开第2片真叶刚露心时进行土壤硅灌根和硅叶面喷施处理,其中土壤加硅处理(KB+Si和Si+R)是使用量筒按每个塑料盆加入100 mL SiO2浓度为2 mmoL·L-1的Na2SiO3·9H2O溶液(Pavlovic et al.,2013);Si+L处理是喷施SiO2浓度为100 mg·kg-1的Na2SiO3·9H2O溶液,喷施量以所有叶片全部湿润但不形成水滴流走为宜,每7 d处理1次(Liang et al.,2005;Gonzalo et al.,2013);土壤不加硅处理(KB、WK和Si+L)土壤浇灌等量的蒸馏水,WK和Si+R处理均在叶面喷施等量的蒸馏水。期间采用称重法浇灌灭菌水,维持各处理间含水量保持一致,每2 d将塑料盆随机调整位置,避免由于自然因素的不均造成的影响。分别于加硅处理后10、20、30 d取土样,随机收集不同处理黄瓜土壤,每重复随机取3盆,将采集后的土壤样品过2 mm筛,一部分自然风干用于土壤化学性状的测定,另一部分土样保存于4 ℃冰箱中,用于土壤酶活性的测定。
1.3 测定项目及方法
土壤化学性状的测定:土壤有机质含量采用重铬酸钾容量法测定;速效氮含量采用碱解扩散法测定;有效磷含量采用钼蓝比色法测定;速效钾含量采用醋酸铵-火焰光度法测定;pH值按土水比1.0 m:2.5 V用酸度计测定;EC值按土水比1.0 m:2.5 V用电导率仪测定(鲍士旦,2000)。土壤酶活性的测定:采用靛酚比色法测定脲酶活性,采用3,5-二硝基水杨酸比色法测定转化酶活性,采用磷酸苯二钠法测定中性磷酸酶活性(严旭升,1988)。
1.4 数据处理
采用Microsoft Excel 2003软件整理原始数据,采用SAS 8.1软件中Tukey进行方差分析。
2 结果与分析
2.1 硅对土壤化学性状的影响
随着时间的增加,不同施硅方式的土壤速效氮含量均呈先增加后降低的趋势(图1)。第10天,无苗土壤加硅处理(KB+Si)的土壤速效氮含量高于无苗土壤不加硅对照(KB);第10、20天,种苗加硅处理(Si+R、Si+L)的土壤速效氮含量也高于种苗不加硅对照(WK);各个时期不同处理间无显著差异。
随着时间的增加,不同施硅方式对土壤有效磷含量的影响不同,与不加硅处理相比,加硅处理后第30天均增加了土壤有效磷含量(图1)。相同处理时间下,无苗土壤加硅处理(KB+Si)与无苗土壤不加硅对照(KB)相比无显著差异。第20、30天,与种苗不加硅对照(WK)相比,种苗加硅处理(Si+R、Si+L)显著增加土壤有效磷含量;在整个取样时期,种苗硅灌根处理(Si+R)土壤有效磷含量最高。
不同施硅方式均降低土壤速效钾含量(图1)。第20、30天,无苗加硅处理(KB+Si)与无苗不加硅对照(KB)相比、种苗硅灌根处理(Si+R)与种苗不加硅对照(WK)相比均显著降低了土壤速效钾含量;整个取样时期,种苗硅叶面喷施处理(Si+L)的土壤速效钾含量与种苗不加硅对照(WK)相比无显著差异,种苗硅灌根处理(Si+R)的土壤速效钾含量最低。
不同施硅方式均降低土壤有机质含量(图1)。第20天,与种苗不加硅对照(WK)相比,种苗加硅处理(Si+R、Si+L)均显著降低土壤有机质含量;整个取样时期,种苗不加硅对照(WK)土壤有机质含量最高,无苗土壤加硅处理(KB+Si)最低。
不同施硅方式均增加土壤pH值(图1)。第20、30天,无苗土壤加硅处理(KB+Si)与无苗土壤不加硅对照(KB)相比、种苗硅叶面喷施处理(Si+L)与种苗不加硅对照(WK)相比均显著提高了土壤pH值;整个取样时期,种苗硅灌根处理(Si+R)与种苗不加硅对照(WK)相比,均能显著提高土壤pH值;整个取样时期,种苗硅灌根处理(Si+R)处理土壤pH值最高。
不同施硅方式均能提高土壤EC值(图1)。整个取样时期,无苗土壤加硅处理(KB+Si)与无苗土壤不加硅对照(KB)相比、种苗土壤硅灌根(Si+R)处理与种苗土壤不加硅对照(WK)相比均显著提高了土壤EC值;整个取样时期,种苗硅叶面喷施处理(Si+L)与种苗不加硅对照(WK)的土壤EC值无显著差异;第20、30天,种苗硅灌根(Si+R)处理土壤EC值显著高于种苗硅叶面喷施(Si+L)处理;整个取样时期,种苗硅灌根处理(Si+R)土壤EC值最高。
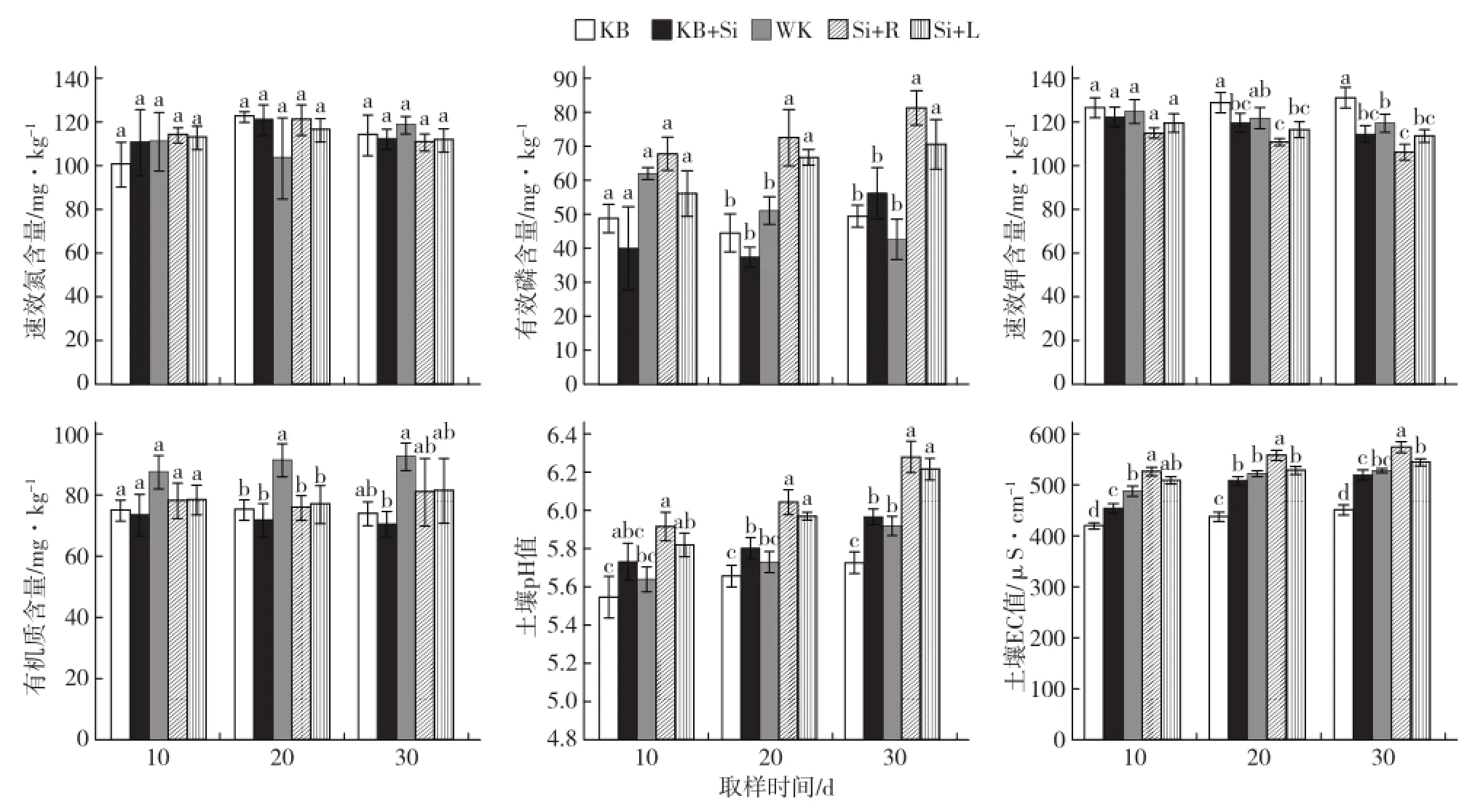
图1 硅对土壤 学性状的影响
2.2 硅对土壤酶活性的影响
第20、30天,不同施硅方式均能提高土壤中性磷酸酶活性(图2)。整个取样时期,无苗土壤加硅处理(KB+Si)中性磷酸酶活性均高于无苗土壤不加硅对照(KB),但差异不显著;第20、30天,种苗加硅处理(Si+R、Si+L)中性磷酸酶活性高于种苗不加硅对照(WK),但差异不显著。
第20、30天,不同施硅方式均能提高土壤脲酶活性(图2)。整个取样时期,无苗土壤加硅处理(KB+Si)土壤脲酶活性均显著高于无苗土壤不加硅对照(KB);第20、30天,种苗土壤加硅处理(Si+R、Si+L)土壤脲酶活性高于或显著高于种苗不加硅对照(WK),且种苗硅灌根处理(Si+R)土壤脲酶活性最高。
不同施硅方式处理均能提高土壤转化酶活性(图2)。第20、30天,无苗土壤加硅处理(KB+Si)与无苗土壤不加硅对照(KB)相比、种苗硅灌根处理(Si+R)与种苗不加硅处理(WK)相比均显著提高了土壤转化酶活性,种苗硅叶面喷施(Si+L)处理与种苗不加硅处理(WK)的土壤转化酶活性差异不显著。

图2 硅对土壤酶活性的影响
3 结论与讨论
土壤酶活性和土壤化学性状一般是评价土壤肥力状况的重要指标,测定相应土壤酶活性和土壤化学性状的变化可以间接地了解和预测土壤肥力的演变趋势(Caldwell,2005)。本试验选取表征土壤化学性状的速效氮、有效磷、速效钾、有机质、pH值、EC值及与碳、氮、磷等营养转化相关的酶研究不同施硅方式对土壤肥力的影响。初步研究结果表明,不同施硅方式处理对土壤化学性状的影响不同,与无苗土壤不加硅对照相比,无苗土壤加硅处理降低或显著降低了土壤速效钾含量,提高或显著提高了土壤pH值、EC值。与种苗不加硅对照相比,种苗硅灌根处理增加或显著增加了土壤有效磷含量及土壤pH值、EC值,降低或显著降低了土壤速效钾及有机质含量;加硅处理后第20、30天,种苗硅叶面喷施处理显著增加了土壤有效磷含量及土壤pH值,降低或显著降低了土壤有机质含量。本试验硅对土壤速效氮含量影响的结果与前人研究结果不一致(李清芳和马成仓,2003),这可能与试验时间长短及土壤氮的形态转化有关(杨敬天 等,2010)。前人研究表明,土施硅肥能提高土壤pH值(Huang et al.,2011),而本试验中种苗硅叶面喷施也显著提高了土壤pH值,这可能是由于硅直接参与黄瓜幼苗的生理生化过程中植株-根系分泌物-微生物相互作用造成土壤pH值升高(Bais et al.,2006;Nicol et al.,2008;Badri et al.,2009)。无苗土壤加硅处理土壤有效磷含量随时间的增加呈现先降低后增加的趋势,与胡克伟等(2002)认为不同施硅量对水稻土壤磷的吸附和解吸的研究结果一致;加硅处理后第20、30天,与无苗不加硅对照相比,种苗硅灌根、种苗硅叶面喷施处理均显著增加了土壤有效磷含量,这可能是由于随着黄瓜的生长硅对土壤磷的解吸量增加造成的,也可能是由于硅酸根离子和磷酸根离子之间竞争吸附位点,导致土壤有效磷含量增加;种苗叶面喷施硅被黄瓜吸收利用后,在黄瓜植株内与其吸收的有效磷存在交互作用,增加了磷的移动性和有效性,减少了黄瓜植株对土壤磷的吸收造成的。加硅处理后第20、30天时,与无苗不加硅对照相比,无苗土壤加硅处理显著降低土壤速效钾含量,这与加硅后土壤钾的转化形态有关(杨敬天 等,2010),而种苗硅灌根处理速效钾含量显著低于种苗不加硅对照,这可能是由于硅刺激植物根系H+-ATP酶活性和根系脱氢酶活性促进了植物对钾的吸收或硅具有选择性吸钾的能力造成的(Liang,1999;Liang et al.,2007;Richmond & Sussman,2003)。不同加硅方式均降低土壤有机质含量是由于硅提高了土壤微生物的活性,将土壤有机质分解为简单的可供植物吸收利用的无机化合物以及CO2和H2O等造成的。硅提高了土壤离子交换能力,造成土壤EC值升高(Camberato,2001)。
本试验中,与相应不加硅对照相比,加硅处理后第20、30天无苗土壤加硅和种苗硅灌根处理均显著提高了土壤脲酶活性,种苗硅叶面喷施仅在加硅处理第20天时显著提高了土壤脲酶活性;加硅处理后第20、30天,无苗土壤加硅和种苗硅灌根处理显著提高了土壤转化酶活性;不同施硅方式对土壤中性磷酸酶活性无显著影响,这与前人的研究部分相似(Liang,1999;Wang et al.,2013)。前人研究表明,土壤加硅可提高土壤微生物的活性和微生物区系的组成(Matichenkov & Calvert,2002;Wang et al.,2013),而土壤微生物活性和微生物区系组成可以间接影响土壤酶的活性(Zhou et al.,2011),这可能是造成土壤加硅处理脲酶和转化酶活性增加的原因。本试验中,硅叶面处理除加硅处理第20天时显著提高了土壤脲酶活性,对转化酶、中性磷酸酶活性无显著影响,这可能是由于叶面喷施硅被作物吸收后直接参与植物的生理生化过程和形态建成,提高了植株体内养分元素的有效性,植株对土壤养分需求减少,土壤养分含量一定程度上影响了土壤酶活性。
此外,本试验仅测定了加硅处理后10、20、30 d的黄瓜根际土壤,并未对其进行长期定位追踪,随着时间的增加,土壤养分含量、酶活性以及微生物区系可能会发生相应的变化,随着不断地添加Na2SiO3·9H2O所引入的钠离子和有效硅不断积累也可能影响作物生长和土壤性状。本试验仅测定了表征土壤肥力的土壤化学性状和土壤酶活性,并未测定土壤微生物学活性和土壤物理学性状,这些都需要进一步研究。要明确硅对土壤肥力状况的影响,还需要进一步探明硅对土壤物理性状及生物学性状的影响。
鲍士旦.2000.土壤农化分析.北京:中国农业出版社.
陈秀芳,赵秀兰,夏章菊,佟振峰.2005.硅缓解小麦镉毒害的效应研究.西南农业大学学报:自然科学版,27(4):447-450.
董敬娜,李光德,敬佩,郝英华,韩晓梅,周楠楠,程珊珊.2011.硅作用下铜对小麦幼苗生理特性影响研究.水土保持学报,25(2):222-226.
胡克伟,关连珠,颜丽,贾冬艳.2002.施硅对水稻土磷素吸附与解吸特性的影响研究.植物营养与肥料学报,8(2):214-218.
李清芳,马成仓.2003.土壤有效硅对棉花幼苗营养代谢的影响.中国农业科学,36(6):726-730.
刘慧霞,郭正刚.2011.不同土壤水分条件下添加硅对紫花苜蓿茎叶和土壤氮磷钾含量的影响.应用与环境生物学报,17(6):809-813.
饶立华,覃莲祥,朱玉贤.1986.硅对杂交稻形态结构和生理的效应.植物生理学通讯,(3):20-24.
严旭升.1988.土壤肥力研究方法.北京:农业出版社.
杨敬天,苏智先,胡进耀,吴庆贵,贺静.2010.珙桐林土壤有机质与酶活性的通径分析.应用与环境生物学报,16(2):164-167.
Badri D V,Weri T L,Lelie D V D,Vivanco J M.2009.Rhizosphere chemical dialogues: plant-microbe interactions.Current Opinion in Biotechnology,20:642-650.
Bais H P,Weir T L,Perry L G,Gilroy S,Vivanco J M.2006.The role of root exudates in rhizosphere interactions with plants and other organisms.Annual Review of Plant Biology,57:233-266.
Boerner R E J,Brinkamn J A,Smith A.2005.Seasonal variations in enzyme activity and organic carbon in soil of burned and unburned hardwork forest.Soil Biol Biochem,37:1419-1426.
Caldwell B A.2005.Enzyme activities as a component of soil biodiversity: a review.Pedobiologia,49:637-644.
Camberato J J.2001.Cation exchange capacity-everything you want to know and much more.South Carolina Turfgrasses Foundation News,October-December.
Chen W,Yao X Q,Cai K Z,Chen J N.2011.Silicon alleviates drought stress of rice plants by improving plant water status,photosynthesis and mineral nutrient absorption.Biol Trace Elem Res,142:67-76.
Gonzalo M J,Lucena J J,Hern á ndez-Apaolaza L.2013.Effect ofsilicon addition on soybean(Glycine max) and cucumber(Cucumis sativus) plants grown under iron deficiency.Plant Physiology and Biochemistry,70:455-461.
Huang H R,Xu L,Bokhtiar S M,Mano J Kumar Srivastav,Li Y R,Yang L T.2011.Effect of calcium silicate fertilizer on soil characteristics,sugarcane nutrients and its yield parameters.Journal of Southern Agriculture,42(7):756-759.
Liang Y C.1999.Effects of silicon on enzyme activity and sodium,potassium and calcium concentration in barley under salt stress.Plant and Soil,209:217-224.
Liang Y C, Sun W C,Si J,Römheld V.2005.Effects of foliar- and root-applied silicon on the enhancement of induced resistance to powdery mildew in Cucumis sativus.Plant Pathology,54:678-685.
Liang Y C,Sun W C,Zhu Y G,Christie P.2007.Mechanisms of silicon-mediated alleviation of abiotic stresses in higher plants: a review.Environmental Pollution,147(2): 422-428.
Marx M C,Wood M,Jarvis S C.2011.A microplate fluorimetric assay for the study of enzyme diversity in soils.Soil Biology & Biochemistry,33(12-13):1633-1640.
Matichenkov V V,Calvert D V.2002.Silicon as a benefical element for sugarcane.Journal of American Society of Sugarcane Technologies,22:21-30.
Nicol G W,Leininger S,Schleper C,Prosser J.2008.The influence of soil pH on the diversity,abundance and transcriptional activity of ammonia oxidizing archaea and bacteria.Envirnmental Microbiology,10(11):2966-2978.
Pavlovic J,Samardzic J,Maksimovic V,Timotijevic G,Stevic N,Laursen K H,Hansen T H,Husted S,Schjoerring J K,Liang Y C,Nikolic M.2013.Silicon alleviates iron deficiency in cucumber by promoting mobilization of iron in the root apoplast.New Phytologist,198:1096-1107.
Richmond K E,Sussman M.2003.Got silicon? The non-essential beneficial plant nutrient.Current Opinion in Plant Biology,6(3) :268-272.
Vakalounakis D J.1996.Root and stem rot of cucumber caused by Fusarium oxysporum f. sp.radicis-cucumerinum.Plant Disease,80:313-316.
Wang L,Cai K Z,Chen Y T,Wang G P.2013.Silicon-mediated tomato resistance against ralstonia solanacearum is associated with modification of soil microbial community structure and activity.Biol Trace Elem Res,152:275-283.
Zhou X G,Yu G B,Wu F Z.2011.Effects of intercropping cucumber with onion or garlic on soil enzyme activities,microbial communities and cucumber yield.European Journal of Soil Biology,47:279-287.
Effects of Different Silicon Fertilization Patterns on Soil Chemical Property and Soil Enzyme Activity
SHEN Yan-hui,ZHOU Xin-gang,WU Feng-zhi*
(College of Horticulture,Northeast Agricultural University,Harbin 150030, Heilongjiang,China)
Black field soil from northern China was chosen,and cucumber‘Jinyan No.4’ was used as testing material. This pot culture experiment studies the effect of different silicon fertilization patterns such as nonseedling soil plus silicon,seedling soil applying silicon at root or spraying silicon at leaf surface, on soil chemical property and soil enzyme activity. The results showed that non-seedling soil plus silicon could significantly increase soil pH value,EC value, soil urease and inverted activity,decrease the content of available potassium significantly 20 days and 30 days after the treatment, and yet had no effect on the contents of available phosphorus,organic matter and available nitrogen. With seedling soil root-applied silicon could significantly increase soil available phosphorus content, pH value, EC value,soil urease and inverted activity,significantly decrease the contents of soil organic matter and available potassium 20 days and 30 days after the treatment. With seedling soil foliar-applied silicon could significantly increase soil pH value and available phosphorus contents and soil urease activity, reduce soil organic matter content 20 days after the treatment. In summary, different application of silicon in a certain extent can affect the soil chemical property and soil enzyme activity. Root-applied silicon can mostly influence soil chemical property and soil enzyme activity. Soil add silicon treatment can affect soil chemical property and soil enzyme activity. Silicon foliar application has minimal impact on soil chemical property and soil enzyme activity.
Silicon;Root-applied;Foliar-applied;Soil chemical properties;Soil enzyme activity
沈彦辉,男,硕士研究生,专业方向:设施园艺与蔬菜生理生态,E-mail:960286062@qq.com
*通讯作者(Corresponding author):吴凤芝,女,教授,博士生导师,专业方向:设施园艺与蔬菜生理生态,E-mail:fzwu2006@aliyun.com
2015-07-09;接受日期:2015-10-19
大宗蔬菜产业技术体系项目(CARS-25-08),国家科技支撑计划项目(2014BAD05B01)

