结球甘蓝叶片卷曲过程中6个生长素相关基因的克隆与表达分析
蒲全明任雪松高启国*刘豫东张林成朱利泉
施松梅1刘晓欢1张 莹1毕云龙2
(1西南大学园艺园林学院,南方山地园艺学教育部重点实验室,重庆 400716;2西南大学农学与生物科技学院,重庆 400716)
研究论文
结球甘蓝叶片卷曲过程中6个生长素相关基因的克隆与表达分析
蒲全明1任雪松1高启国1*刘豫东1张林成1朱利泉2
施松梅1刘晓欢1张 莹1毕云龙2
(1西南大学园艺园林学院,南方山地园艺学教育部重点实验室,重庆 400716;2西南大学农学与生物科技学院,重庆 400716)
生长素在结球甘蓝球叶向上、向内自然卷曲的过程中发挥着重要的调控作用。为挖掘重要的影响结球甘蓝叶片卷曲的生长素相关基因,通过对结球甘蓝莲座期叶片与结球期叶片的转录组进行对比分析,筛选出6个显著差异表达的生长素相关基因,分别为调控生长素动态平衡的BoILL6、BoASA1基因,控制极性运输的BoSF21、BoPIN4基因,参与信号转导的BoARF8、BoGH3.5基因。对上述6个基因进行同源克隆,分别获得全长cDNA序列,序列分析发现6个基因均含有生长素相关的结构域。分子进化树分析发现各基因与芜菁的对应基因遗传关系最近,拟南芥次之。荧光定量PCR检测结果显示,BoILL6、BoASA1与BoSF21的表达量变化最为显著,结球期叶片相对莲座期叶片的表达量差异均高达12倍以上,变化趋势与转录组数据分析结果基本一致,说明这3个基因可能与结球甘蓝叶片的卷曲发育密切相关。
结球甘蓝;叶片卷曲;生长素相关基因;基因克隆;表达分析
结球甘蓝(Brassica oleracea L. var. capitata L.)属十字花科芸薹属,其营养生长主要经过幼苗期、莲座期和结球期3个阶段。幼苗期和莲座期叶片主要进行平展性扩张生长,而结球期叶片向上、向内卷曲抱合发育形成硕大的叶球。叶球质量和紧实度作为结球甘蓝的两个重要农艺性状,受球叶数及卷曲程度的直接影响(李曙轩,1990)。结球甘蓝的叶片进入结球期会发生自然的向上、向内卷曲,这种卷曲球叶为探索叶片卷曲的调控机制提供了理想材料,目前对甘蓝叶片卷曲发育的研究报道较少。
叶片的分化和卷曲生长过程受到激素的影响(Ito,1957)。生长素作为重要的植物激素,在叶片分化、生长及形态发育中具有重要的调控作用(Cheng et al.,2007;李朝霞 等,2013)。早期研究发现,烟草叶片涂抹外源生长素,可使叶片偏上性生长(Keller & van Volkenburgh,1997);拟南芥生长素合成缺陷突变体spl-D和ptl-D都出现叶片偏下生长的表型(Li et al.,2008),而生长素过量表达突变体rooty、yucca、iaaM则呈现出叶片偏上生长的表型(King et al.,1995;Romano et al.,1995;Zhao et al.,2001)。拟南芥生长素信号突变体axr1表现出叶片偏上性生长(Lincoln et al.,1990),而nph4/arf7导致叶片偏下性生长(Harper et al.,2000)。最近的研究表明,生长素对叶片形态发育起着决定性作用(Barkoulas et al.,2008)。在拟南芥中,生长素浓度升高与分布不均衡会导致叶片小而卷曲(林莹莹 等,2015);生长素极性运输蛋白AtPIN的功能缺失将导致叶片变态发育形成有粗壮叶脉的融合叶或主叶脉分叉的宽大叶片(Sawchuk et al.,2013)。由此可见,涉及生长素动态平衡调控、极性运输及信号转导的相关基因对叶片形态发育均蓝球叶卷曲发育的分子调控机制还知之甚少。
本试验基于对结球甘蓝结球期叶片与莲座期叶片的转录组对比分析以及差异表达基因功能注释,筛选出结球甘蓝中显著差异表达的生长素动态平衡相关基因BoASA1(Niyogi & Fink,1992)、BoILL6(Bartel & Fink,1995),极性运输相关基因BoSF21(Kräuter-Canham et al.,1997)、BoPIN4(Gälweiler et al.,1998),参与信号转导相关基因BoGH3.5(Wright et al.,1987)、BoARF8(Ulmasov et al.,1997),分别对上述6个基因的编码序列进行克隆和生物信息学分析;并利用荧光定量PCR技术进一步分析这6个生长素相关基因在结球甘蓝不同时期叶片中的表达情况,以期为筛选生长素相关基因中参与甘蓝叶片卷曲调控的重要基因以及探讨生长素调控甘蓝叶片卷曲的分子机制提供依据。
1 材料与方法
1.1 试验材料
供试材料519为结球性好的中熟甘蓝品系,由西南大学园艺园林学院十字花科课题组提供。2012年7月底在西南大学十字花科蔬菜研究所实验农场播种,育苗30 d后移栽到大田。依据《中国蔬菜栽培学》(中国农业科学院蔬菜花卉研究所,2009)阐述的结球甘蓝各个时期的叶片数以及田间形态观察和数据统计,519在18~30片真叶时为莲座期;30~45片真叶时为过渡期;45片真叶以上(中间叶球大小如乒乓球,即叶球直径4 cm左右)即进入结球期。
2012年9~12月,分别于结球甘蓝莲座期(总叶数为21片)、结球期(总叶数为50片)取长1 cm左右的叶片,用于总RNA的提取和转录组测序。2012年12月至2013年4月,分别于结球甘蓝莲座期(总叶数为24片)、莲座期到结球期的过渡阶段(总叶数为40片)、结球期(总叶数为60片)取长1 cm左右的叶片,-80 ℃保存,用于总RNA的提取与基因表达分析。
1.2 用于转录组分析的叶片卷曲指数测定
分别将莲座期和结球期选取的叶片随机分成3组,每组3片,精确测量并计算卷曲指数。叶片上卷时,侧卷指数(TC)=lm/pw-1,纵卷指数(LC)=纵卷指数(LC)=1-tb/pl。其中,lm为叶片自然状态下的叶宽,pw为叶片压平后的叶宽,tb为叶片自然状态下的叶长,pl为叶片压平后的叶长。
1.3 总RNA的提取
参照植物总RNA提取试剂盒(Tiangen,DP432)说明书提取上述各时期叶片的总RNA,利用NanoVue plus超微量分光光度计(GE,美国)测定RNA浓度;参照PrimeScript RT reagent Kit Perfect Real Time反转录试剂盒说明书反转录成cDNA第一条链,利用NanoVue plus超微量分光光度计测定后将反转录产物稀释至同一浓度,用于荧光定量PCR分析。
1.4 基于转录组的差异基因筛选及基因克隆验证
首先,分别将莲座期和结球期叶片混合提取总RNA,送北京百迈克公司用HiSeq 2000进行转录组测序,利用Trinity软件对各样品数据进行Unigenes组装,通过RPKM值来反映Uigenes表达丰度,利用IDEG 6软件进行差异表达基因检测,以log2(不同时期RPKM比值)绝对值≥2为标准统计差异表达基因,利用Blast软件将前期转录组所得的差异表达Unigenes序列(张林成 等,2014)与Swissport、TrEMBL、NR、NT、GO、COG和KEGG数据库进行比对,获得Unigenes的蛋白功能注释信息,依据功能及其表达差异大小筛选与生长素相关的基因。根据转录组测序组装所得的Unigenes序列,结合芸薹属数据库(http://brassicadb.org/brad/)比对获得各基因的cDNA序列,运用Primer primer 6.0软件设计扩增基因引物(表1)。基因克隆PCR体系为25 μL,以结球期叶片cDNA为模板,按高保真DNA聚合酶PrimeSTAR说明书操作。扩增程序为:98 ℃预变性2 min;98 ℃变性10 s,退火温度(表1)30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。PCR扩增产物经1.2%琼脂糖凝胶电泳检测,回收纯化目的条带,扩增产物连接pEASY-Blunt载体,转化Trans1-T1大肠杆菌感受态,通过蓝白斑筛选白色阳性菌落,经PCR验证阳性克隆子后送深圳华大基因科技有限公司测序。
1.5 基因的生物信息学分析
基于已完成的转录组测序和数据分析,通过同源PCR扩增的方法获得各基因全长cDNA序列后,利用Clustalxl 8.0软件对所得序列进行比对分析,利用DNAStar软件推导基因编码序列相应氨基酸序列,利用在线软件SignalP(http://www.cds. dtu.dk/services/)对信号肽的存在情况进行分析,通过ExPASy(http://expasy.org/tools//)在线分析氨基酸的理化性质,利用Swiss-model在线工具(http:// www.swissmodel.expasy.org/)、PROSITE(http://www. expasy.org/prosite)、InterProScan(http://www.ebi. ac.uk/interpro/scan.html)以及Predict Protein(http:// www.predictprotein.org/)预测蛋白质的二级结构和功能位点,利用NCBI中Blast(http://www.ncbi.nlm. nih.gov/)在线分析结球甘蓝生长素相关基因和其他物种的同源性;利用MEGA 5.1软件构建系统发育树,并分析其进化关系。

表1 结球甘蓝生长素相关基因克隆引物
1.6 基因的荧光定量分析
采用实时荧光定量RT-PCR的方法,对各生长素相关基因表达的时空特异性进行分析。分别以莲座期叶片、过渡期叶片与结球期叶片的cDNA为模板,参照TaKaRa SYBR® Premix Ex TaqTM II(Tli RNaseH Plus)试剂盒说明书(25 μL反应液体系)检测各生长素相关基因的表达情况。根据基因同源克隆所得的序列,利用Primer Primer 5.0软件设计荧光定量引物,引物序列见表2。以TIPS和Actin2作为内参基因(Chandna et al.,2012),反应在C1000/CFX96仪器(Bio-Rad,美国)上完成,反应程序为:95 ℃预变性30 s;95 ℃变性5 s,退火温度(表2)30 s,40个循环。利用Bio-RadCFX96荧光定量PCR仪CFX Manager Software软件(2–ΔΔCT法)和Excel软件进行数据处理。

表2 荧光定量PCR(qRT-PCR)引物
2 结果与分析
2.1 转录组数据分析与生长素相关差异表达基因的筛选
为了筛选出可能参与甘蓝叶片自然卷曲发育调控的生长素相关基因,对莲座期叶片和结球期叶片进行转录组测序和对比分析,利用Trinity软件对各样品测序数据进行组装,利用Blast软件将序列与NT、NR、GO、COG、SwissProt、TrEMBL和KEGG等数据库比对,共获得54 209条Unigenes功能注释信息,莲座期叶片与结球期叶片间差异表达的基因共有1 768条,其中与生长素相关的差异表达基因有49条,包括涉及生长素动态平衡的基因8条,参与生长素信号转导的基因33条,调控生长素极性运输的基因8条。利用RPKM值来反映Unigenes的表达丰度,以log2〔结球期叶片RPKM(T3)/莲座期叶片RPKM(T6)〕绝对值≥2为标准统计差异表达基因,依据差异显著性由高到低的原则选取6个生长素相关基因进行后续分析,分别为涉及生长素动态平衡的基因BoASA1、BoILL6,调控生长素极性运输的基因BoPIN4、BoSF21,涉及生长素信号转导的基因BoGH3.5和BoARF8(表3)。15.45,BoPIN4基因为-2.24,BoSF21基因为2.83,BoGH3.5基因为4.74,BoARF8基因为2.87。莲座期叶片的纵卷指数为-0.06,侧卷指数为-0.19;结由此可见,除BoPIN4在卷曲程度更高的结球期叶片中表达量比莲座期叶片低以外,其余5个基因在卷曲程度更高的结球期叶片中表达量均比莲座期叶片高。
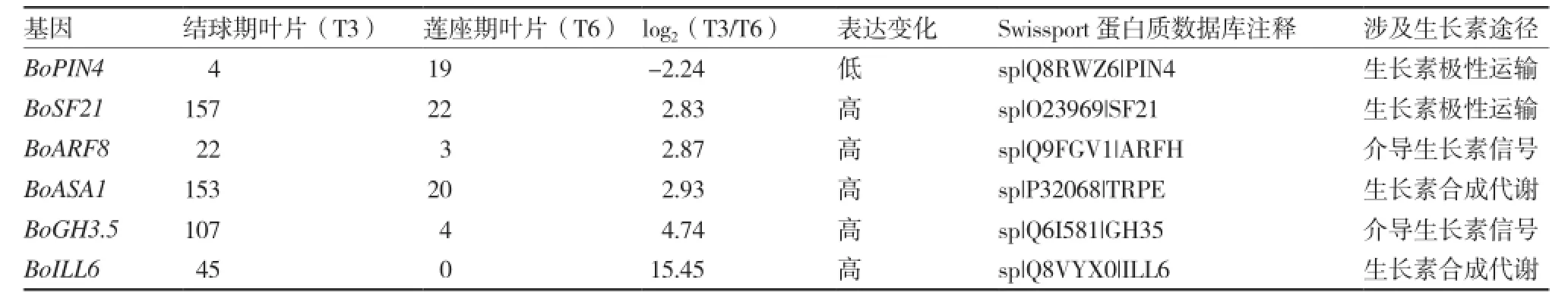
表3 结球甘蓝生长素相关基因转录组数据分析
2.2 基因克隆与cDNA序列分析
通过转录组数据获得上述6个生长素相关基因的Unigenes序列,与芸薹属数据库进行比对分析发现,可从转录组测序结果中获得BoASA1、BoILL6、BoSF21、BoGH3.5、BoARF8的全长cDNA序列,其开放阅读框(ORF)大小分别为1 785、1 386、1 035、1 776、2 406 bp;而BoPIN4只有部分cDNA序列。进一步以结球期叶片总RNA反转录的cDNA为模板,对这6个生长素相关基因进行PCR克隆验证,获得6个基因的全长cDNA序列。其中BoPIN4的cDNA序列长度为1 950 bp,其余5个基因的cDNA序列长度与转录组测序结果一致。通过Bolbase数据库的BLAST Search程序进行分析比对发现(表4),生长素动态平衡调控基因BoASA1、BoILL6分别与Bol044016、Bol006952一致性最高,分别定位于C09、C03染色体;生长素极性运输调控基因BoPIN4、BoSF21分别与Bol014822、Bol009024一致性最高,均定位于C02染色体;生长素信号转导基因BoGH3.5、BoARF8分别与Bol032157、Bol012563一致性最高,分别定位于C09、C06染色体。
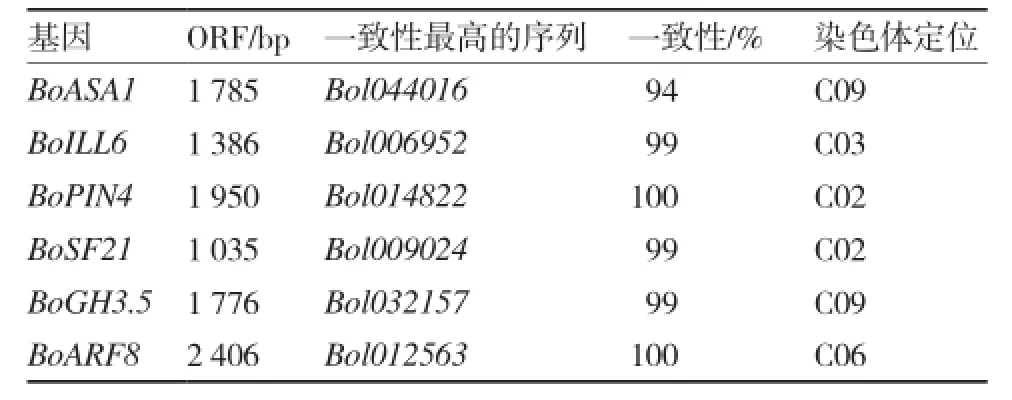
表4 结球甘蓝生长素相关基因的cDNA序列分析
2.3 蛋白序列分析
利用ExPASy在线软件分析6个蛋白序列的分子量、平均疏水性、理论等电点,发现BoASA1、BoARF8和BoGH3.5为可溶性蛋白(表5)。利用CBS网站在线软件TMHMM Server v2.0与Signal 4.0分析发现BoILL6(第7~29位氨基酸处)、BoSF21(第114~136位氨基酸处)与BoPIN4(第7~26、41~60、69~91、101~123和130~152位氨基酸处)含跨膜域,BoILL6(第1~24位氨基酸处)含信号肽。利用CBS网站的在线软件NetPhos 2.0对各蛋白序列进行磷酸化位点分析,发现各蛋白均具有多个可能的蛋白激酶磷酸化位点,以Ser位点为主。
通过NCBI在线Blast比对及myhits在线软件Motif Scan分析各蛋白,绘制各蛋白结构示意图(图1)。结果显示:BoASA1含有保守的Anth_synt_I_ N结构域与Chorismate_bind功能域,作为存在于序列N端的邻氨基苯甲酸合成酶组件,Anth_synt_I_ N可以催化氨与分支酸的结合,Chorismate_bind功能域则是邻氨基苯甲酸合成酶的催化区域;BoILL6含典型的M20_IAA_Hyd功能域,可水解IAA-Asp形成游离IAA;BoSF21含Ndr域,该结构参与调控生长素极性运输(Mudgil et al.,2013);BoPIN4含保守的AEC(auxin efflux carrier)域与Mem_trans(membrane transport protein)域,是生长素运输载体蛋白的特异性结构域;BoGH3.5含1个GH3生长素响应启动子(GH3_arp);BoARF8含1个保守的B3 DNA结合结构域、生长素响应因子(ARF)功能域与Auxin/IAA域。
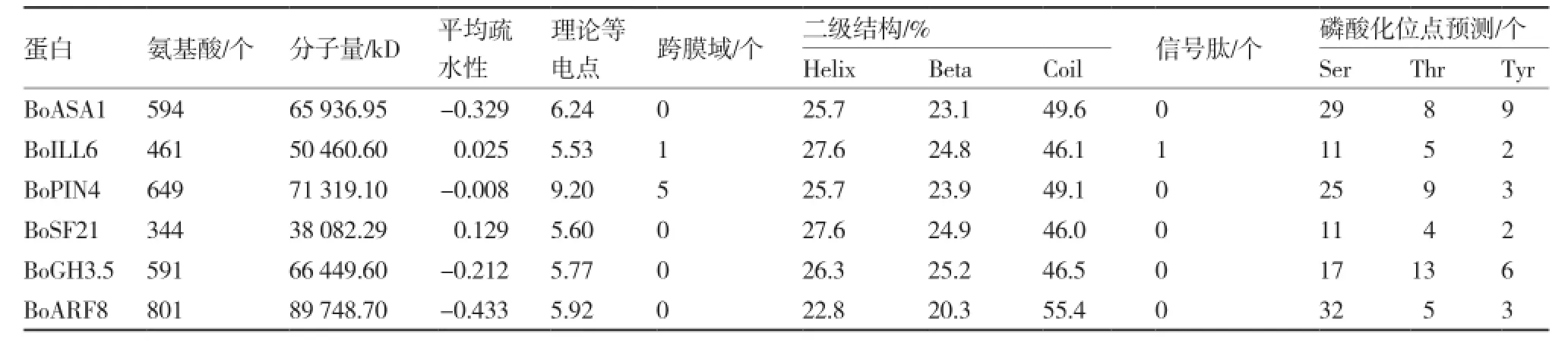
表5 结球甘蓝生长素相关基因编码的蛋白质特征
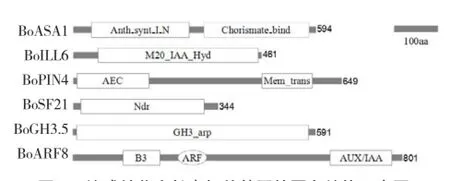
图1 结球甘蓝生长素相关基因的蛋白结构示意图
通过NCBI网站Blast比对,结果表明这6个生长素相关基因的编码蛋白与芜菁、拟南芥基因具有较高的一致性。结球甘蓝BoASA1、BoILL6、BoPIN4、BoSF21、BoGH3.5、BoARF8与BrASA1、 BrILL6、BrPIN4、BrSF21、BrGH3、BrARF8的相似性最高,分别为98%、98%、95%、99%、98%、94%。在线收集各蛋白的同源序列构建系统进化树(图2),分析表明结球甘蓝BoASA1、BoILL6与芜菁BrASA1、BrILL6距离最近,与拟南芥AtASA1、AtILL6次之,都属于生长素动态平衡调控蛋白;结球甘蓝BoSF21、BoPIN4分别与芜菁BrSF21、BrPIN4,拟南芥AtSF21、AtPIN4聚为一大分支,都属于生长素极性运输类蛋白;结球甘蓝BoGH3.5、BoARF8分别与芜菁BrGH3.5、BrARF8遗传关系最近,与拟南芥次之,属于生长素信号转导类蛋白。
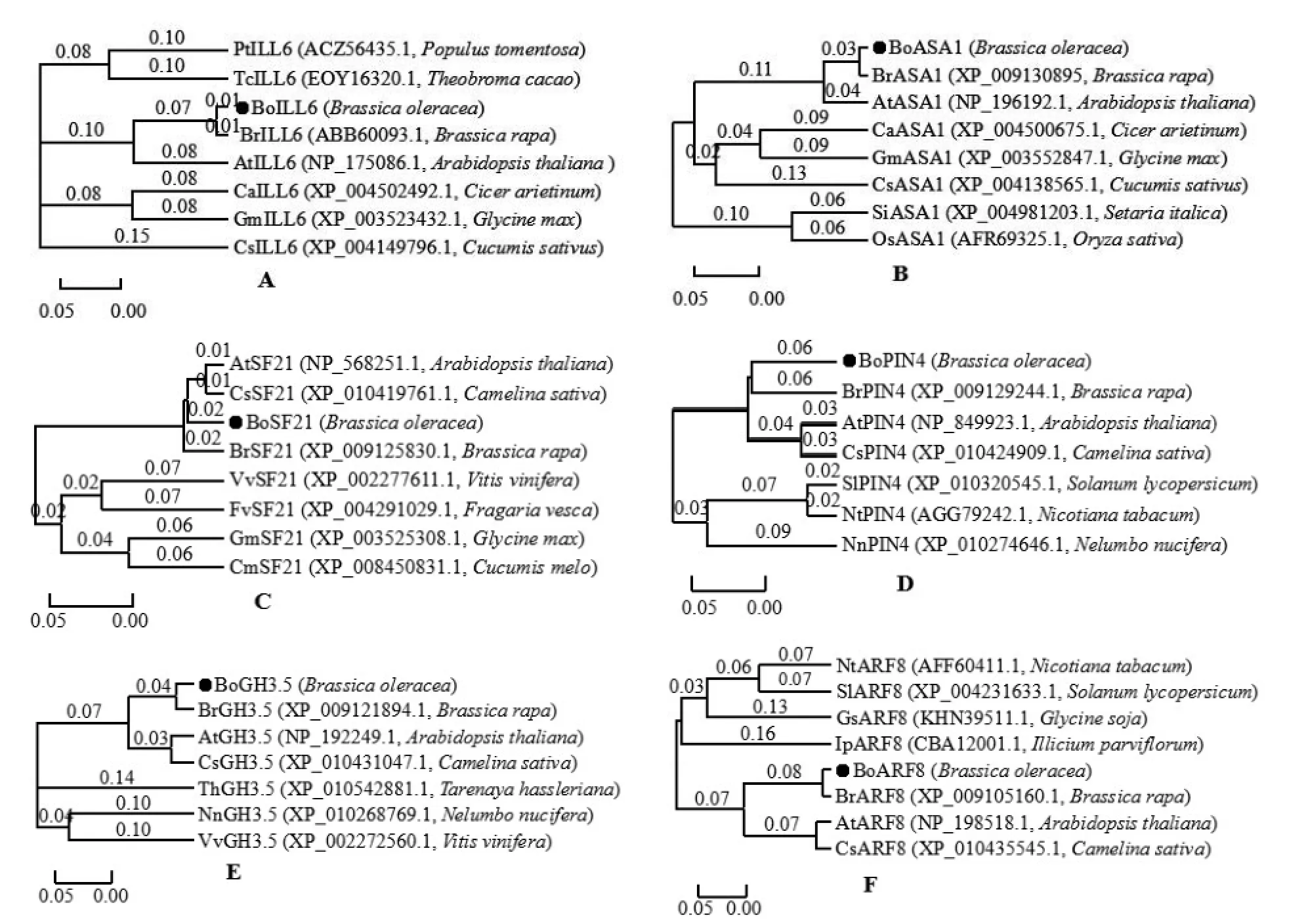
图2 结球甘蓝生长素相关基因的系统发育树
2.4 生长素相关基因的时空表达特性分析
以结球甘蓝莲座期叶片、过渡期叶片和结球期叶片的cDNA为模板,TIPS和Actin2为内参基因,通过荧光定量PCR检测这6个生长素相关基因的表达情况。从图3可以看出,生长素动态平衡调控类基因BoILL6与BoASA1的表达趋势相同,过渡期、结球期2个时期叶片的表达量均高于莲座期叶片表达量(图3-a),分别是莲座期叶片的14.5倍与42.8倍、3.87倍与12.33倍,这与转录组分析的2个基因表达变化趋势一致。生长素极性运输类基因BoPIN4与BoSF21的表达模式存在明显差异,与莲座期叶片相比,BoPIN4在结球期叶片中整体下调0.6倍;而BoSF21在过渡期叶片和结球期叶片的表达量分别为莲座期叶片的22.1倍与29.8倍,呈显著上升趋势(图3-b),这与转录组分析这2个基因的表达变化趋势相同。生长素信号转导类基因BoGH3.5与BoARF8在各个时期叶片均有表达,BoARF8在结球期叶片中的表达量比莲座期叶片高,但上升幅度相比于转录组分析结果较小;BoGH3.5在过渡期叶片与结球期叶片中的表达量分别为莲座期叶片的1.59倍与3.65倍(图3-c),与转录组分析结果相符。
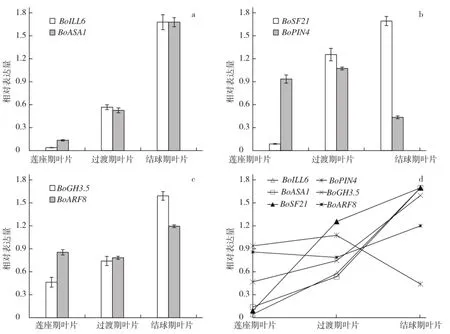
图3 结球甘蓝生长素相关基因的时空表达特性
从图3还可以看出,与较平展的莲座期叶片相比,除了BoPIN4在结球期叶片中表达量下调外,其余5个基因均在结球期叶片中上调表达(图3-d),这与转录组分析的各基因表达变化模式一致。
3 结论与讨论
生长素在植物体内主要通过动态平衡调控、极性运输与信号转导等过程发挥其对生长发育的调节作用(Chitwood et al.,2012)。生长素通过调控叶片背/腹面细胞生长与分裂,对叶片卷曲发育具有重要影响(Tsukaya,2003;Li et al.,2007)。研究发现,生长素稳态调控基因UGT84B1、IATM1与信号转导基因WRKY71-1在拟南芥中过量表达,均能够使叶片发生卷曲(Jackson et al.,2002;Qin et al.,2005;Qin et al.,2013);在烟草中,iaaM的超表达会促进生长素含量升高,进而引起植株叶片皱缩和卷曲(李朝霞 等,2013)。生长素浓度的升高或降低均会导致叶片的形态改变(Jyothilakshmi et al.,2008)。在拟南芥中,属于M20家族的AtILL6基因超表达不仅能通过水解IAA-Ala促进植物体内生长素含量升高,还能通过水解茉莉酸共轭物JAIle间接促进生长素含量升高,进而调节植物形态建成(Emilie et al.,2013)。AtASA1基因的高表达能够促进生长素水平升高(Sun et al.,2009),而ASA1功能的缺失会降低内源生长素含量(Stepanova et al.,2005)。本试验获取的甘蓝BoILL6、BoASA1基因与拟南芥AtILL6、AtASA1同源性分别高达84%、90%,经序列分析发现BoILL6蛋白中存在典型的M20_IAA_Hyd结构域、BoASA1中存在典型的Anth_synt_I_N与Chorismate_bind结构域。进一步进行荧光定量分析发现,BoILL6、BoASA1在卷曲的结球期叶片中的表达量较平展的莲座期叶片剧烈上调。由此推测,甘蓝结球期叶片BoILL6和BoASA1表达量升高,导致叶片中生长素浓度升高,进而参与结球甘蓝球叶卷曲发育表型的调控。
生长素极性运输在叶片对称发育过程中具有重要作用。本试验从结球甘蓝中获得了BoPIN4与BoSF21基因,分析表明BoPIN4含典型生长素运输载体蛋白具有的AEC域,在结球期叶片中的表达量较莲座期叶片下降了0.6倍;BoSF21含Ndr结构域,与NDL1同属N-MYC家族,在结球期叶片中的表达量较莲座期上升了29.8倍,这与Mudgil等(2013)发现拟南芥AtNDL1负调节AtPIN1表达的结果一致。在拟南芥中,AtNDL1超表达会造成叶序异常发育(Mudgil et al.,2013),生长素外输载体AtPIN功能缺失会导致拟南芥产生叶脉粗壮的融合叶或主叶脉分叉的宽大叶片(Sawchuk et al.,2013)。由此推测,BoSF21可能通过负调控BoPIN4的表达参与生长素极性运输,进而在结球甘蓝叶片形态发育中发挥重要作用。
在生长素信号转导过程中,生长素响应因子ARF处于中心位置(Li et al.,2015),而GH3家族是其下游靶基因之一(Yang et al.,2006)。有关报道表明,生长素响应因子ARF3在番茄中过量表达,会导致叶片下卷(Tamar et al.,2012);在拟南芥中,属于GH3基因家族的ASR1基因过量表达,引起莲座叶片向下卷曲、侧根生长受阻(李志邈,2004)。笔者从结球甘蓝中克隆获得的BoARF8、BoGH3.5基因,分析发现BoARF8含有Arf功能域,BoGH3.5含生长素响应启动子GH3_arp。随着结球甘蓝叶片的卷曲,结球期叶片被包裹于甘蓝叶球中导致见光少或未见光,而ARF8基因的表达又需要光诱导(Tian et al.,2004),这可能就是导致本试验中荧光定量PCR检测显示BoARF8在结球期叶片中表达量上升幅度比转录组分析差异小的原因。但是,本试验中转录组数据分析和荧光定量PCR检测结果均表明结球期叶片中BoARF8与BoGH3.5基因的表达量均较莲座期上调,BoGH3.5基因上调的幅度较BoARF8的上调幅度大,这与Yang等(2006)发现水稻ARF8基因正调控GH3基因表达的结论相符。
综上所述,本试验在对结球甘蓝莲座期叶片和结球期叶片进行转录组测序和分析的基础上,初步明确了显著差异表达的6个生长素相关基因(log2绝对值>2)。同时在对结球甘蓝生长发育过程的形态观察中发现由莲座期进入过渡期以及结球期后,叶片的分化速度明显加快,且刚分化出的叶片形态已有了明显的改变。因此,笔者在后续进行荧光定量PCR检测基因表达时增加了过渡期的材料。对比转录组和荧光定量PCR分析的基因表达差异的结果,虽然由于两种情况的取材时间点稍有差异,造成所检测的基因表达变化的倍数不同,但是两种情况下6个基因的整体变化趋势一致。尤其是荧光定量PCR检测结果显示BoILL6、BoASA1、BoSF21等3个生长素相关基因的表达变化显著,结球期叶片相对莲座期叶片的表达差异均高达12倍以上,且在3个时期叶片中的表达量呈逐渐上升的趋势,说明这3个基因与结球甘蓝叶片发育过程中叶片卷曲程度具有紧密相关性。依据前述外源生长素涂抹后使叶片呈现偏上性生长的表型(Keller & van Volkenburgh,1997;李朝霞 等,2013),以及拟南芥中AtILL6、AtASA1和AtSF21基因功能分析结果(Stepanova et al.,2005;Sun et al.,2009;Emilie et al.,2013),推测甘蓝结球期叶片中这3个基因表达量较莲座期叶片显著升高,可能会提高结球期叶片中游离态生长素浓度以及改变叶片中生长素的极性分布,使结球期叶片向上、向内生长,呈现自然卷曲的表型,从而通过生长素途径影响甘蓝叶片卷曲发育。接下来的工作是对这些基因进行结球甘蓝遗传转化和表型分析,以便进一步探讨其在甘蓝叶片卷曲发育过程中的重要作用。
李曙轩.1990.中国农业百科全书.北京:农业出版社:317-318.
李朝霞,殷娴,江一希,姜洋,肖尊安.2013.转基因烟草中过量生长素对叶片生长发育的影响.北京师范大学学报:自然科学版,49(4):369-373.
李志邈.2004.两个与抗病、抗逆和发育相关的拟南芥激发标签突变体asr1和dai1的研究〔博士论文〕.杭州:浙江大学.
林莹莹,李晓云,刘帅,钟玉婷,李玲.2015.过表达转录因子AhAREB1对拟南芥生长素分布的影响.华南师范大学学报:自然科学版,47(1):87-92.
张林成,高启国,蒲全明,任雪松,刘豫东,朱利泉,王小佳.2014.结球甘蓝BoLH01和BoLH02基因的克隆与表达.作物学报,40(8):1371-1379.
中国农业科学院蔬菜花卉研究所.2009.中国蔬菜栽培学.2版.北京:中国农业出版社:497-499.
Barkoulas M,Hay A,Kougioumoutzi E,Tsiantis M.2008.A developmental framework for dissected leaf formation in the Arabidopsis relative Cardamine hirsuta.Nature Genetics,40:1136-1141.
Bartel B,Fink G R.1995.ILR1,an amido hydrolase that releases active indole-3-acetic acid from conjugates.Science,268:1745-1748.
Chandna R,Augustine R,Bisht N C.2012.Evaluation of candidate reference genes for gene expression normalization in Brassica juncea using real time quantitative RT-PCR.PLoS One,7(5):36918.
Cheng Y,Dai X,Zhao Y.2007.Auxin synthesized by the YUCCA flavin monooxygenases is essential for embry ogenesis and leaf formation in Arabidopsis.Plant Cell,19:2430-2439.
Chitwood D H,Headland L R,Ranjan A,Martinez C C,Braybrook S A,Koenig D P,Kuhlemeier Cris,Smith R S,Sinha N R.2012.Leaf asymmetry as a developmental constraint imposed by auxindependent phyllotactic patterning.The Plant Cell,24:2318-2327.
Emilie W,Laurence M,Raphaël L,Emilie H,C lé ment H,Yann A,Michel M,Franck P,Thierry H.2013.The amido-hydrolases IAR3 and ILL6 contribute to jasmonoyl-isoleucine hormone turnover and generate 12-hydroxy-jasmonic acid upon wounding in Arabidopsis leaves.Plant Biology,288(44):31701-31714.
Gälweiler L,Guan C,M ü ller A,Wisman E,Mendgen K,Yephremov A.1998.Regulation of polar auxin transport by AtPIN1 in Arabidopsis vascular tissue.Science,282(5397):2226-2230.
Harper R M,Stowe-Evans E L,Luesse D R,Muto H,Tatematsu K.2000.The NPH4 locus encodes the auxin response factor ARF7,a conditional regulator of differential growth in aerial Arabidopsis tissue.Plant Cell,12:757-770.
Ito H.1957.Effect of temperature and photoperiod on head formation of leafy head of Chinese cabbage.J Hort Assoc Japn,26:154-162.
Jackson R G,Kowalczyk M,Li Y,Higgins G,Ross J,Sandberg G,Bowles D J.2002.Over-expression of an Arabidopsis gene encoding a glucosyltransferase of indole-3-acetic acid:phenotypic characterisation of transgenic lines.Plant J,32:573-583.
Jyothilakshmi V,Claudia R,Yvonne V,Iris C,Ajit V,Bationa S,Ond E,Miroslav S,Ludwig-M ü ller J,Ralf O.2008.The role of auxins and cytokinins in the mutualistic interaction between Arabidopsis and Piriformospora indica.MPMI,21:1371-1383.
Keller C P,van Volkenburgh E.1997.Auxin-induced epinasty of tobacco leaf tissues (a nonethylene-mediated response).Plant Physiol,13:603-610.
King J J,Stimart D P,Fisher R H,Bleecker A B.1995.A mutation altering auxin homeostasis and plant morphology in Arabidopsis.Plant Cell,7:2023-2037.
Kräuter-Canham R,Bronner R,Evrad J L,Hahne G,Friedt W,Steinmetz A.1997.A transmitting tissue- and pollen-expressed protein from sunflower with sequence similarity to the human RTP protein.Plant Sci,129:191-202.
Li L C,Kang D M,Chen Z L,Qu L J.2007.Hormonal regulation of leaf morphogenesis in Arabidopsis.J Inte Plant Biol,49:75-80.
Li L C,Qin G J,Tsuge T,Hou X H,Ding M Y,Aoyama T,Oka A,Chen Z L,Gu H Y,Zhao Y D,Qu L J.2008.SPOR OCYTELESS modulates YUCCA expression to regulate the development of lateral organs in Arabidopsis.New Phytol,179:751-764.
Li S B,OuYang W Z,Hou X J,Xie L L,Hu C G,Zhang J Z.2015.Genome-wide identification,isolation and expression analysis of auxin response factor(ARF)gene family in sweet orange(Citrus sinensis).Front Plant Sci,6:119.
Lincoln C,Britton J H,Estelle M.1990.Growth and development of the axr1 mutants of Arabidopsis.Plant Cell,2:1071-1080.
Mudgil Y,Ghawana S,Jones A M.2013.N-MYC DOWNREGULATED-LIKE proteins regulate meristem initiation by modulating auxin transport and MAX2 expression.PLoS One,8(11):77863.
Niyogi K K,Fink G R.1992.Two anthranilate synthase in Arabidopsis:defense-related regulation of the tryptophan pathway.Plant Cell,4(6):721-733.
Qin G J,Gu H Y,Zhao Y D,Ma Z,Shi G L,Yang Y,Eran P,Chen H D,Liu M H,Chen Z L,Qu L J.2005.An indole-3-acetic acid carboxyl methyltransferase regulates Arabidopsis leaf development.The Plant Cell,17(10):2693-2704.
Qin Z,Lyu H J,Zhu X L,Meng C,Quan T Y,Wang M C,Xia G M.2013.Ectopic expression of a wheat WRKY transcription factor gene TaWRKY71-1 results in hyponastic leaves in Arabidopsis thaliana.PLoS One,8(5):e63033.
Romano C P,Robson P R,Smith H,Estelle M,Klee H.1995.Transgene-mediated auxin overproduction in Arabidopsis:hypocotyl elongation phenotype and interactions with the hy6-1 hypocotyl elongation and axr1 auxin-resistant mutants.Plant Mol Biol,27:1071-1083.
Sawchuk M G,Edgar A,Scarpella E.2013.Patterning of leaf vein networks by convergent auxin transport pathways.PLoS Genet,9(2):1003294.
Stepanova A N,Hoyt J M,Hamilton A A,Alonso J M.2005.A link between ethylene and auxin uncovered by the characterization of two root-specific ethylene-insensitive mutants in Arabidopsis.Plant Cell,17(8):2230-2242.
Sun J Q,Xu Y X,Ye S Q,Jiang H L,Chen Q,Liu F,Zhou W K,Chen R,Li X G,Olaf T,Wu X Y,Cohen J D,Palme K,Li C Y.2009.Arabidopsis ASA1 is important for jasmonate-mediated regulation of auxin biosynthesis and transport during lateral root formation.The Plant Cell,21:1495-1511.
Tamar Y,Irena P,Dror P,Gilgi F,Anna P,Moti S,Guy W,Johnpaul A,Ziva A,Yuval E.2012.Failure of the tomato transacting short Interfering RNA program to regulate auxin response factor 3 and ARF4 underlies the wiry leaf syndrome.Plant Cell,24(9):3575-3589.
Tian C E,Muto H,Higuchi K,Matamura T,Tatematsu K,Koshiba T,Yamamoto K T.2004.Disruption and overexpression of auxin response factor 8 gene of Arabidopsis affect hypocotyl elongation and root growth habit,indicating its possible involvement in auxin homeostasis in light condition.The Plant Journal,40(3):333-343.
Tsukaya H.2003.Organ shape and size:a lesson from studies of leaf morphogenesis.Current Opinion in Plant Biology,6(1):57-62.
Ulmasov T,Hagen G,Guilfovle T J.1997.ARF1,a transcription factor that binds to auxin response elements.Science,276(5320):1865-1868.
Wright R M,Hagen G,Guilfovle T.1987.An auxin-induced polypeptide in dicotyledonous plants.Plant Mol Biol,9:625-634.
Yang J H,Han S J,Yoon E K,Lee W S.2006.Evidence of an auxin signal pathway,microRNA167-ARF8-GH3,and its response to exogenous auxin in cultured rice cells.Nucleic Acids Research,34(6):1892-1899.
Zhao Y,Christensen S K,Fankhauser C,Cashman J R,Cohen J D,Weigel D,Chory J. 2001. A role for flavin monooxy genase-like enzymes in auxin biosynthesis .Science,291:306-309.
Clone and Expression Analysis of Six Auxin-related Genes in Brassica oleracea L. var. capitata L.
PU Quan-ming1,GAO Qi-guo1*,ZHANG Lin-cheng1,SHI Song-mei1,LIU Xiao-huan1,ZHANG Ying1,BI Yun-long2,REN Xue-song1,LIU Yu-dong1,ZHU Li-quan2
(1Key Laboratory of Horticulture Science for Southern Mountainous Regions,Ministry of Education,College of Horticulture and Landscape Architecture,Southwest University, Chongqing 400716,China;2College of Agronomy and Biotechnology,Southwest University,Chongqing 400716,China)
Auxin plays an important role in regulating the process of Brassica oleracea L. var. capitata L. leaf curl.In order to find out the auxin relevant genes involved in cabbage leaf curling,we analyzed transcriptome of cabbage leaf at rosette and heading stages and identified 6 significantly differentially expressed auxin-related genes,including regulation of homeostasis genes(BoILL6,BoASA1),controlling polar transport genes(BoSF21,BoPIN4)and involving in signal transduction genes(BoARF8,BoGH3.5).The full-length cDNA sequences of 6 genes were obtained,respectively using homologous clone method.The protein structure prediction revealed that 6 genes contained auxin-related domains.Phylogenetic analysis though MEGA 5.1 comparison displayed that these genes had the closest genetic relationship with correspondence genes of Brassica rapa,and Arabidopsis thaliana followed. The real-time Fluorescence quantitative PCR analysis suggested that the expression level of BoILL6,BoASA1 and BoSF21 showed significantly different trend.The expression level of these 3 genes in leaf during heading stage were 12 folds more than that in the leaf at rosette stage.The trend was consistent with the results of transcriptome analysis.The up-regulated expression of these 3 genes in the leaf during heading stage maybe lead to enhance the auxin concentration and change the auxin polar contribution in the leaves,and finally lead to format of the leaf curl.
Brassica oleracea L. var. capitata L.;Leaf curl;Auxin-related genes;Gene cloning;Expression analysis
蒲全明,男,硕士研究生,专业方向:甘蓝重要品种性状基因的分离与鉴定,E-mail:puquanming@163.com
*通讯作者(Corresponding author):高启国,男,副研究员,硕士生导师,主要从事甘蓝重要品种性状基因的分离与鉴定、十字花科植物自交不亲和性等方面的研究,E-mail:gaoqg2004031@163.com
2015-08-26;接受日期:2015-09-14
国家重点基础研究发展计划(“973”计划)项目(2012CB113900),国家自然科学基金项目(30900986),重庆市自然科学基金重点项目(cstc2012jjB80010),中央高校基本科研业务费专项资金资助项目(XDJK2010B010)

