植物甾醇的研究进展*
张斌,郁听,栗磊,孟祥河
1(浙江工业大学海洋学院,浙江杭州,310014)2(杭州博士达油脂有限公司,浙江杭州,311103)
植物甾醇(plant sterol,PS)又称植物固醇,它是一种结构与胆固醇类似但具有多重生理活性的三萜烯。早在19世纪50年代,人们就发现了PS的降胆固醇功效,之后又通过大量的动物和临床试验来研究PS的每日最适摄入量,欧洲食品安全局推荐每日应摄入PS 1.5~3 g,这样可降低人体内7% ~11.3%的低密度脂蛋白胆固醇。PS主要来自于植物油的不皂化物,需经过分离提取才能富集到高纯度的产物,而且PS的水溶性和油溶性均较差,这会限制其在人体内的吸收率。因此,本文就PS上述方面问题总结了近些年国内外的研究进展,并对在食品加工贮藏时产生的植物甾醇氧化产物(plant sterol oxidation products,POPs)及其食用安全性问题展开较全面的综述。
1 来源
PS主要以自由醇结构、脂肪酸酯、甾基糖苷及其酰化物等形式存在于自然界。PS在食用油中以游离和酯化形式为主,这些油的来源包括坚果、谷物、豆类和植物种子等[1-2]。当然,从蛋黄、哺乳动物的肝脏和甲壳类动物等非植物膳食原料中也可获取少量PS[3]。迄今为止报道的PS主要来源有:(1)植物油提取工艺副产物-脱臭馏出物(deodorizer distillate,DD)[4-5];(2)工业生产的下脚料浮油[6-7];(3)酿酒行业中的发酵废弃物[8]。
2 分子结构和生理功效
PS是以环戊烷多氢菲为主要骨架的3-羟基化合物(图1),一般在C-17位上连有由8~10个碳原子组成的侧链,根据C-5位上有无双键分为甾醇和甾烷醇。常见的PS有豆甾醇、β-谷甾醇、菜油甾醇和菜籽甾醇,它们主要的结构区别在于支链大小和双键数目。

图1 几种主要代表性甾醇与胆固醇结构图Fig.1 Structure figures of several main representative sterols and cholesterol
PS C-3位上的OH和C-5位上的双键决定其具有多重生理功效。目前人们研究最多的是PS的降胆固醇功效,而且普遍认为PS能与胆固醇竞争溶解于小肠内腔的胆汁酸微胶束,减少微胶束中胆固醇的含量,使之不能运送到达小肠微绒毛的吸收部位。而Liang等的研究结果表明,PS通过调控胆固醇代谢转运脂蛋白和相关酶的表达也能减少胆固醇在人体内吸收[9-10]。此外,PS 还有抗炎、退热、美容、抗癌、促进动物生长等生理功效。近几年的研究热点在减肥和抗氧化两方面,如Furlan[11]等在动物喂养试验中发现,小鼠若喂以含2%PS的高脂膳食(其中含有12% 的蛋白质和35% 的脂肪),持续8周小鼠体重较对照组明显减轻。正因为PS这么多的生理功效,因此早已被广泛应用于食品、药品和化妆品等多个领域[12-14]。
3 PS分离提取技术
PS部分以酯化形式存在于原材料中,所以提取前一般先进行水解使之全部转化成游离PS。水解分为高温高压水解和碱水解,后者因条件温和,且水解皂化一起进行,因此使用较普遍。目前PS的提取方法根据其来源分:(1)植物油DD中PS提取工艺[15-16](如图2所示)。
a途径适用于游离脂肪酸、甘油三酯和生育酚含量较多的DD,具体是先通过真空蒸馏或皂化反应分离出游离脂肪酸,此时剩余物质主要包括PS、生育酚、烃类、甘油一酯、甘油二酯和甘油三酯,其中PS与苯甲酸酐酯化生成甾醇酯(sterol ester,SE),再短程蒸馏去除生育酚,最后转酯化反应后冷却分离得到PS晶体。含游离脂肪酸和生育酚较少的DD则采用b途径,由皂化反应得到的未皂化物冷却结晶分离得到PS粗制品;(2)浮油中PS提取工艺[17](如图3所示)。由正己烷萃取得到的未皂化部分经热水冲洗、有机相浓缩、蒸馏等步骤分别去除无机盐、溶剂和轻馏分等得到PS晶体;(3)天然油料作物中提取PS:该提取工艺与浮油中PS的提取过程基本相似,只是在原料浸提和萃取时结合了微波辅助萃取、超临界CO2萃取或固相萃取等新提取技术[18-20],再通过高速逆流色谱法等技术分离纯化[21],PS的结构和纯度分析一般采用气相色谱(gas chromatography,GC)[22-24]。

图2 脱臭馏出物中甾醇的提取工艺Fig.2 Extraction process of sterol in deodorizer distillate
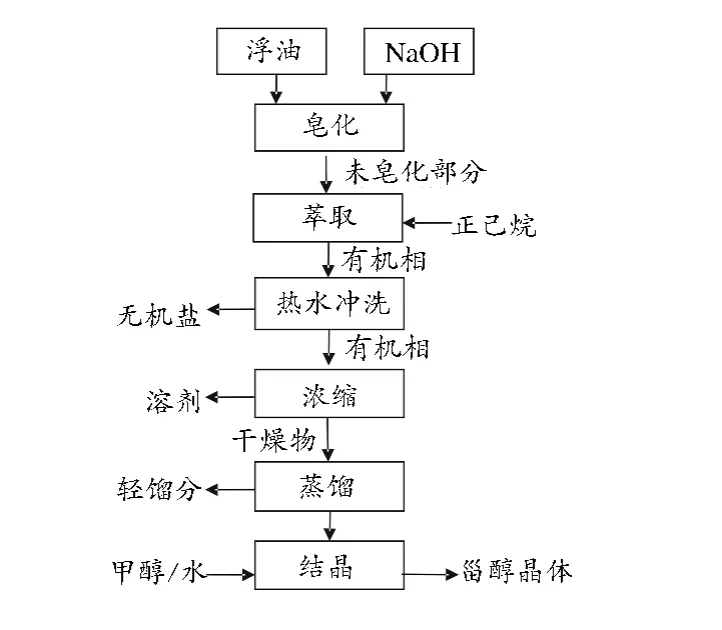
图3 浮油中甾醇的提取工艺Fig.3 Extraction process of sterol in tall oil
4 溶解性的改性研究
天然的PS熔点高(130~180℃),在水中不溶,油溶性也非常低且有白垩味,这些性状是PS应用的瓶颈。因此,近年来国内外研究人员尝试通过PS溶解性改性以获得更好的应用。
4.1 PS水溶性研究
国内外对于PS水溶性研究报道较少。早期人们主要通过添加硬脂酸钠、卵磷脂和单甘酯等单一或复合乳化剂以改善PS在水中的分散性,或再制成微胶囊应用于全脂到无脂等多种产品[25-26]。但是乳化方法只是提高了PS在水溶性食品中的分散性和稳定性,其水溶性并未得到实质改善。受到环糊精与黄酮类药物包合应用的启发,张娟聪等[27]尝试以正丁醇为溶剂,PS浓度2%,β-环糊精与PS的摩尔比为4∶1,40℃,中等速度搅拌下将β-环糊精与PS包合12 h,PS的包合率可达90%,且水溶性得到明显改善。之后吕晓玲[28]和周阳[29]还对羟丙基-β-环糊精包合效果进行了评价,发现包合物相比未经包合的PS在水中的溶解度提高了200倍以上,并通过动物实验证实包合产物并不影响原PS的降血脂功效。
4.2 PS油溶性研究
油溶改性主要通过PS和脂肪酸酯化或者与脂肪酸甲酯酯交换合成植物甾醇酯(sterol esters,SE),若利用长链脂肪酸与PS反应还可获得更高的生物活性,因此该产品可广泛应用在含脂食品中。
酯化合成根据所用催化剂分为化学法和酶法。早期人们采用甲醇钠催化化学法合成SE,但容易生成一些副产物(如氧化甾醇和脱水甾醇),且得到的SE纯度不高。因此Meng等[30]研究硅钨酸作为酯化反应催化剂,以获得高产量高纯度的SE,该研究证实硅钨酸经过六次连续使用后,仍然有比较强的催化能力,基本符合工业化生产要求。Valange等[31]发现,La2O3表面碳酸盐碱性越小,SE酯化率越高,同时还能有效抑制β-谷甾醇侧链的脱水反应。酶法合成反应条件温和、专一性强、副反应较少、产物质量好并易于纯化分离,所以近几年人们在酶法合成上进行了大量研究。Zheng等[32]利用假丝酵母固定化脂肪酶合成亚麻酸甾醇酯,该固定化酶不仅对反应pH和温度有较强抗性,而且在55℃、醇酸摩尔比1.5∶1、反应6 h条件下,酯化率高达95.3% 。Hellner等[33]在无溶剂体系下以PS、辛酸和葵花油为原料酶法一步合成结构脂质和SE,酯化率和甘油三酯转化分别为92.1%和44.1%。季国志等[34]将SE与α-亚麻酸复配并成功应用于乳制品。可见,随着研究的深入,人们在SE合成反应上必定向营养功能最大化方向发展。
5 PS氧化物(POPs)
天然PS在光、热、O2或酶等作用下,会发生自身氧化或者酶促氧化形成POPs。POPs种类繁多,主要分为主环氧化物和侧链氧化物。自身氧化一般生成包含羟基(—OH)、酮基 keto-(=O)、环氧基(epoxy-)和三羟基(triol-)等结构的主环氧化物,而活体内的酶促氧化则生成侧链氧化物,大都包含20 OH—、25 OH—、26 OH—、29 OH—等结构(如图4所示)。PS氧化速度和氧化产物因氧化条件不同而各异,如Rudzińska等[35]将含有 PS的黄油分别在 4℃和 20℃ 储藏18周,储藏结束时发现20℃下PS总量下降了30%,7-OH氧化物含量却上升了3倍,epoxy-氧化物在第 6周达到最大值,随后又不断下降。关于POPs的分析,一般采用 GC-MS。Menéndez-Carreño等[36]则认为 GC×GC分离技术有助于更好地对POPs进行选择性分析,研究还证实了最易生成的POPs主要是7-OH、7-keto和5,6-epoxy氧化物。

图4 POPs的一般形成过程和结构Fig.4 General forming process and structure of POPs
6 安全性
尽管FDA和欧盟都已批准PS可用于降胆固醇食品中,但是天然PS或由于加工不当产生的POPs在人体内的实际生理活性研究和安全性仍然是目前的研究热点。
6.1 天然PS和SE
一般认为,天然PS是安全性较高的新型功能食品添加剂。但Katan等[37]发现,PS的摄入会降低血液中脂溶性维生素的水平,可能是由于前者可减少血液中的脂溶性维生素载体-脂蛋白的含量所致,但这可以通过摄入富含对应营养成分的食物加以补充。
植物固醇血症(又称谷固醇血症)是由于ABCG5和ABCG8(调控肠道内PS吸收的转运蛋白)的突变使PS在胆汁中代谢出现障碍而导致血液中PS水平过高的一种罕见的遗传性脂质代谢疾病,患有该代谢疾病的个体过多摄入PS有可能得黄瘤和早发性冠心病[38],至于 PS对儿童和孕妇的影响还有待考究[39]。总的来说,天然PS具有较高的食用安全性。
6.2 POPs
因为POPs与胆固醇氧化产物(cholesterol oxidation products,COPs)在结构上类似,所以POPs的安全性问题也备受关注。到目前为止,POPs的生理活性和安全性研究包括:
6.2.1 降胆固醇功效
最新研究证明,膳食中掺入一定量豆甾醇氧化物会阻碍低密度脂蛋白受体(LDLR:跟血液中低密度胆固醇的去除有关)和HMG-CoA还原酶(胆固醇合成速率限制酶)的表达[10],而且豆甾醇氧化物无法激活LXRα(LXRα 是减少胆固醇吸收的靶向受体)[40],因此大多POPs不再具备降胆固醇功效。
6.2.2 动脉粥样硬化和炎症反应
COPs目前已被证实可促使动脉粥样硬化,引起炎症反应,所以人们就POPs展开了类似的毒性试验。Yang等[41]发现,β-谷甾醇氧化混合物可减缓血管舒张,从而损伤主动脉的功能性,这可能会导致动脉粥样硬化。Vejux等[42]则证实了7-keto-谷甾醇可减少单核白细胞(U937细胞)中白介素-8的分泌,当7-keto-谷甾醇浓度为60 μM时,还可促进人体结肠癌细胞(Caco-2)中促炎性细胞因子、肿瘤坏死因子TNF-α和白介素-8的分泌,而TNF-α的增加直接影响肠上皮细胞的完整性。可见某些POPs也可促使动脉粥样硬化,引起炎症反应,甚至致癌。
6.2.3 性激素分泌
不同POPs对雌性激素影响不同。混合POPs作用于乳腺癌细胞MCF-7刺激雌激素产生,而单纯的7β-OH-豆甾醇氧化物作用则出现了抗雌激素反应[43],van den Heuvel等[44]却发现,谷甾醇氧化物和豆甾醇氧化物的混合物仅影响雄性激素分泌而对雌性激素没有影响,所以POPs对于性激素的影响可能要对不同种类的氧化物分别研究才能定论。
6.2.4 细胞毒性
POPs的细胞毒性是目前研究和报道较多的。Adcox等[45]首先提出高浓度下POPs具有细胞毒性,甚至引起细胞凋亡,高俊兰[46]也对POPs的细胞毒性进行了初探,发现其与COPs有类似的毒性,但毒性远低于 COPs。具体研究[47-49]表明,β-谷甾醇氧化物细胞凋亡的水平最高,在U937细胞中,同等浓度下triol-衍生物细胞毒性最大,但7β-OH衍生物和7-keto衍生物的细胞凋亡水平最高,且VC的添加可减少它们的细胞毒性,更有新型豆甾醇衍生物5,6,22,23-二环氧基豆甾烷和5,6-环氧基豆甾烷-22S,23S-二醇表现出了低浓度(30 μmol/L)高凋亡毒性[50],但 POPs的这点对于化学疗法选择性致死癌症细胞具有一定的研究价值。
Ryan等[49]在探究 POPs致使细胞凋亡的途径时,发现7β-OH-谷甾醇氧化物和所有的豆甾醇氧化物都能降低U937细胞中谷胱甘肽,从而引起线粒体膜电位损失,最终使细胞色素c释放进入胞液,活化细胞凋亡的蛋白酶,但是确切途径还需进一步验证。
总之,POPs的安全性问题尚未完全定论,对人体健康的具体影响和分析方法以及如何最小化其在食品和人体内含量是今后研究的重要方向。
7 结论
PS作为一种有效的生物活性组分已被广泛应用在食品、医药和化妆品等行业。目前,利用超临界萃取或固相萃取等现代提取分离技术提取植源性基料中的PS是期望的,再通过高速逆流色谱法分离纯化,得到的精制PS再用GC分析。对于PS溶解性差的问题,主要引入了多不饱和脂肪酸进行油溶改性,使其营养功能最大化。在正常剂量下天然PS对人体基本无害,但对儿童和孕妇的影响还有待研究。至于POPs,它不仅没有降胆固醇效果,还可能引起动脉粥样硬化和炎症反应,干扰性激素分泌,并具有细胞毒性,高浓度下甚至引起细胞凋亡,因此探究各种POPs的生理活性和安全性问题将是今后研究的重要方向。
[1] Phillips K M,Ruggio D M,Ashraf-Khorassani M.Phytosterol composition of nuts and seeds commonly consumed in the United States[J].Journal of Agricultural and Food Chemistry,2005,53(24):9 436-9 445.
[2] Nurmi T,Lampi A M,Nyström L,et al.Distribution and composition of phytosterols and steryl ferulates in wheat grain and bran fractions [J].Journal of Cereal Science,2012,56(2):379-388.
[3] Ostlund Jr R E.Phytosterols and cholesterol metabolism[J].Current Opinion in Lipidology,2004,15(1):37-41.
[4] Panpipat W,XU X,GUO Z.Towards a commercially potential process:Enzymatic recovery of phytosterols from plant oil deodoriser distillates mixture[J].Process Biochemistry,2012,47(8):1 256-1 262.
[5] Copeland D,Belcher W M.Methods for Treating Deodorizer Distillate[P].US,6,750,359.2004-06-15.
[6] Vilela C,Santos S A O,Oliveira L,et al.The ripe pulp of Mangifera indica L.:A rich source of phytosterols and other lipophilic phytochemicals[J].Food Research International,2013,54(2):1 535-1 540.
[7] Rohr R,Rohr R,Trujillo-Quijano J A.Process for Separating Unsaponifiable Valuable Products from Raw Materials[P].US 6,846,941.2005-01-25.
[8] Nuissier G,Bourgeois P,Grignon-Dubois M,et al.Composition of sugarcane waxes in rum factory wastes[J].Phytochemistry,2002,61(6):721-726.
[9] LIANG Y T,WONG W T,GUAN L,et al.Effect of phytosterols and their oxidation products on lipoprotein profiles and vascular function in hamster fed a high cholesterol diet[J].Atherosclerosis,2011,219(1):124-133.
[10] Alemany L,Laparra J M,Barberá R,et al.Relative expression of cholesterol transport-related proteins and inflammation markers through the induction of 7-ketosterolmediated stress in Caco-2 cells[J].Food and Chemical Toxicology,2013,56:247-253.
[11] Furlan C P B,Marineli R S,Marostica Junior M R.Conjugated linoleic acid and phytosterols counteract obesity induced by high-fat diet[J].Food Research International,2013,51(1):429-435.
[12] Nomaguchi K,Tanaka M,Misawa E,et al.Aloe vera phytosterols act as ligands for PPAR and improve the expression levels of PPAR target genes in the livers of mice with diet-induced obesity[J].Obesity Research & Clinical Practice,2011,5(3):190-201.
[13] Marineli R S,Furlan C P B,Marostica Jr M R.Antioxidant effects of the combination of conjugated linoleic acid and phytosterol supplementation in Sprague–Dawley rats[J].Food Research International,2012,49(1):487-493.
[14] Llaverias G,Escolà-Gil J C,Lerma E,et al.Phytosterols inhibit the tumor growth and lipoprotein oxidizability induced by a high-fat diet in mice with inherited breast cancer[J].The Journal of Nutritional Biochemistry,2013,24(1):39-48.
[15] Czuppon T,Kemeny Z,Kovari E,et al.Process for Recovery of Plant Sterols from By-product of Vegetable Oil Refining[P].US,7,368,583.2008-06-06.
[16] YANG H,YAN F,WU D,et al.Recovery of phytosterols from waste residue of soybean oil deodorizer distillate[J].Bioresource Technology,2010,101(5):1 471-1 476.
[17] Hamunen A.Process for Isolation of Fatty Acids,Resin Acids and Sterols from Tall Oil Pitch[P] US,8,450,453.2013-05-28.
[18] LU B,ZHANG Y,WU X,et al.Separation and determination of diversiform phytosterols in food materials using supercritical carbon dioxide extraction and ultraperformance liquid chromatography-atmospheric pressure chemical ionization-mass spectrometry[J].Analytica Chimica Acta,2007,588(1):50-63.
[19] Balme S,Gülaüar F O.Rapid screening of phytosterols in orange juice by solid-phase microextraction on polyacrylate fibre derivatisation and gas chromatographic–mass spectrometric[J].Food Chemistry,2012,132(1):613-618.
[20] XIAO X H,YUAN Z Q,LI G K.Preparation of phytosterols and phytol from edible marine algae by microwaveassisted extraction and high-speed counter-current chromatography[J].Separation and Purification Technology,2013,104:284-289.
[21] Schröder M,Vetter W.Investigation of unsaponifiable matter of plant oils and isolation of eight phytosterols by means of high-speed counter-current chromatography[J].Journal of Chromatography A,2012,1237:96-105.
[22] Toivo J,Phillips K,Lampi A M,et al.Determination of sterols in foods:Recovery of free,esterified,and glycosidic sterols[J].Journal of Food Composition and Analysis,2001,14(6):631-643.
[23] Santos R,Limas E,Sousa M,et al.Optimization of analytical procedures for GC–MS determination of phytosterols and phytostanols in enriched milk and yoghurt[J].Food Chemistry,2007,102(1):113-117.
[24] Kim N S,Lee J H,Han K M,et al.Discrimination of commercial cheeses from fatty acid profiles and phytosterol contents obtained by GC and PCA [J].Food Chemistry,2014,143:40-47.
[25] Ostlund Jr R E.Sitostanol Formulation with Emulsifier to Reduce Cholesterol Absorption and Method for Preparing and Use of Same[P].US,6,063,776.2000-05-16.
[26] CHEN J W,Hsieh H J,WU W T.Method of Emulsifying Phytosterolby NaturalSaponin,Emulsion Prepared Thereby and Water Dispersible Phytosterol Powder Product[P].US,11/179,472.2005-07-13.
[27] 张娟聪,潘秋月,孟祥河,等.β-环糊精改善植物甾醇水溶性的研究[J].中国粮油学报,2008,23(4):111-114.
[28] 吕晓玲,温娟,陶东川,等.植物甾醇及其环糊精包合物对高血脂小鼠降血脂实验研究[J].食品工业科技,2011(9):393-398.
[29] 周阳.植物甾烷醇油溶性及水溶性的改性研究[D].无锡:江南大学,2013.
[30] MENG X,SUN P,PAN Q,et al.Synthesis of plant sterol esters catalyzed by heteropolyacid in a solvent‐free system [J].European Journal of Llipid Science and Technology,2006,108(1):13-18.
[31] Valange S,Beauchaud A,Barrault J,et al.Lanthanum oxides for the selective synthesis of phytosterol esters:Correlation between catalytic and acid–base properties[J].Journal of Catalysis,2007,251(1):113-122.
[32] ZHENG M M,DONG L,LU Y,et al.Immobilization of Candida rugosa lipase on magnetic poly(allyl glycidyl ether-co-ethylene glycol dimethacrylate)polymer microsphere for synthesis of phytosterol esters of unsaturated fatty acids[J].Journal of Molecular Catalysis B:Enzymatic,2012,74(1):16-23.
[33] Hellner G,T″ok e E R,Nagy V,et al.Integrated enzymatic production of specific structured lipid and phytosterol ester compositions[J].Process Biochemistry,2010,45(8):1 245-1 250.
[34] 季国志,钱文涛,陈伟,等.α-亚麻酸、植物甾醇酯复方牛奶降血脂功能研究[J].中国乳品工业,2012,40(7):35-36.
[35] Rudzińska M,Przybylski R,Wᶏsowicz E.Degradation of phytosterols during storage of enriched margarines[J].Food Chemistry,2014,142:294-298.
[36] Menéndez-Carreño M,Steenbergen H,Janssen H G.Development and validation of a comprehensive two-dimensional gas chromatography–mass spectrometry method for the analysis of phytosterol oxidation products in human plasma [J].Analytical and Bioanalytical Chemistry,2012,402(6):2 023-2 032.
[37] Katan M B,Grundy S M,Jones P,et al.Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels[C]//Mayo Clinic Proceedings.Elsevier,2003,78(8):965-978.
[38] Patel S B.Plant sterols and stanols:their role in health and disease[J].Journal of Clinical Lipidology,2008,2(2):11-19.
[39] Lea L J,Hepburn P A.Safety evaluation of phytosterolesters.Part 9:Results of a European post-launch monitoring programme [J].Food and Chemical Toxicology,2006,44(8):1 213-1 222.
[40] Plat J,Nichols J A,Mensink R P.Plant sterols and stanols:effects on mixed micellar composition and LXR(target gene)activation[J].Journal of Lipid Research,2005,46(11):2 468-2 476.
[41] YANG C,CHEN Z Y,WONG S L,et al. β-Sitosterol oxidation products attenuate vasorelaxation by increasing reactive oxygen species and cyclooxygenase-2 [J].Cardiovascular Research,2013,97(3):520-532.
[42] Vejux A,Montange T,Martine L,et al.Absence of oxysterol-like side effects in human monocytic cells treated with phytosterols and oxyphytosterols[J].Journal of Agricultural and Food Chemistry,2012,60(16):4 060-4 066.
[43] Newill H,Loske R,Wagner J,et al.Oxidation products of stigmasterol interfere with the action of the female sex hormone 17β‐ estradiol in cultured human breast and endometrium cell lines[J].Molecular Nutrition & Food Research,2007,51(7):888-898.
[44] Van Den Heuvel M R,Leusch F D L,Taylor S,et al.Assessment of the reproductive-endocrine disrupting potential of chlorine dioxide oxidation products of plant sterols[J].Environmental Science & Technology,2006,40(8):2 594-2 600.
[45] Adcox C,Boyd L,Oehrl L,et al.Comparative effects of phytosterol oxides and cholesterol oxides in cultured macrophage-derived cell lines[J].Journal of Agricultural and Food Chemistry,2001,49(4):2 090-2 095.
[46] 高俊兰.植物甾醇氧化物的制备及其细胞毒性的初探[D].合肥:安徽农业大学,2012.
[47] Kenny O,O'Callaghan Y,O'Connell N M,et al.Oxidized derivatives of dihydrobrassicasterol:cytotoxic and apoptotic potential in U937 and HepG2 cells[J].Journal of Agricultural and Food Chemistry,2012,60(23):5 952-5 961.
[48] O'Callaghan Y,Kenny O,O'Connell N M,et al.Synthesis and assessment of the relative toxicity of the oxidised derivatives of campesterol and dihydrobrassicasterol in U937 and HepG2 cells [J].Biochimie,2013,95(3):496-503.
[49] Ryan E,Chopra J,McCarthy F,et al.Qualitative and quantitative comparison of the cytotoxic and apoptotic potential of phytosterol oxidation products with their corresponding cholesterol oxidation products[J].The British Journal of Nutrition,2005,94(3):443-451.
[50] O'Callaghan Y C,Foley D A,O'Connell N M,et al.Cytotoxic and apoptotic effects of the oxidized derivatives of stigmasterol in the U937 human monocytic cell line[J].Journal of Agricultural and Food Chemistry,2010,58(19):10 793-10 798.

