L-丝氨酸的微生物法制备研究进展*
朱林江,李崎
1(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡,214122)
2(江南大学食品安全与营养协同创新中心,江苏无锡,214122)
L-丝氨酸属于非必需氨基酸,但具有重要的生理功能和应用价值,已被应用于医药、食品和化妆品等领域,包括医药领域的氨基酸输液和滴眼液,食品领域的饮料添加剂以及化妆品领域的天然保湿因子等。其生产方法有化学合成法、蛋白水解法、酶的生物转化法、微生物细胞的前体转化和微生物直接发酵法等[1]。目前,主要的生产方式是微生物前体转化,但生产成本偏高,使L-丝氨酸的价格仍保持较高水平,其中医药级的L-丝氨酸价格约为40美元/kg。与其他氨基酸不同,L-丝氨酸是细胞中心代谢的产物,而非典型的代谢途径末端产物,胞内代谢运转速度较快,其生物制备难度较大。
随着现代生物技术的不断发展,特别是代谢工程、合成生物学和基因组工程的快速发展,人们对工业微生物的生理和代谢改造能力进一步加强,能够重构各种化合物的合成途径,包括氨基酸、有机酸、新型能源化合物以及生物材料等等[2-3]。因此,通过微生物直接利用廉价的糖质原料发酵生产L-丝氨酸的制备方法重新受到关注。通过实时代谢通量分析,解析了L-丝氨酸中心代谢流的部分特征[4];通过代谢工程方法,提高了微生物直接发酵法生产L-丝氨酸的能力,产量达到了35 g/L以上[5-6]。本文从 L-丝氨酸作为中心代谢产物的特征、微生物前体转化制备方法以及丝氨酸合成途径的代谢工程改造3个方面阐述其相关研究进展,并探讨存在的问题。
1 L-丝氨酸的中心代谢产物特征
许多氨基酸的合成途径较为复杂,但一般是合成代谢途径的末端产物,分解途径较为简单。而L-丝氨酸的合成途径刚好相反,如图1所示。
图1在微生物细胞内的典型L-丝氨酸合成途径中,合成步骤较为简单:即葡萄糖经过EMP途径,到关键的L-丝氨酸合成前体3-磷酸甘油酸(3-BG),再通过3步的酶促反应生成L-丝氨酸。这3步反应分别是:①NAD+依赖的3-磷酸甘油酸脱氢酶(PGDH)催化氧化3-BG生成3-羟磷酸丙酮;②在磷酸丝氨酸氨基转移酶(PSAT)催化下进行转氨反应,生成3-磷酸丝氨酸;③最后,由磷酸丝氨酸磷酸酶(PSP)催化生成L-丝氨酸。这一简单的合成途径,同样存在着典型的氨基酸反馈调节机制。如在谷氨酸棒杆菌中[4],PGDH受到L-丝氨酸的反馈调节,其调控活性中心均位于酶的C-端,与天冬氨酸脱氢酶、高丝氨酸脱氢酶和苏氨酸脱氢酶等氨基酸合成代谢途径中的关键酶相似,可通过点突变消除L-丝氨酸的反馈抑制作用。
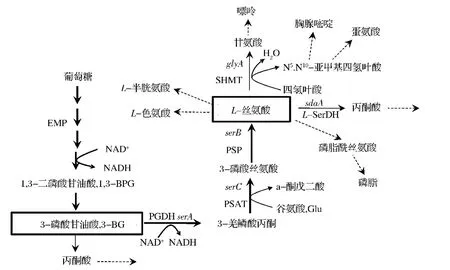
图1 胞内L-丝氨酸的合成代谢途径Fig.1 Metabolic pathway of L-serine synthesis in microbial cell
尽管L-丝氨酸的合成代谢途径较为简单,但在胞外过量积累的难度却较大。这是由于L-丝氨酸存在复杂的分解代谢途径,并参与了胞内C-1活性单元的循环,即属于胞内中心代谢产物。如图1所示,L-丝氨酸是许多胞内化合物合成的前体物,包括甘氨酸、半胱氨酸、色氨酸等氨基酸,嘌呤、胸腺嘧啶之类的核酸碱基以及磷脂酰丝氨酸(磷脂合成)。通过同位素示踪实验证实,若胞内过量积累丝氨酸,会迅速地被丝氨酸脱水酶L-SerDH催化生成丙酮酸,进入细胞的主代谢流[7]。此外,丝氨酸羟甲基转移酶(SHMT)与四氢叶酸共同作用,将L-丝氨酸被转变为甘氨酸,此反应为细胞提供了重要的C-1单元化合物N5,N10-亚甲基四氢叶酸。该C-1化合物可进一步转换为其他活性的C-1单元化合物,包括5-甲基四氢叶酸和10-甲基四氢叶酸。这3种C-1活性化合物参与胞内多种重要化合物的合成,包括蛋氨酸、嘧啶、D-泛酸和tRNAfMet。随后重新被转化为四氢叶酸,完成1次C-1单元的循环。由于C-1循环参与了这些胞内重要代谢物的合成,使SHMT的表达是细胞生长所必需的[8]。在E.coli中,通过SHMT的碳代谢流通量被估计占总EMP途径通量的15%。而在谷氨酸帮杆菌中,流经丝氨酸的碳代谢通量占全细胞葡萄糖碳代谢通量的7.5%[9]。所以,L-丝氨酸合成代谢途径,除了具有典型的氨基酸合成途径中的反馈调节和支路竞争等之外,同时还为细胞提供重要生物活性的C-1单元,是胞内重要的中心代谢产物。所以,L-丝氨酸在胞内的代谢运转速度极快,参与胞内C-1单元循环,部分降解分支途径不能直接删除,极大地增加生物法制备L-丝氨酸的难度。
2 L-丝氨酸的微生物前体转化制备方法
由于L-丝氨酸在胞内的中心代谢物特征,通过传统氨基酸生产菌选育方法难以得到高产菌株,比如用氨基酸结构类似物消除反馈抑制和营养缺陷型菌株筛选等方法,只能选育得到数克每升合成能力的突变菌株[10]。由此,人们转向了微生物前体转化的方法制备L-丝氨酸,即利用SHMT催化反应的逆反应,将较为便宜的前体物如甘氨酸转变为丝氨酸。该逆反应是将外加的甘氨酸和胞内活性C-1单元N5,N10-亚甲基四氢叶酸转变为丝氨酸和四氢叶酸。为使微生物细胞实现这种逆反应,并过量积累丝氨酸,需要选育甘氨酸耐受性的菌株,同时能够利用简单的C-1单元化合物(如甲醇或甲醛)取代胞内合成的活性C-1单元化合物。后来发现一些甲基营养型细菌具备这种代谢特征,它们的SHMT能够以外加的简单C-1单元化合物为底物合成丝氨酸,如一些假单胞菌(Pseudomonas)、石蜡节杆菌(Arthrobacter paraffineus)、嗜甲基生丝微菌(Hyphomicrobium methylovorum)、球形节杆菌(Arthrobacter globiformis)和白八叠球菌(Sarcina albida)等[6,10]。这些细菌被证实能够通过乙醛酸循环和丝氨酸循环,如图2所示,吸收胞外的C-1单元化合物作为营养物质,合成丙酮酸,提供细胞的生长[11]。所以改造这些甲基营养型细菌,可应用前体物甘氨酸、C-1单元化合物甲醇或甲醛,通过SHMT介导的生物转换的方法制备L-丝氨酸。
选育的微生物前体物转化方法生产L-丝氨酸的菌株包括[6]:①假单胞菌3ab,在甲醇为唯一碳源的培养基中,将甘氨酸转化为丝氨酸,摩尔转化率达到50%,丝氨酸产量约7 g/L;②假单胞菌MS31,同样利用甲醇,通过选育,降低丝氨酸的降解,使产量可达24 g/L;③嗜甲基生丝微菌GM2,利用甲醇,经过提高甲醇脱氢酶和SHMT的活性,并结合分批次补料和稳定期细胞的发酵策略,合成了45 g/L的丝氨酸,其甘氨酸的摩尔转化率为50%[12];④球形节杆菌和白八叠球菌,可积累21 g/L的丝氨酸。以上选育的菌株均能直接利用胞外简单的C-1化合物,L-丝氨酸产量得到了显著提高,但甘氨酸转化率并不高,增加了丝氨酸的生产成本。后来选育了1株具有较高转化率的甲基营养型(Methylobacterium sp.)菌株MN43,利用甲醇,将甘氨酸转化为丝氨酸的效率接近93%,且能够合成65 g/L的丝氨酸,具备了良好的生产性能[13]。由于高浓度的甘氨酸会抑制细胞的生长以及丝氨酸在胞内降解的不可避免性,由此衍生出了另一种微生物转化的方法,即利用过量表达了SHMT酶的渗透性细胞或裂解的胞浆,将甘氨酸直接转化合成丝氨酸,消除L-丝氨酸的降解反应。其典型的例子是产气克氏杆菌(Klebsiella aerogenes)[14],通过胞内高效过量表达E.coli来源的SHMT,使表达的酶蛋白占细胞总蛋白的10%,并将30 g/L的高密度细胞渗透化或破碎,添加一定浓度的四氢叶酸和甲醛的条件下,高效转化甘氨酸为丝氨酸,其转化率达到88%,且丝氨酸产量达到了450 g/L。不过,该方法的原料成本和胞浆制作成本相对较高。随着分子生物学方法在工业菌株改造中的广泛应用,近几年,针对甲基营养型细菌利用C-1化合物进行生物转化生产L-丝氨酸的特征,已有遗传改造的研究报到,即通过表达载体提高胞内SHMT表达水平,从而显著性提高L-丝氨酸的产率[15];或是筛选不同生物来源的高活性SHMT 酶,如海藻希瓦氏菌[16]和变形假单胞菌[17],应用于甲基营养型细菌中,提高其L-丝氨酸转化效率。
3 从糖质原料发酵制备L-丝氨酸

图2 甲基营养型细菌固定化甲醇和甲醛的丝氨酸循环和乙醛酸再生循环Fig.2 Methanol and formaldehyde fixation via the serine cycle and glyoxylate regeneration cycle in methylotrophs
随着现代生物技术的快速发展,人们对微生物的改造能力不断增强,采用低成本的糖质原料发酵生产L-丝氨酸的微生物直接发酵法重新受到关注。目前,已通过传统诱变育种和代谢工程相结合的方法,选育了一些具有工业应用潜力的L-丝氨酸生产菌株,从葡萄糖或蔗糖直接发酵合成L-丝氨酸。其中典型菌株包括:①德国的Eggeling课题组通过代谢工程策略,改造谷氨酸帮杆菌的模式菌株Corynebacterium glutamicum ATCC 13032,成为了1株性能良好的L-丝氨酸生产菌株。其主要策略包括解除了L-丝氨酸合成途径关键酶PGDH的反馈抑制、强化从3-磷酸甘油酸合成丝氨酸的合成途径、消除丝氨酸脱水酶LSerDH介导的降解途径和调节C-1单元循环等,最终使谷氨酸棒杆菌在简单的葡萄糖培养基中,胞外积累35 g/L 以上的 L-丝氨酸[5,18],也有报道其产量已达到了50 g/L[6]。②由许正宏课题组选育的谷氨酸棒杆菌SYPS-062,该菌株通过多次诱变育种和相似的代谢工程策略,即消除反馈抑制、强化合成途径、消弱降解途径等,使该菌株能够在蔗糖的简单培养基中,合成25 g/L以上的丝氨酸,但其副产物丙氨酸和缬氨酸积累较高[19-20]。通过发酵培养基的优化,产量也已达到30 g/L的水平。③新疆农业科学院微生物所保藏有1株黄色短杆菌S112(Brevibacterium flavum),通过诱变育种和遗传育种相结合,解除了反馈抑制和扩增上游的合成路径,使该菌株合成丝氨酸的能力达到了18 g/L[21],具备良好的工业应用潜力。④其他一些通过代谢工程改造的菌株,包括解除反馈抑制和减弱降解途径的谷氨酸奉杆菌SER-8[22]和大肠杆菌NW-7[23],但其 L-丝氨酸合成水平均较低。
以上选育的L-丝氨酸生产菌,主要通过代谢工程方法进行改造,其主要策略包括:(1)消除合成途径中的反馈抑制。在谷氨酸帮杆菌中,PDGH由serA基因编码,含有530个氨基酸,其C-端部分序列与催化功能无关,但被证实包含L-丝氨酸的变构调节中心。通过删除第197个氨基酸,可完全消除丝氨酸的反馈抑制,同时不影响催化活性[4]。而在大肠杆菌中,通过改造PDGH的His344和Asn346两个位点为丙氨酸,可消除丝氨酸的反馈抑制[23]。(2)强化上游的合成途径,主要是过量表达serB和serC以及经过改造serA。(3)消弱L-丝氨酸的降解途径。主要涉及两条降解途径,即丝氨酸脱氢酶(sdaA编码)催化其转换为丙酮酸,从而进入主代谢流,通过删除sdaA可有效地降低丝氨酸的降解速率;通过SHMT酶(glyA编码)催化其转化为甘氨酸,由于该酶是细胞生长所必需的,所以通过减弱glyA的表达或采用人工诱导启动子控制其表达,可有效地阻止丝氨酸的降解,但也会降低细胞的生长速率[18,24]。(4)C-1 单元循环的调控。该策略是通过调控SHMT催化反应中的辅因子四氢叶酸的合成水平,从而有效控制丝氨酸转化为甘氨酸反应。即通过删除四氢叶酸合成途径中的pabAB基因,降低胞内四氢叶酸的浓度,使其成为生长的限制性因子,有效地减弱L-丝氨酸的降解速率,使其在发酵初期便开始积累,提高了生产速率[5,25]。细胞生长所需的四氢叶酸,则以外加叶酸的方式或添加复合发酵培养基的方法,如玉米浆等[5],用于发酵过程的优化控制。这种应用维生素为限制性因子,促进目的代谢产物的积累,已成为代谢工程改造的一个新策略,被应用到其他氨基酸的合成中,如限制泛酸的浓度,提高缬氨酸的合成[26]。
通过以上代谢工程策略,使菌株生产中心代谢产物L-丝氨酸的能力显著提高。其中,改造中心代谢产物L-丝氨酸合成途径的特殊策略是以四氢叶酸作为限制性辅因子对其合成进行改造,取代了胞内重要代谢酶的调控,同时删除了sadA介导的降解分支,不但积累高浓度的丝氨酸,而且保持较好的生长速率。不过,丝氨酸代谢工程改造中仍有存在一些问题亟待解决,比如副产物积累的问题,即部分碳流通过EMP途径流经丙酮酸,从而形成副产物,比如丙氨酸和缬氨酸[27-28];当胞外糖源浓度下降时,细胞开始利用胞外积累的丝氨酸作为营养物质,造成发酵液中的残糖浓度难以降低到较低水平,不利于工业生产,所以需要进一步调控生产菌株降解丝氨酸性能;此外生产菌株的转化率有待进一步提高。针对以上这些问题,需要我们应用系统生物学技术进一步认识丝氨酸作为中心代谢物在细胞能量代谢、C-1单元活性化合物循环和其他潜在的合成途径中所起的作用[29],更好地解决中心代谢产物积累的技术难题;将系统生物学技术与L-丝氨酸发酵条件优化相结合,理解溶氧水平、碳代谢流方向以及辅酶平衡等因素对L-丝氨酸胞外积累的影响;同时需要借助最新发展的高效的基因组工程技术[2],包括已经在谷氨酸棒杆菌中实现了的寡核苷酸介导的多位点基因组同步修饰技术[30],对生产菌株的基因组进行高效改造;增强菌株利用不同糖质原料的能力,包括淀粉、木糖等[31-32],降低微生物发酵制备L-丝氨酸的成本。
[1] 冯美卿,曹秀格,卢永辉.L-丝氨酸制备方法评述[J].氨基酸和生物资源,2000,22(3):42-44.
[2] Esvelt K M,Wang H H.Genome-scale engineering for systems and synthetic biology[J].Molecular Systems Biology,2013,9:641.
[3] Park J H,Lee S Y.Towards systems metabolic engineering of microorganisms for amino acid production [J].Curr Opin Biotechnol,2008,19(5):454-460.
[4] Peters-Wendisch P,Netzer R,Eggeling L,et al.3-phosphoglycerate dehydrogenase from Corynebacterium glutamicum:the C-terminal domain is not essential for activity but is required for inhibition by L-serine [J].Appl Microbiol Biotechnol,2002,60(4):437-441.
[5] Stolz M,Peters-Wendisch P,Etterich H,et al.Reduced folate supply as a key to enhanced L-serine production by Corynebacterium glutamicum [J].Appl Environ Microbiol,2007,73(3):750-755.
[6] Wendisch V F.Amino acid biosynthesis:pathways,regulation,and metabolic engineering[M].Berlin;New York:Springer,2007:259-272.
[7] Netzer R,Peters-Wendisch P,Eggeling L,et al.Cometabolism of a nongrowth substrate:L-serine utilization by Corynebacterium glutamicum [J].Appl Environ Microbiol,2004,70(12):7 148-7 155.
[8] Simic P,Willuhn J,Sahm H,et al.Identification of glyA(encoding serine hydroxymethyltransferase)and its use together with the exporter ThrE to increase L-threonine accumulation by Corynebacterium glutamicum[J].Appl Environ Microbiol,2002,68(7):3 321-3 327.
[9] Marx A,de Graaf A A,Wiechert W,et al.Determination of the fluxes in the central metabolism of Corynebacterium glutamicum by nuclear magnetic resonance spectroscopy combined with metabolite balancing[J].Biotechnol Bioeng,1996,49(2):111-129.
[10] Enei H,Yokozeki K,Akashi K.Recent progress in microbial production of amino acids[M].New York:Gordon and Breach,1989.
[11] Laukel M,Rossignol M,Borderies G,et al.Comparison of the proteome of Methylobacterium extorquens AM1 grown under methylotrophic and nonmethylotrophic conditions[J].Proteomics,2004,4(5):1 247-1 264.
[12] Izumi Y,Yoshida T,Miyazaki S S,et al.L-serine production by a methylotroph and its related enzymes[J].Appl Microbiol Biotechnol,1993,39(4-5):427-432.
[13] Hagishita T,Yoshida T,Izumi Y,et al.Efficient L-serine production from methanol and glycine by resting cells of Methylobacterium sp.strain MN43 [J].Biosci Biotechnol Biochem,1996,60(10):1 604-1 607.
[14] Hsiao H Y,Wei T.Enzymatic production of L-serine with a feedback control system for formaldehyde addition [J].Biotechnol Bioeng,1986,28(10):1 510-1 518.
[15] SHEN P,CHAO H,JIANG C,et al.Enhancing production of L-serine by increasing the glyA gene expression in Methylobacterium sp.MB200 [J].Appl Biochem Biotechnol,2010,160(3):740-750.
[16] JIANG W,XIA B,LIU Z.A serine hydroxymethyltransferase from marine bacterium Shewanella algae:Isolation,purification,characterization and L-serine production[J].Microbiol Res,2013,168(8):477-484.
[17] JIANG W,XIA B,HUANG J,et al.Characterization of a serine hydroxymethyltransferase for L-serine enzymatic production from Pseudomonas plecoglossicida [J].World J Microbiol Biotechnol,2013,29(11):2 067-2 076.
[18] Peters-Wendisch P,Stolz M,Etterich H,et al.Metabolic engineering of Corynebacterium glutamicum for L-serine production [J].Appl Environ Microbiol,2005,71(11):7 139-7 144.
[19] 罗玉常.产L-丝氨酸谷氨酸棒杆菌SYPS-062的代谢工程[D].无锡:江南大学,2012.
[20] 徐国强.L-丝氨酸高产菌株的选育及发酵条件优化[D]. 无锡:江南大学,2008.
[21] 谢玉清,罗淑萍,茆军.L-丝氨酸产生菌c-11中serA基因的克隆与表达[J].新疆农业科学,2007,44(5):652-653.
[22] LAI S,ZHANG Y,LIU S,et al.Metabolic engineering and flux analysis of Corynebacterium glutamicum for L-serine production [J].Sci China Life Sci,2012,55(4):283-290.
[23] LI Y,CHEN G K,TONG X W,et al.Construction of Escherichia coli strains producing L-serine from glucose[J].Biotechnology Letters,2012,34(8):1 525-1 530.
[24] 金雪霞,张晓梅,窦文芳,等.谷氨酸棒杆菌SYPS-062 L-丝氨酸脱水酶活性分析及其基因敲除对L-丝氨酸积累的影响[J].中国生物工程杂志,2011,31(1):29-34.
[25] ZHANG X,XU G,LI H,et al.Effect of cofactor folate on the growth of Corynebacterium glutamicum SYPS-062 and L-serine accumulation [J].Appl Biochem Biotechnol,2014,DOI 10.1007/s12010-014-0945-8.
[26] Radmacher E,Vaitsikova A,Burger U,et al.Linking central metabolism with increased pathway flux:L-valine accumulation by Corynebacterium glutamicum[J].Appl Environ Microbiol,2002,68(5):2 246-2 250.
[27] 苑亮,张晓梅,窦文芳,等.氨基脱氧分支酸合成酶对Corynebacterium glutamicum SYPS-062积累L-丝氨酸的影响[J].生物技术通报,2011(6):211-217.
[28] 罗玉常,窦文芳,张晓梅,等.谷氨酸棒杆菌ilvE基因的敲除对相关氨基酸合成的影响[J].生物技术通报,2012(11):185-191.
[29] 张晓梅,窦文芳,许泓瑜,等.谷氨酸棒杆菌SYPS-062合成L-丝氨酸的代谢通量分析[J].生物工程学报,2010,26(10):1 363-1 371.
[30] Binder S,Siedler S,Marienhagen J,et al.Recombineering in Corynebacterium glutamicum combined with optical nanosensors:a general strategy for fast producer strain generation [J].Nucleic Acids Res,2013,41(12):6 360-6 369.
[31] Kawaguchi H,Vertes A A,Okino S,et al.Engineering of a xylose metabolic pathway in Corynebacterium glutamicum[J].Appl Environ Microbiol,2006,72(5):3 418-3 428.
[32] Tateno T,Fukuda H,Kondo A.Production of L-Lysine from starch by Corynebacterium glutamicum displaying alpha-amylase on its cell surface[J].Appl Microbiol Biotechnol,2007,74(6):1 213-1 220.

