山东省鸡传染性法氏囊病流行现状及病毒特性
蒋文明,庄青叶,王素春,李金平,侯广宇,陈继明
(中国动物卫生与流行病学中心,山东青岛 266032)
山东省鸡传染性法氏囊病流行现状及病毒特性
蒋文明,庄青叶,王素春,李金平,侯广宇,陈继明
(中国动物卫生与流行病学中心,山东青岛 266032)
用RT-PCR方法对山东省疑似传染性法氏囊病(IBD)组织样品进行检测,对阳性样品进行了病毒分离,设计引物扩增出分离病毒的全基因组。谱系分析表明,除WF株外,其他分离株与国内大部分强毒株位于同一个谱系。序列分析表明,LY、QD、BZ、LC、TA、DZ、HZ、JN分离株VP2七肽基序均为S-W-S-A-S-G-S,在第222、253、256、279、284、294和299位上的氨基酸残基分别是A、Q、I、D、A、I和S,具有IBDV强毒的分子特征。攻毒试验表明,LY株产生明显IBD病变,死亡率为40%(2/5),为强毒株,结果与序列分析一致。WF株与B87和Gt疫苗株位于同一谱系,VP2分子特征也与Gt弱毒株相同,攻毒试验显示WF株为弱毒株。同源性分析表明,LY、QD、BZ、LC、TA、DZ、HZ、JN与国内分离的强毒株之间VP2氨基酸序列的同源性为93.3%~99.8%,与现行商品疫苗毒株B87和Gt的VP2氨基酸序列同源性分别为94.1~96.2%和94.5~96.9%;WF分离株与国内分离株之间VP2氨基酸同源性为95.6%~99.2%,与疫苗株B87和Gt株VP2氨基酸同源性分别为99.2%和99.6%。本文对山东省流行的鸡传染性法氏囊病毒进行了分子流行病学分析,对病毒的基因组学和致病性进行了初步研究,此研究对了解本病的流行现状,分析病毒变异规律具有重要意义。
传染性法氏囊病;RT-PCR;基因组;VP2蛋白
传染性法氏囊病(IBD)又称甘布罗病(Gumboro disease),由双股RNA病毒科、禽双股RNA病毒属的传染性法氏囊病病毒(IBDV)引起。虽然火鸡、鸭、珍珠鸡和鸵鸟均可感染IBDV,但仅鸡临床上发病,且仅损害幼鸡。该病不但致染病动物死亡,还导致机体免疫抑制,使机体的免疫防御能力降低和疫苗免疫接种失败。
IBDV基因组包括A、B两个片段,编码5种病毒蛋白:VP1、VP2、VP3、VP4和VP5。VP1由B片段编码,为病毒自身编码的依赖RNA的RNA聚合酶。其他4种病毒蛋白由A片段编码的多聚蛋白加工而成:VP2和VP3是病毒的主要结构蛋白,构成病毒衣壳,VP4为病毒自身蛋白酶,VP5的功能尚不明确。VP2是病毒的主要保护性抗原,具有血清型特异性,已经鉴定的中和表位主要在VP2上,并且均为构象依赖性[1-3]。此外,VP2还与病毒的毒力和细胞嗜性有关[4]。
20世纪80年代中后期,在世界范围内暴发了在抗原性和致病性等方面与经典毒株有很大差异的IBDV变异毒株(包括超强毒株,vvIBDV)导致的IBD,使养鸡业遭受了重创[5]。变异株和vvIBDV的出现使该病的防控难度加大,IBD免疫失败已成为禽病防控的重要问题[6]。因此,进一步分析当前流行的IBDV分子遗传变异特征对研制新型IBD疫苗、提高IBDV免疫防控效果具有重要的理论与现实意义。国内外对IBDV的分子流行病学分析主要是针对VP2基因,为此,作者对山东省当前流行的IBDV进行了分离和全基因组测序,并进一步分析了VP2基因的分子特征,对IBDV的流行现状进行了探讨。
1 材料与方法
1.1 病料来源
病料来自2013-2014年山东省临沂、潍坊、青岛、滨州、聊城、泰安、德州、菏泽、济宁等地区发生疑似传染性法氏囊病的鸡场,采集发病鸡的法氏囊组织,研磨冻融,-20℃保存备用。
1.2 主要试剂
QIAamp Viral RNA Mini Kit购自Qiagen公司,HiScript II One Step RT-PCR Kit购自Vazyme公司,TOPO克隆试剂盒购自Clone Smarter公司。
1.3 传染性法氏囊病毒核酸检测
1.3.1 引物设计。根据GenBank中发表的IBDV基因组序列,利用MEGA软件进行比对,在SA片段保守区设计两对引物,序列如下:P1,5′-GAGATCAGACAAACGATCGCAGC-3′,P2,5′-TCTGTCAGTTCACTCAGGCTTCC-3′。预期片段大小437bp。引物由宝生物工程有限公司合成。
1.3.2 RT-PCR。根据QIAamp Viral RNA Mini Kit操作说明提取病料中病毒的RNA。RT-PCR反应根据HiScript II One Step RT-PCR Kit说明书进行操作。在PCR反应管中依次加入ddH2O 6.25μL,2×Buffer 12.5μL,引物P1、P2(10pmol/L)各1.0μL,Enzyme Mix 1.25μL,最后加入模板RNA 3.0μL。RT-PCR反应条件如下:50℃ 30min,94℃ 2min,然后进行35个循环(94℃ 30s,55℃30s,72℃30s),最后72℃延伸5min。PCR产物经1.5%的琼脂糖凝胶电泳分析。
1.4 病毒分离
样品研磨冻融后,经0.22μm孔径的滤器过滤除菌后,经绒毛尿囊膜接种9~11日龄SPF鸡胚,每个鸡胚接种0.2mL样品。具体接种方法如下:分别在鸡胚无血管处和气室顶端打一小孔,用吸球在气室顶端孔处抽吸以制造人工气室,然后用注射器于鸡胚无血管处接毒,之后将所打孔用蜡封闭,继续孵化。每日照蛋,接种48h内死亡的鸡胚弃去不用。收集接种48h后死亡鸡胚,检查鸡胚病变。对培养物进行IBDV的RT-PCR检测。
1.5 传染性法氏囊病毒全基因组扩增
1.5.1 引物设计。根据GenBank中发表的IBDV基因组序列,利用MEGA软件进行比对,分别在A、B片段保守区设计中间引物,对A、B片段进行分段扩增。引物由宝生物工程有限公司合成(表1)。
1.5.2 RT-PCR。RT-PCR反应根据HiScript II One Step RT-PCR Kit说明书进行操作。反应体系同1.3.2。RT-PCR反应条件如下:50℃ 30min,94℃2min,然后进行35个循环(94℃ 30s,55℃30s,72℃120s),最后72℃延伸5min。PCR产物经1.0%琼脂糖凝胶电泳后,利用DNA胶回收试剂盒纯化回收,然后与TOPO载体连接,阳性重组质粒送生工生物测序鉴定。

表1 扩增IBDV全基因组引物
1.6 序列分析
将测得的序列进行拼接,获得完整的基因组序列(A和B片段)。利用ClustalW软件分别与GenBank中发表的IBDV基因组序列进行对比,再用MEGA5.2软件对序列进行谱系分析。谱系分析的参数设置如下:采用Neighbor-joining计算方法,核苷酸变异设为Kimura 2-parameter模式,各位点变异速率设为Gamma分布(Gamma参数为2.0)。Bootstrap值的计算设置为1000个重复。
1.7 VP2基因分析
用DNAStar软件对本研究中分离毒株的VP2序列和GenBank中发表的所有IBDV的VP2序列进行分析,并利用MEGA软件构建系统进化树,进行谱系分析。
1.8 病毒毒力鉴定
选取LY和WF分离株,以105 EID50 IBDV对3周龄的SPF鸡进行滴眼攻毒,0.1 mL/只,每组5只,观察临床症状和病变。
2 结果
2.1 RT-PCR结果
对从山东临沂、潍坊等地区发生疑似传染性法氏囊病的鸡场采集的发病鸡法氏囊组织进行RTPCR检测,扩增出与预期片段大小一致的条带(图1),说明这些发病鸡感染了传染性法氏囊病毒。
2.2 病毒分离

图1 疑似传染性法氏囊病组织RT-PCR检测
样品经绒毛尿囊膜接种SPF鸡胚后引起部分鸡胚死亡。病变主要表现为萎缩、皮下水肿、充血,皮下或颅内出血,肝脏肿大、不均匀的充血、呈致斑驳病变。晚死的鸡胚表现肝肿大、变绿、有坏死灶;脾肿大,肾水肿、充血,呈斑纹状。分离毒株分别命名为LY、WF、QD、BZ、LC、TA、DZ、HZ、JN。
2.3 全基因组扩增与序列分析
通过分段扩增的方法,获得了传染性法氏囊病毒9个分离株的全基因组。根据靴攀值(bootstrap)和核苷酸差异(bootstrap ≥ 60和核苷酸差异 > 2%划分为一个分支;核苷酸差异 < 2%为一个亚分支)进行谱系分析。结果表明,A基因片段可以划分为A1、A2、A3三个大的谱系,A1又可进一步细分为A1.1和A1.2两个小分支,近年来分离的强毒株主要分布在A1.1分支,本研究中分离的LY、QD、BZ、LC、TA、DZ、HZ、JN也属于此分支;A3可进一步细分为A3.1、A3.2和A3.3三个小分支,其中A3.3包含了B87和Gt疫苗株,本研究中分离的WF也属于此分支。B基因片段可以划分为B1、B2、B3三个大的谱系,B1又可进一步细分为B1.1和B1.2两个小分支,近年来分离的强毒株主要属于B1.1分支,本研究中分离的LY、QD、BZ、LC、TA、DZ、HZ、JN也属于此分支。B2分支包含了B87和Gt疫苗株,本研究中分离的WF也属于此分支(图2)。
2.4 VP2序列分析

图2 IBDV全基因组谱系分析
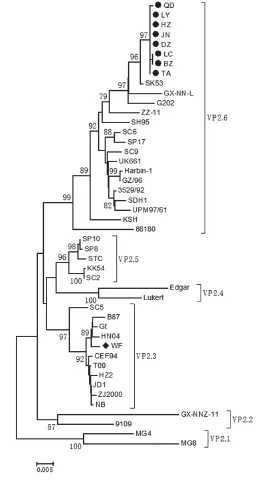
图3 IBDV VP2基因谱系分析
LY、QD、BZ、LC、TA、DZ、HZ、JN分离株VP2蛋白的七肽基序为S-WS-A-S-G-S,而WF分离株的VP2七肽基序为S-W-S-A-R-G-S,与弱毒Gt疫苗株相同。LY、QD、BZ、LC、TA、DZ、HZ、JN分离株在第222、253、256、279、284、294和299位上的氨基酸残基分别为A、Q、I、D、A、I和S,这些氨基酸残基是IBDV具有致病性的特征氨基酸残基,而WF分离株在这些位点的氨基酸残基分别为P、H、V、N、T、L和N,与弱毒Gt疫苗株相同。根据致病性IBDV的VP2基因分子标志判断,LY、QD、BZ、LC、TA、DZ、HZ、JN分离株具备IBDV强毒株的分子特征,而WF分离株具备IBDV弱毒株的分子特征。
谱系分析表明,VP2可以划分为6个分支,本研究中分离的LY、QD、BZ、LC、TA、DZ、HZ、JN与大部分强毒分离株属于VP2.6分支,WF分离株与B87和Gt疫苗株同属于VP2.3分支(图3)。本研究中分离的LY、QD、BZ、LC、TA、DZ、HZ、JN与 国 内分离的强毒株之间VP2氨基酸序列的同源性为93.3%~99.8%,与现行商品疫苗毒株B87和Gt的VP2氨基酸序列同源性分别为94.1%~96.2%和94.5%~96.9%;WF分离株与国内分离株之间VP2氨基酸同源性为95.6%~99.2%,与疫苗株B87和Gt株VP2氨基酸同源性分别为99.2%和99.6%。
2.5 分离株的毒力
将分离毒对SPF鸡进行攻毒试验,LY组在攻毒后第2d出现明显食欲减退和精神萎靡症状,在第3d死亡2只;尸体剖检见法氏囊组织水肿和出血,腺胃与肌胃交界处出血,腿肌、胸肌有条索状出血。用1.3中RT-PCR方法进行检测,结果为阳性。根据OIE《陆生动物诊断试验和疫苗手册》的定义,LY株为强毒力IBDV。WF组在攻毒后几乎不引起临床症状、没有鸡的死亡,法氏囊出现了轻微的水
肿病变,为低毒力IBDV。
3 讨论
随着IBDV变异毒株(包括超强毒株)的不断出现,不但引起患病鸡死亡,还导致机体免疫抑制,使机体的免疫防御能力降低和疫苗免疫接种失败,从而继发和并发其他疾病,致使养鸡业经济损失加剧。
我们从山东省疑似IBD发病鸡中分离到9株IBDV,并进行了基因组测序和分析,谱系分析表明大部分分离株与国内近年来分离的毒株属于同一个谱系,说明它们之间的亲缘关系很近。
VP2蛋白与病毒的致病性、免疫保护抗原表位有关,因此研究VP2蛋白变异状况对提高IBD疫苗的免疫防控效果具有重要意义。VP2蛋白分为保守区和高变区两部分,不同毒株之间的基因变异大多数发生在高变区。VP2蛋白高变区有1个重要结构:七肽基序S-W-S-A-S-G-S(第326~332位氨基酸残基)[2,6]。VP2蛋白高变区的七肽基序和特征性氨基酸被认为是强毒株或超强毒株在衍化过程中的分子标记[6,7]。研究发现,七肽基序在强毒株中是唯一保守的,这个富集丝氨酸基序所形成的氢键参与对毒力至关重要的分子内或分子间相互作用[2]。
研究表明,IBDV强毒株和超强毒株在VP2蛋白的A222、Q253、I256、D279、A284、I294和 S299是高度保守的[8-11]。其中,Q253、D279和A284除与细胞的毒力有关外,还与细胞嗜性有关[8,9]。虽然IBDV的毒力、细胞嗜性和致病型等分子特征仍然需要深入研究,但从迄今已报道的结果可以看出,VP2蛋白七肽基序以及一些特征氨基酸残基是致病性IBDV的重要分子标记。
本研究对近期山东省分离的IBDV VP2蛋白进行了序列分析,除WF株外,其他分离株的七肽基序均为S-W-S-A-S-G-S,在222、253、256、279、284、294和299位上的氨基酸残基分别是A、Q、I、D、A、I和S。根据有关致病性IBDV的VP2蛋白分子标志判断,LY、QD、BZ、LC、TA、DZ、HZ、JN具备IBDV强毒株的分子特征。选取LY株对3周龄雏鸡进行攻毒试验,可使其产生典型的IBD病变和死亡。结合临床症状、病理变化、RT-PCR检测结果,判定LY为IBDV强毒株。同源性分析发现,山东省分离株与国内分离株VP2氨基酸同源性为93.3%~99.8%,与现行商品疫苗毒株B87和Gt的VP2氨基酸序列同源性分别为94.1%~96.2%和94.5%~96.9%。
本研究中分离的WF株七肽基序和222、253、256、279、284、294和299位上的氨基酸残基,与弱毒Gt疫苗株相同,SPF鸡攻毒试验也表明WF为弱毒株。临床调查发现,分离WF病毒的鸡群未使用Gt疫苗进行免疫。从基因组序列来看,WF株的A片段与Gt疫苗株的核苷酸同源性为99.6%,有11个碱基不同,其中有1处缺失;WF株的B片段与Gt疫苗株的核苷酸同源性为99.9%,有3个碱基不同;其中VP2与Gt疫苗株的核苷酸同源性为99.6%,有6个碱基不同,其中有1处连续3个碱基不同。因此,判断WF为自然弱毒株,而非Gt疫苗株。
[1] Yamaguchi T,Iwata K,Kobayashi M,et al. Epitope mapping of capsid proteins VP2 and VP3 of infectious bursal disease virus[J]. Arch Virol,1996,141(8):1493-1507.
[2] Heine H G,Haritou M,Failla P,et al. Sequence analysis and expression of the host-protective immunogen VP2 of a variant strain of infectious bursal disease virus which can circumvent vaccination with standard type I strains[J]. J Gen Virol,1991,72(8):1835-1843.
[3] Cui X,Nagesha H S,Holmes I H. Mapping of conformational epitopes on capsid protein VP2 of infectious bursal disease virus by fd-tet phage display[J]. J Virol Methods,2003,114(1):109-112.
[4] Domanska K,Mato T,Rivallan G,et al. Antigenic and genetic diversity of early European isolates of infectious bursal disease virus prior to the emergence of the very virulent viruses:early European epidemiology of infectious bursal disease virus revisited[J]. Arch Virol,2004,149(3):465-480.
[5] Muller H,Islam M R,Raue R. Research on infectious bursal disease the past,the present and the future[J]. Vet Microbiol,2003,97(1/2):153-165.[6] Yamaguchi T,Kasanga C J,Terasaki K,et al. Nucleotide sequence analysis of VP2 hypervariable domain of infectious bursal disease virus detected in Japan from 1993 to 2004[J]. J Vet Med Sci,2007,69(7):733-738.
[7] Vakhariaa V N,Heb J,Ahamedb B,et al. Molecular basis of antigenic variation in infectious bursal disease virus[J]. Virus Res,1994,31(2):265-273.
[8] Lim B L,Cao Y,Yu T,et al. Adaptation of very virulent infectious bursal disease virus to chicken embryonic fibroblasts by site-directed mutagenesis of residues 279 and 284 of viral coat protein VP2[J]. J Virol,1999,73(4):2854-2862.
[9] Brandt M,Yao K,Liu M,et al. Molecular determinants of virulence,cell tropism,and pathogenic phenotype of infectious bursal disease virus[J]. J Virol,2001,75(24):11974-11982.
[10] Wang Y S,Wang Z C,Tang Y D,et al. Comparison of four infectious bursal disease viruses isolated from different bird species[J]. Arch Virol,2007,152(10):1787-1797.
[11] Martin A M,Fallacara F,Barbieri I,et al. Genetic and antigenic characterization of infectious bursal disease viruses isolated in Italy during the period 2002-2005[J]. Avian Dis,2007,51(4):863-872.
Epidemic Situation and Virus Characteristics of Infectious Bursal Disease in Shandong province
Jiang Wenming,Zhuang Qingye,Wang Suchun,Li Jinping,Hou Guangyu,Chen Jiming
(China Animal Health and Epidemiology Center,Qingdao,Shandong 266032)
Tissue samples with suspected infectious bursal disease(IBD)from Shandong province were detected by RT-PCR method,and viruses were isolated from the positive samples. The whole genomes of isolates were amplified with designed primers. Phylogenetic analysis showed that these isolates except WF strain belonged to the same lineage with most virulent strains in the country. Sequence analysis showed that VP2 seven-peptide motif of LY,QD,BZ,LC,TA,DZ,and HZ isolates were S-W-S-A-S-G-S,and amino acid residues at positions 253,253,256,256,284,294 and 299 were A,Q,I,D,A,I and S respectively,with molecular characteristics of virulent IBDV. Challenge test showed that LY strain induced obvious IBD lesions,mortality was 40%(2/5),referred as virulent IBDV,which was consistent with the sequence analysis. WF strain and vaccine strains B87 and Gt belonged to the same lineage,their VP2 molecular features were same as the Gt attenuated strain,and challenge experiments showed WF strain as attenuated IBDV. Sequences analysis indicated that the homology of amino acid sequences of VP2 of LY,QD,BZ,LC,TA,DZ,and HZ isolates and other virulent strains in the country was 93.3% ~ 99.8%,while with the vaccine strains B87 and Gt were 94.1 ~ 96.2% and 94.5 ~ 96.9% respectively. The homology of amino acid sequences of VP2 of between WF isolate and other isolates was 95.6% ~ 99.2%,and with the vaccine strains B87 and Gt were 99.2% and 99.6% respectively. In this paper,molecular epidemiology of chicken infectious bursal virus was analyzed in Shandong province,and genomics and pathogenicity of the virus were studied preliminarily. It is of great significance to understand the epidemic situation and analysis of the virus variation.
infectious bursal disease;RT-PCR;genome;VP2 protein
S852.65
A
1005-944X(2015)03-0011-06

