例析原电池原理的考查方式
谢改雯
一、考查所给装置是否原电池
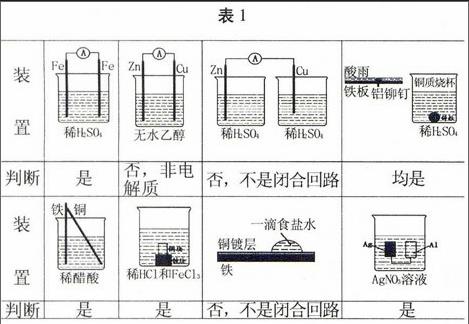
解决这类题型必须清楚构成原电池的条件:(1)有两种活动性不同的金属作电极(或一种惰性电极,如石墨电极、铂电极。),例如:Zn-Cu,Cu-Ag,Zn-石墨,Cu-Pt均可以是组成原电池的两个电极的材料;(2)电极材料均插入电解质溶液中;(3)两极相连与电解质溶液共同构成闭合回路。要构成一个原电池,必须满足这样的三个条件,缺一不可,缺少其中的任意一个条件均不能构成原电池,如对表1中各种装置的判断。
表1
归纳总结在判断一个装置是否原电池时,应该注意这样三点:(1)不要计较电极的形状和大小;(2)不要计较闭合电路的形成方式,可以有导线,也可以不用导线,只要让两个电极互相连通就行;(3)也不必考虑电解质的成分,可以是一种溶质,也可以是多种溶质的电解质溶液;可以是强电解质溶液,也可以是弱电解质溶液。
二、考查电极反应式的书写
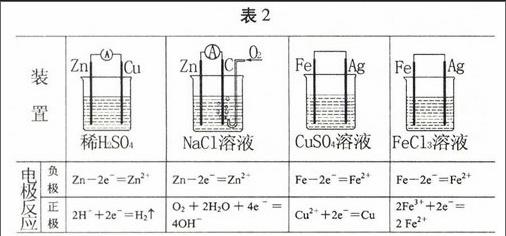
表2
表2列出了几种装置电极反应式的书写,一般说来,简单的原电池负极的电极反应一般是负极金属本身失电子变成金属阳离子:
R-ne-Rn+,比较容易写出;正极上的反应相对复杂一些,需要判断出溶液中的哪种微粒在正极板上得电子,这取决于溶液中各种微粒得电子能力的相对大小,这是正确写出正极上电极反应式的关键。常见的有这样三种情况,(1)酸性溶液中,H+得电子,发生析出氢气的反应,可以看作金属的析氢腐蚀;(2)在弱酸性、中性溶液中,通常溶液中的O2得电子,可以看作是负极发生吸氧反应;(3)当溶液中有金属活动顺序表中H后面的金属阳离子时,通常该金属阳离子得电子,如Cu2+、Fe3+、Ag+等。
这是一些简单原电池的电极反应式的书写。但是对于一些实用电池的电极反应式的书写,则要认真思考。
例1铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,电池的总反应为PbO2+Pb+2H2SO42PbSO4+2H2O,其中PbSO4不溶于水也不溶于稀硫酸。根据上述情况判断:(1)蓄电池的负极是,其电极反应式为。
(2)蓄电池的正极是,其电极反应式为。
(3)蓄电池工作时,其中电解质溶液的pH(填“增大”、“减小”或“不变”)。
解析从电池的总反应,可以看出Pb的化合价升高、失去了电子,因而作负极。这时,有些学生可能会将电极反应式写作Pb-2e-Pb2+。这里需要特别提醒注意的是:因为PbSO4不溶于水,不溶于稀硫酸,所以生成的Pb2+并不能存在于电解质溶液中,必须与溶液中的SO2-4继续发生反应生成PbSO4(Pb2++SO2-4PbSO4),所以,负极周围发生的电极反应为:Pb-2e-+SO2-4PbSO4。
同理,从总反应上看,得电子的物质是PbO2,所以正极是PbO2,首先发生的变化应该是PbO2+2e-Pb2++2O2-,在水溶液中,O2-是不会存在的,它有两个去向:在酸性溶液中与氢离子结合生成水,即2O2-+4H+2H2O;在中性或碱性条件下与水结合生成OH-,即2O2-+2H2O4OH-。这里显然是前一种情况,也就是说,在正极PbO2及其周围发生了两个连续的变化:PbO2+2e-Pb2++2O2-和2O2-+4H+2H2O,两个连续发生的反应的反应式相加的结果就是正极上的电极反应式:PbO2+2e-+4H++SO2-4PbSO4+2H2O。
由于铅蓄电池在工作过程中硫酸被消耗,浓度降低,所以电解质溶液的pH会增大。
归纳总结书写实用电池的电极反应式时,要注意三个问题:(1)两极得失电子数要相等;(2)电极反应不单纯是电极自身的反应,而是这个电极及其周围的区域发生的反应,也就是说一定要考虑电解质溶液对电极反应的影响;(3)当已知电池的总反应时,如果能够判断出某一极的电极反应,则可以利用两极反应之和等于电池的总反应这一重要关系,推断并写出另一电极上的反应式。
三、考查推断反应现象
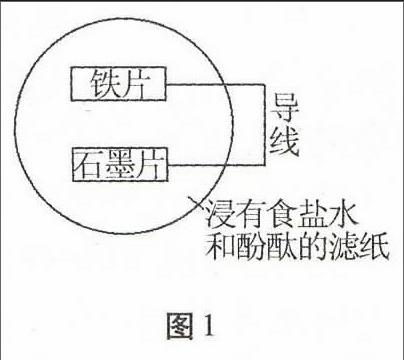
图1例2如图1所示,将一个铁片和石墨片用导线连接后,放在一张滤纸上并压紧,使三者充分接触, 并不断向滤纸上滴加饱和食盐水和酚酞的混合液,一段时间后。
(1)先变红的区域在 附近,该电极是 极。
(2)写出两极上的电极反应式 。
解析从原电池的构成条件不难发现,铁片、石墨、导线、食盐水构成了一个原电池装置,其中铁片为负极,石墨为正极。负极上的电极反应为:2Fe-4e-2Fe2-,正极上的电极反应为:O2+2H2O+4e-4OH-,于是先变红的区域为石墨片附近,该电极为正极。
归纳总结解决这类问题时注意:若要分析原电池在工作过程中出现的现象,必须先分析原电池的两极、以及电解质溶液中所发生的反应,由反应结果去推断反应的现象。
四、考查条件对化学反应速率的影响
例3为了探究金属腐蚀的条件和快慢,某课外学习小组用不同金属丝将三根大小相同的普通铁钉分别固定在图2所示的三个装置内,并将这些装置在相同的环境中放置一段时间,铁钉腐蚀最严重的是 (填a、b或c),铁钉几乎未被腐蚀的是 (填a、b或c)。
图2
解析电化学腐蚀是造成钢铁腐蚀的主要原因。电化学腐蚀的机理是构成原电池。乍一看,三个装置中,铁钉都没有与液体接触,都没有形成原电池。实际上,只有铁钉c由于浓硫酸的强吸水性而处于干燥的环境,所以没有形成原电池而几乎不会被腐蚀。铁钉a、b处于酸性潮湿的环境中,表面上会形成一层酸性液膜,这层液膜与铁和碳能形成无数微小原电池而被腐蚀。同时,铁钉b还与铜丝形成另一个宏观上的原电池,腐蚀就更快,所以,腐蚀最严重的是铁钉b,几乎未被腐蚀的是铁钉c。
五、考查按要求设计原电池
例4某原电池的总反应方程式是:
Zn+Cu2+Zn2++Cu
该原电池组成是( )。
电解质溶液正极负极
ACuCl2溶液ZnMg
BCuCl2溶液CuZn
CZnCl2溶液ZnCu
DZnCl2溶液CuZn
解析从给出的总反应可以看出:Zn化合价升高,失去电子,所以Zn一定作负极,然后只要找比Zn活动差的金属电极或惰性电极作正极都可以。得电子的是Cu2+,则电解质溶液中必须含有Cu2+,硫酸铜、氯化铜、硝酸铜溶液都可以。所以这题的答案应该是BD。
归纳总结在解决这类习题时,必须要抓住电池的总反应中化合价的变化作为出发点来进行分析和设计。
(收稿日期:2015-06-10)

