美国食品药品监督管理局关键路径计划及其对我国医疗器械市场准入制度的启示
邵玉波 李 非
美国食品药品监督管理局关键路径计划及其对我国医疗器械市场准入制度的启示
邵玉波①李 非②
目的:通过阅读大量文献对美国食品药品监督管理局(FDA)关键路径计划进行研究,分析关键路径计划对我国医疗器械市场准入制度的贡献与不足。方法:采用文献综述的方法对美国FDA关键路径计划进行分析研究。结果:我国应借鉴关键路径计划,改革现有医疗器械市场准入制度,提高效率,简化程序,促进产品的安全与发展。结论:研究借鉴美国FDA关键路径计划,对于构建我国医疗器械市场准入路径具有重要的指导意义。
食品药品监督管理局;关键路径计划;医疗器械;市场准入路径
DOI∶ 10.3969/J.ISSN.1672-8270.2015.11.037
[First-author’s address] National Institutes for Food and Drug Control, Beijing 100050, China.
保护公众健康是美国食品药品监督管理局(food drug fdministration,FDA)的使命,他主要通过以下三种途径来实现该使命。第一,保证医疗产品的安全、有效;第二,促进医疗产品创新,让更安全、更有效的产品以病人偿付得起价格提供给公众;第三,帮助公众获得其所需的准确、科学的信息。为了实现该使命,美国FDA提出了“关键路径计划”,以解决产品从基础研究走向市场周期过长的危机,从而改善产品创新过程。
美国FDA于2004年首次发布了关于关键路径的白皮书《创新/停滞:新医疗产品关键路径上的挑战与机遇》(Innovation/Stagnation:Challenge and Opportunity on the Critical Path to New Medical Products)[1]。该报告研究危机产生的原因及未来发展趋势;分析以往对关键路径有益的尝试和发展,计划未来的努力方向;号召通过行业、学术科研机构与FDA共同合作,识别关键问题和开发解决方案。
我国医疗器械市场准入路径正处于关键的改革过程中,研究借鉴美国FDA关键路径计划对于构建我国医疗器械市场准入路径,实现我国医疗器械兼顾安全和发展的长期目标具有十分重要的指导意义。本文通过阅读大量文献对美国FDA关键路径计划进行了研究,分析了关键路径计划对我国医疗器械市场准入制度的贡献与不足。
1 美国FDA的关键路径计划
1.1 关键路径计划提出的背景
医疗器械产品的安全直接影响着公众的生命安危。如何更好的对医疗器械产品进行监管,保证其安全性和有效性,已成为世界各国共同努力的目标。医疗器械的市场准入是产品上市前的必经之路,也是监管的重要环节。医疗器械市场准入路径本身包含了“流水线”式的过程,如产品检验、临床试验、质量管理体系检查、注册评价等。美国FDA在2004年的研究中发现,创新产品的上市速度越来越慢,产品的研发与实际应用之间的距离不断扩大。2004年的前10年间,行业在医疗产品研发的基础投入增长了2.5倍,美国政府的在医疗产品研究的基础投入增长了2.3倍;而医疗产品的申请反而减少了10%到90%不等,这表明医疗产品的开发已经跟不上基础科学领域的创新[2]。美国FDA认为要集中努力为从基础科学创新到医疗产品开发之间的过程提供充分的支持,这就迫切地需要在构建现代化关键路径上取得突破。
1.2 关键路径的内涵
关键路径指的是新药、新生物制品及新医疗器械的研发过程中的关键性环节[3]。企业经过基础研究后,通过设计研发新品,新研发的产品需要经过临床前和临床试验以及申报、审批过程,才能上市。在新产品的研发过程中,只有很少的一部分能顺利通过关键路径最终成活上市(如图1所示)。
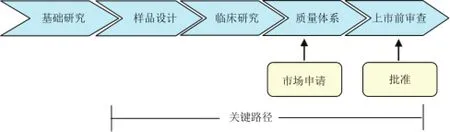
图1 医疗产品市场准入的关键路径
1.3 关键路径计划的主要内容
生物医学的基础研究成果理应能迅速转变为提高公共健康的医疗器械产品,但是新产品的低产率却未能使这些研究成果充分用于改善人类健康。一方面是因为新品的研发成本不断上升,严重妨碍企业对高风险新项目的研发投入;另一方面,新品研发的高失败率严重影响资源的有效配置,陈旧的评价工具如检测、动物试验及人体试验也经常不能准确的预见一些潜在的安全问题,因而无法有效评估新的医学技术。关键路径计划研究的内容主要是优先处理当前最迫切的医疗器械产品的研发路径问题,使生物医学基础研究的成果能迅速转变为提高公共健康的新产品。这些最优先研究的问题将列入关键路径机遇清单,并从安全评价、临床效果评价和产品实现三个维度进行研究。美国FDA认为清单中很重要的一项就是迫切需要构建一套新的产品研发支持工具集,以提高关键路径上产品研发的可预测性和有效性,确保新的生物医学基础研究成果能更快更准确的转变为有效的治疗手段。
1.4 关键路径计划的进展
自美国FDA在2004年正式启动了关键路径计划,其后的近10年间美国FDA坚持推动和实施关键路径计划,并且每年都发布计划实施的活动和结果评估[3]。在2006年发布了《关键路径机遇报告》;2007年发布了《开展中的主要关键路径活动》;2008年发布了《财政支持的关键路径活动》;2009年发布了《主要成果报告》;2010年发布了《受关键路径计划支持的项目报告》[4-5]。通过以上努力,美国FDA在促进产品创新上取得了显著的成绩。
在美国FDA构建和实施的产品研发支持工具集中,指导原则文件是美国FDA一直坚持并取得突出效果的市场准入工具。美国FDA发布指导原则的目的是解释当前政府的政策和监管问题,代表了美国FDA对政策和问题的现行理解。指导原则内容包括设计、生产、销售,测试;申报的处理、内容和评价;检查和执法;科学问题。其中美国FDA医疗器械和放射产品中心至今已发布了很多指导原则,有效地提高了医疗器械产品研发关键路径的可预测性和效率。
2 关键路径计划对我国医疗器械市场准入制度的启示
2.1 我国研究现状
虽然美国FDA在2004年就发起了革新性的关键路径计划,并逐步取得了成效,但是在我国仅仅引起监管当局和行业很少关注,在国家级医药期刊上公开发表的文献只有2篇。李中华在2007年系统介绍了美国FDA关键路径计划的背景、科技要素和主要内容[6];常永亨在2009年介绍了美国FDA关键路径计划,并提出结合我国国情,研究发达国家经验,设计我国的医疗器械市场准入路径[7]。我国正处于关键的改革过程中,研究借鉴美国FDA关键路径计划对于我国医疗器械监管有着积极意义。
2.2 对我国医疗器械市场准入制度的启示
美国FDA关键路径计划的核心价值主要体现在两个方面:科学审评前移和优化准入路径。科学审评前移是将市场准入过程中政府的服务职能前置或前移,有助于产品从研发阶段就与法规、准入要求对接,从而设计出符合市场准入要求的产品,提高产品质量、缩短准入周期;优化准入路径是减少市场准入过程中的风险和不确定性,有助于新产品、新企业的发展。
2.3 对于关键路径计划的借鉴
美国FDA实施关键路径计划是围绕其监管使命,即保证医药产品安全有效,又促进创新进步,使公众能够获得更有效、更便宜的产品。这与我国现阶段医疗器械监管的使命是一致的。因此,应借鉴关键路径计划,改革我国监管方式,提高效率,简化程序,促进医疗器械产品的安全与发展。
2.4 对于现有医疗器械市场准入制度的改革
为保证上市医疗器械产品的安全,各国都设立了市场准入制度。我国与美国FDA相比,医疗器械市场准入制度面临不同的现状:
(1)市场准入效率尚需完善。美国FDA从1976年发布联邦食品、药品和化妆品法有关医疗器械的修订案,逐步形成成熟的医疗器械市场准入制度体系,主要包括分类、一般控制、510(k)程序、PMA审批、GMP、临床试验审批监查等。而我国2000年才将医疗器械正式纳入监管体系,2004年发布第一个医疗器械注册管理办法,并于2014年进行了第一次修订,文件中虽然明确了注册的程序和职责,但在与风险相适应的审评模式改革方面尚需完善,例如美国FDA推行的实质性等同原则和简化510(k)等手段,对提高产品注册效率更有积极的意义。
(2)注册审评资源不足已成为制约行业发展的因素。医疗、教育、住房是我国三大民生话题,医疗器械行业是构筑医疗体系的重要支撑点。医疗器械行业的快速发展给政府监管提出了新的挑战。我国用于医疗器械研究和开发的公共和私人投资不断增加,但是更加有效、更加支付得起的医疗器械产品推广应用速度却越来越慢。究其原因,主要是当前的医疗器械注册审评资源严重不足,制约了行业发展。美国FDA从事医疗器械上市审查的人员有300余人,而欧盟进行医疗器械审查的公告机构达到74个。而中国目前在国家局层面从事医疗器械注册技术审评的人员仅有70余人;各省级药品监管部门从事医疗器械注册技术审评的人员仅为140余人[8]。
(3)市场准入制度未能对行业良性发展提供有效的导向。成熟的市场准入制度不仅是产品上市前控制,更应该对行业的良性发展提供导向,包括鼓励产品不断创新;提高有效性的同时降低风险;促进企业完善自身质量管理;推动行业整合优化等。例如,风险管理活动不仅仅是对医疗器械制造商自我控制的要求,更是我国监管的强制性要求。作为责任主体,生产企业应该在医疗器械产品生命周期的所有阶段执行风险管理[9-12]。然而我国很多企业的风险管理活动仅在产品市场准入阶段准备的一份风险管理报告,市场准入未起到推动企业贯彻风险管理理念的作用。美国FDA具有成熟的市场准入制度体系,其关键路径计划重在发展新的、更可靠的安全性评价工具及相应标准[13]。我国市场准入制度建立尚处起步阶段,行业发展需要更加科学、成熟的市场准入制度,应把改革重点放在构建现代化的医疗器械市场准入制度上[14]。
2.5 构建现代化的医疗器械市场准入关键路径
目前,我国对医疗器械市场准入缺乏系统研究,以往文献主要是介绍国外政府监管模式和经验,未能提出我国市场准入路径中存在的问题,以及客观评价准入路径的标准。美国FDA关键路径计划在这方面给了有益的启示:
(1)应用关键路径法。以此确定医疗器械市场准入规制中的关键环节;
(2)分析关键路径上每个环节的问题。以此协调各方解除制约因素;
(3)主动改革医疗器械分类、临床试验、审评等机制。以此使医疗器械市场准入路径更加安全、高效;
(4)发展新的安全性评价指南相应标准。以此指导行业通过关键路径提高效率;
3 结语
借鉴美国FDA关键路径计划,构建我国医疗器械市场准入制度的重点应当是:分析医疗器械市场准入路径中存在的问题,探讨产生这些问题的原因并提出相应的解决方案;用管理学理论及关键路径法客观分析、阐述市场准入路径的关键路径及其规制;用模型方法建立关键路径的模型;用风险分析方法评价模型对医疗器械安全有效的影响;用经济学方法评价模型对医疗器械市场准入效率和成本的影响[15]。从建立模型、关键路径法和模型评价的角度出发,比较研究国外如何通过改革分类模式、临床试验模式、510(k)注册模式等关键路径,以适应医疗器械行业和技术发展,构建适于我国的医疗器械市场准入制度。
[1]FDA.Innovation/Stagnation:Challenge and Opportunity on the Critical Path to New Medical Products.[EB/OL].[2004-03].http://www.fda.gov.
[2]FDA.Innovation/Stagnation: Critical Path Opportunity Report.[EB/OL].[2006-03].http:// www.fda.gov.
[3]FDA.Innovation/Stagnation:Critical Path Opportunity list.[EB/OL].[2006-03].http://www. fda.gov.
[4]FDA.Key FDA Critical Path Activities Under Way in 2007.[EB/OL].[2008-06].http://www. fda.gov.
[5]FDA.The Critical Path Initiative:Report on Key Achievements in 2009.[EB/OL].[2008-06]. http://www.fda.gov.
[6]李中华,郭翔宇.FDA的关键路径计划[J].中国医药技术经济与管理,2007,1(4):84-90.
[7]常永亨,宓现强.FDA的关键路径动议对我国医药监管的启示[J].中国医疗器械信息,2009,15(6):22-26.
[8]王兰明.中国医疗器械注册管理工作的现状与思考[J].中国医疗器械信息,2012,17(11):28-34.
[9]李非,吕大雷,梁文,等.医疗器械生产企业风险管理水平的影响因素研究及对策[J].中国医疗器械信息,2010,16(4):74-77.
[10] 常永亨.欧盟的医疗器械市场准入与第三方认证的区别[J].中国医疗器械杂志,2010,34(1):42-43.
[11]秦韶燕,崔涛,股海松,等.浅谈韩国对医疗器械市场准入的要求[J].医疗卫生装备,2015,36(5):124-126,131.
[12]王兰明,王宿.美国欧盟医疗器械上市许可管理制度及其启示[J].中国药业,2012,21(24):1-5.
[13]王兰明.关于推进医疗器械上市后安全性监测工作的探讨[J].中国医疗器械信息,2009,15(4):48-52.
[14]黄莉婷,董齐,陆朝甫.我国医疗器械临床应用监测与评价现状[J].中国医疗设备,2013,28(11):63-66.
[15]岳伟.加快《医疗器械监督管理条例(修正案)》发布的重大意义[J].中国医疗器械杂志,2013,37(1):40-43.
Research on inspiration to medical device market access system from FDA's critical pathplan
SHAO Yu-bo, LI Fei
China Medical Equipment,2015,12(11)∶117-120.
Objective∶ Through reading a lot of literature on the critical path planning of FDA, analyzed the contribution and shortage of the critical path plan to China's medical device market access system. Methods∶ To analyze the critical path planning of FDA by using the method of literature review. Results∶ China should reference the critical path plan, reform the existing medical instrument market access system, improve the efficiency, simplify the procedure and promote the safety and development of the product. Conclusion∶ The research on the critical path planning of FDA is very important for the construction of China's modern medical device market access path.
Food drug fdministration; Critical path plan; Medical device; Market access path
邵玉波,女,(1977- ),硕士,工程师。中国食品药品检定研究院,从事有源医疗器械检验以及实验室综合业务管理工作。
1672-8270(2015)11-0117-04
R197.39
A
2015-07-27
①中国食品药品检定研究院 北京 100050
②辽宁省药械审评与监测中心 辽宁 沈阳 110003

