球囊霉素相关土壤蛋白提取条件的优化
何开平,杜鹏,吴强盛 (长江大学园艺园林学院,湖北 荆州434025)
球囊霉素 (glomalin)是丛枝菌根真菌 (arbuscular mycorrhizal fungi,AMF)侵染植物根系后由根外菌丝或孢子释放的一类特殊糖蛋白,在陆地生态系统中具有重要的功能[1]。目前,对土壤中球囊霉素的测定主要是通过考马斯亮蓝法和丛枝菌根真菌单克隆抗体MAb32B11进行酶联免疫 (ELISA)反应[2]。研究发现,采用考马斯亮蓝法测定球囊霉素时,高温提取并不能破坏除球囊霉素以外的所有非热稳态土壤蛋白。因此,Rillig[2]建议使用球囊霉素相关土壤蛋白 (glomalin-related soil protein,GRSP)这个术语代替球囊霉素。AMF菌丝释放的GRSP进入土壤后,具有胶结功能,可与沙土、黏土以及有机物质结合,促进团聚体的形成和稳定团聚体的结构,且这种功能要明显高于根系菌根侵染率和土壤菌丝对团聚体稳定的效应[3,4]。GRSP也能延缓土壤中碳的降解[5],能够固持重金属污染的土壤中的重金属[6],调节土壤/植物中的水分状况[7]。
Wu等[4]最近将GRSP分为2种类型,易提取球囊霉素相关土壤蛋白 (EE-GRSP)和难提取球囊霉素相关土壤蛋白 (DE-GRSP),但是这2种物质的提取技术还待商榷,一些提取的过程都不同程度地影响着EE-GRSP和DE-GRSP提取量。柑橘是我国南方重要的果树,在农业生产、农民增收中具有重要作用。许多研究工作已经证实GRSP对柑橘园土壤的团聚体稳定性和土壤肥力产生效应[4,7]。
鉴于此,本研究拟对柑橘园土壤中EE-GRSP和DE-GRSP的提取方法进行优化,为今后进一步研究GRSP在柑橘园土壤中的作用提供技术支撑。
1 材料与方法
1.1 试验材料
2013年4月21日,在长江大学柑橘园26年生枳砧温州蜜柑根围收集土样。随机选择8棵生长健壮的植株,在距离植株根茎大约1m处,于表层5cm深处取土样,每棵树取土约1kg,带回实验室自然风干,过4mm筛备用。
1.2 试验方法
EE-GRSP的提取参考文献 [1]从3个不同因素考虑:土样重量、高温灭菌时间和离心时间。在试验过程中分别选取上一次最优的试验结果作为下一次的提取条件。
土样重量:称取0.25、0.50、0.75、1.00、1.25g的过筛土样,按照常规提取比例(1∶8)分别加入2、4、6、8、10mL 20mmol/L柠檬酸缓冲液 (pH 7.0),121℃灭菌0.5h,10000r/min离心3min,将上清液转入10mL离心管,待测。此过程共5个处理,每个处理重复4次。
高温灭菌时间:取上一次试验结果最佳的土样重量,加入相应体积的20mmol/L柠檬酸缓冲液(pH 7.0),分别于121℃下灭菌0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0h。灭菌后,然后10000r/min离心5min,以空白为对照,以牛血清白蛋白为标准曲线,采用考马斯亮蓝染色法[8]于595nm波长下测定其光密度。此过程共10个处理,每个处理重复4次。
离心时间:在高温灭菌最佳时间的基础上,进行离心时间的处理,分别离心5、10、15、20、25min,取上清液测定其吸光值。共5个处理,每个处理重复4次。
DE-GRSP的提取参考文献 [4]离心时间的设计进行:EE-GRSP离心后的沉淀使用8mL 50mmol/L柠檬酸缓冲液 (pH 8.0)高压灭菌1h,然后分别10000r/min离心5、10、15、20、25min,取上清液,测定其光密度。此过程共5个处理,每个处理重复4次。
1.3 数据处理
运用SAS 8.1软件的ANOVA过程对处理间作差异性的测验,采用Duncan法进行多重比较分析。
2 结果与分析
2.1 土样重量对EE-GRSP提取量的影响
图1所示为不同土样重量对EE-GRSP提取量的影响。结果显示,在0.25~0.75g土壤重量范围内,EE-GRSP的提取量随着土样重量的增加而逐渐升高,且在0.75g时EE-GRSP的提取量最高,达到1.41mg/g。随着土壤重量的继续增加,EE-GRSP的提取量又逐渐下降,而后从1.0~1.25g时EE-GRSP的提取量又显著地升高。因此,当土样重量为0.75mg/g时提取效果最好。因此,土样重量为0.75g为后续试验的一个最佳条件。
2.2 高温灭菌时间对EE-GRSP提取量的影响
图2显示,在土样重量相同的情况下,不同的高温灭菌时间显著地影响了EE-GRSP的提取量,呈现出波浪状起伏变化。高温灭菌提取1h所测得的EE-GRSP值最高,当高温灭菌时间为1.5h时,EE-GRSP的提取量迅速降低,最低时下降了38.2%。而后随着灭菌时间的增加,EE-GRSP的提取量表现出升高、降低以及再升高的趋势。因此,在土样重量为0.75g时,高温灭菌提取1h时所得到的EE-GRSP含量最高。

图1 土样重量对柑橘根际EE-GRSP含量的影响

图2 高温灭菌时间对柑橘根际EE-GRSP含量的影响
2.3 离心时间对 EE-GRSP和 DE-GRSP提取量的影响
图3表明不同的离心时间对土样中EEGRSP的提取量有显著的影响。离心时间从5min到20min范围内,EE-GRSP的提取量随着离心时间的增加而增加,在离心时间为20min时,EE-GRSP提取量达到最高。当离心时间继续增加时,EE-GRSP的提取量显著降低。从图3还可以看出,相比较于离心时间为20min而言,EE-GRSP的提取量降低了79.8%。
图4显示不同离心时间对DE-GRSP提取量的影响。当离心时间为5min时,DE-GRSP提取量最低;离心10min时DE-GRSP的提取量最高,为0.58mg/g,但随着离心时间的继续增加,DE-GRSP的含量显著降低,且在15~25min范围内DE-GRSP的提取量无显著地变化。
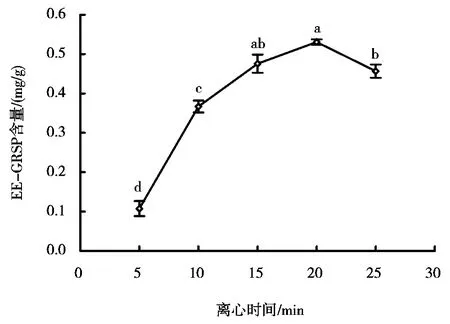
图3 离心时间对柑橘根际EE-GRSP含量的影响

图4 离心时间对柑橘根际DE-GRSP含量的影响
3 讨论与小结
前人对GRSP的提取都是按照 Wright等[1]描述的方法进行,即土样重量 (g)与缓冲液的体积(mL)的比例为1∶8。他们认为,即使土样重量不同,加入的缓冲液体积不同,只要提取比例一样,所提取出的GRSP含量是没有差异的。然而,本研究分别称取了不同重量的土样,然后按照相同的提取比例加入相应的缓冲液,结果显示在同一提取比例下,不同的土样重量所提取的EE-GRSP含量有显著地差异。当土样重量为0.75g时所提取出来的EE-GRSP含量达到最高,说明在固定的1∶8提取比例下,当柠檬酸缓冲液为6mL、土样质量为0.75g时,高温提取能使土壤中的EE-GRSP释放量达到最大。
本研究显示,在EE-GRSP的提取过程中,不同的灭菌时间对EE-GRSP的提取有一定的影响,在高温灭菌1h所提取出来的EE-GRSP含量最高,暗示土壤灭菌过程中高温的时间延长可能使土壤有机质结合的GRSP释放更彻底。但是随着高温时间的延长 (超过1h),反而导致EE-GRSP含量的下降,进一步暗示了EE-GRSP可能不能忍受长时间的高温处理,导致大量降解。
本研究结果也表明,土壤样品为0.75g与柠檬酸缓冲液为6mL混合,高温灭菌后,分别离心5、10、15、20min和25min,发现在5~20min内,随着离心时间的不断升高,所提取的EE-GRSP含量呈现上升的趋势,在离心时间为20min时达到最大;对于DE-GRSP而言,则在离心时间为10min时达到最大。谢小林等[9]发现离心力大小显著影响了土壤颗粒的分离,离心力越大可分离更多更细的土壤微粒,从而对GRSP定量测定的干扰就越少。因此,建议在提取GRSP时,应加大离心力或者适当增加离心时间,以便从土壤中分离到纯度更高的GRSP成分。
简而言之,对土壤中EE-GRSP的提取中,建议宜称取0.75g土样,加入6mL 20mmol/L柠檬酸缓冲液 (pH 7.0),高温灭菌1h,然后10000r/min离心20min,DE-GRSP采用10000r/min离心10min。采用上述过程,可以较准确地测定土壤中GRSP含量,减少实验过程造成的误差。不同类型的土壤在进行GRSP的提取过程中还需要进一步地校正。
[1] Wright S F,Upadhyaya A.Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi[J].Soil Science,1996,161:575~586.
[2] Rillig M C.Arbuscular mycorrhizae,glomalin,and soil aggregation [J].Canadian Journal of Soil Science,2004,84:355~363.
[3] 彭思利,申鸿,袁俊吉,等.丛枝菌根真菌对中性紫色土土壤团聚体特征的影响 [J].生态学报,2011,31(2):498~505.
[4] Wu Q S,Cao M Q,Zou Y N,et al.Direct and indirect effects of glomalin,mycorrhizal hyphae,and roots on aggregate stability in rhizosphere of trifoliate orange [J].Scientific Reports,2014,4:5823.
[5] Rillig M C,Wright S F,Allen M F,et al.Rise in carbon dioxide changes soil structure [J].Nature,1999,400:628.
[6] Cornejo P,Meier S,Borie G,et al.Glomalin-related soil protein in a Mediterranean ecosystem affected by a copper smelter and its contribution to Cu and Zn sequestration [J].Science of the Total Environment,2008,406:154~160.
[7] Zou Y N,Srivastava A K,Wu Q S,et al.Glomalin-related soil protein and water relations in mycorrhizal citrus(Citrus tangerina)during soil water deficit [J].Archives of Agronomy and Soil Science,2014,60:1103~1114.
[8] Koidea R T,Peoplesa M S.Behavior of Bradford-reactive substances is consistent with predictions for glomalin [J].Applied Soil E-cology,2013,63:8~14.
[9] 谢小林,许朋阳,朱红惠,等.球囊霉素相关土壤蛋白的提取条件 [J].菌物学报,2011,30(1):92~99.

