鼠疫耶尔森菌F1-V 融合蛋白改构体的构建、原核表达及纯化
房婷,尹可欣,任军,张晓鹏,于蕊,宋小红,杨秀旭,于长明
军事医学科学院科学院 生物工程研究所,北京 100071
鼠疫也称黑死病,是由鼠疫耶尔森菌(Yersinia pestis)引起的烈性传染病,主要的寄主和传染源为啮齿类动物[1]。感染鼠疫菌主要有3 种类型,即腺鼠疫、肺鼠疫和败血症鼠疫。其中肺鼠疫病程急、致死率高,肺鼠疫患者咳嗽产生的带菌飞沫可经呼吸道途径发生人-人传播,导致更加严重的人间鼠疫[2-4]。
进入20世纪90年代后,鼠疫疫情逐渐活跃的趋势更加明显,鼠疫被WHO 确定为重新流行的20 种传染病之一。鼠疫治疗目前以抗生素治疗为主,虽早期给予足量抗生素的治疗效果良好,但副作用较大,且已发现耐药鼠疫菌菌株[3,5]。因此,鼠疫的预防成为关键,研究鼠疫疫苗具有重要意义。传统鼠疫疫苗有全菌体灭活疫苗(如美国使用的鼠疫USP 死菌苗)及减毒活疫苗(如中国和其他几个国家正在使用的EV76 减毒活疫苗)等,但上述疫苗存在副作用大、免疫次数多、保护时间短,且无法防护通过气溶胶传播的肺鼠疫等一系列问题[6-7]。而重组亚单位疫苗克服了传统疫苗的许多缺陷,不含感染组分,无致病性,且具有在体内不复制的优点,因此,亚单位疫苗成为当前鼠疫疫苗研究的热点。目前鼠疫亚单位疫苗主要有以下4 种形式:F1 荚膜抗原(F1 抗原)、V抗原、以一定比例混合的F1抗原+V抗原、F1-V融合蛋白,其中后者不仅可以有效防护腺鼠疫,而且可以有效阻止肺鼠疫的发生[8-12]。
上述疫苗最大的问题在于,F1 的天然功能是其在鼠疫菌外膜聚集成寡聚蛋白,形成胶样颗粒层、水溶性的荚膜物质。这种天然属性会造成其易于形成不均一的聚集体。虽然无论是完整形式的F1 聚合体还是F1 解聚后的单体都具有免疫原性,但这会为疫苗生产的质量控制带来问题[13-15]。而且用F1和V构建的融合蛋白重组F1-V(rF1-V)也无法避免目的蛋白的无规则聚集,导致纯化后的rF1-V 相对分子质量从53 061 到1.5×107间均有分布[11]。在本研究中,我们根据F1 的结构特点对其序列进行改构,将N 端1~14位氨基酸移到C 端,再将其与V 蛋白融合,形成稳定、均一的单体形式融合蛋白,鉴定正确后,使之在大肠杆菌中高效表达,然后摸索了纯化方法,并对纯化产物进行了检测。
1 材料与方法
1.1 材料
感受态大肠杆菌Top10、BL21(DE3)购自天根公司;质粒pET-32a(+)购自Novagen 公司,pET42a-VF1 为本室保存;限制性内切酶购自NEB 公司;Pyrobest DNA 聚合酶、ExTaqDNA 聚合酶、T4DNA 连接酶等购自TaKaRa 公司;质粒提取试剂盒、琼脂糖凝胶DNA 回收试剂盒购自Qiagen 公司;PageRuler Prestained Protein Ladder 购 自Thermo 公 司;蛋 白marker 购自北京全式金生物技术有限公司;离子交换填料Source30 Q、疏水填料Phenyl Sepharose High Performance(装于XK 26/20 柱壳)、凝胶过滤预装柱HiLoad 26/60 Superdex 75 prep grade 均购自GE Healthcare 公司;抗小鼠IgG-HRP 为Santa Cruze公司产品;细菌内毒素标准品购自厦门鲎试剂实验厂有限公司;氨苄西林(Amp)为华北制药厂产品;抗V和抗F1单克隆抗体购自Abcam公司。
低温高速离心机购自Beckman Coulter 公司;SDS-PAGE 电泳仪为BIO-RAD 公司产品;Image Quant LAS4000mini 成像系统和纯化仪AKTA EXPLORER均为GE Healthcare公司产品;酶标仪Spectra Max Paradigm 为Molecular Devices公司产品。
1.2 目的基因的PCR扩增及产物纯化
引物设计见表1,由生工生物工程(上海)股份有限公司合成。以pET42a-VF1 为模板,PCR 分别扩增V及F1mut片段。第一轮PCR 用引物F1mutF1和F1mutR1,去掉F1 分子N 端的1~14 位氨基酸对应的碱基序列,并在核酸序列的5'端引入NdeⅠ酶切位点,得到F1mut1;用引物VF和VR,在V基因序列的5'端引入BamHⅠ酶切位点,3'端引入终止密码子和NotⅠ酶切位点,得到V序列。第二轮PCR 用引物F1mutF1、F1mutR2,以F1mut1为模板,在其3'端引入F1 分子N 端1~14 位氨基酸对应的碱基序列,用SA 连接,得到F1mut2序列。第三轮PCR 用引物F1mutF1、F1mutR3,以F1mut2为模板,在其3'端引入F1 分子N 端15~21 位氨基酸对应的碱基序列和BamHⅠ酶切位点,最终得到F1mut片段。PCR 产物经10 g/L 琼脂糖凝胶电泳分析,并用琼脂糖凝胶DNA回收纯化试剂盒纯化。
1.3 表达载体的构建及鉴定
将纯化的PCR 产物首先进行加A 反应,将加A产物与pMD18-T 连接后,转化大肠杆菌TOP10 感受态细胞,37℃培养,用菌落PCR 鉴定重组质粒,阳性克隆送生工生物工程(上海)股份有限公司进行DNA测序分析。
将测序正确的质粒pMD18-T-F1mut和pMD18-T-V 分别用NdeⅠ/BamHⅠ和BamHⅠ/NotⅠ双酶切,片段回收后与pET-32a 载体连接转化,37℃培养,挑取单菌落,菌落PCR 鉴定,将阳性克隆送生工生物工程(上海)股份有限公司进行DNA 测序分析,测序正确的阳性pET-32a-F1mut-V 质粒转化大肠杆菌BL21(DE3)感受态细胞。
1.4 rF1mut-V的诱导表达
从平板上挑取获得的改构体工程菌的单菌落,接种于5 mL 含100 mg/mL Amp 的LB 培养液中,37℃、220 r/min培养12 h,次日以1∶100的比例转接到含Amp 的LB 培养液中,37℃、220 r/min 培养至对数生长中期(D600nm约为0.6),加入终浓度为50μmol/L 的IPTG,25℃诱导5 h,15% SDS-PAGE 鉴定诱导表达情况。
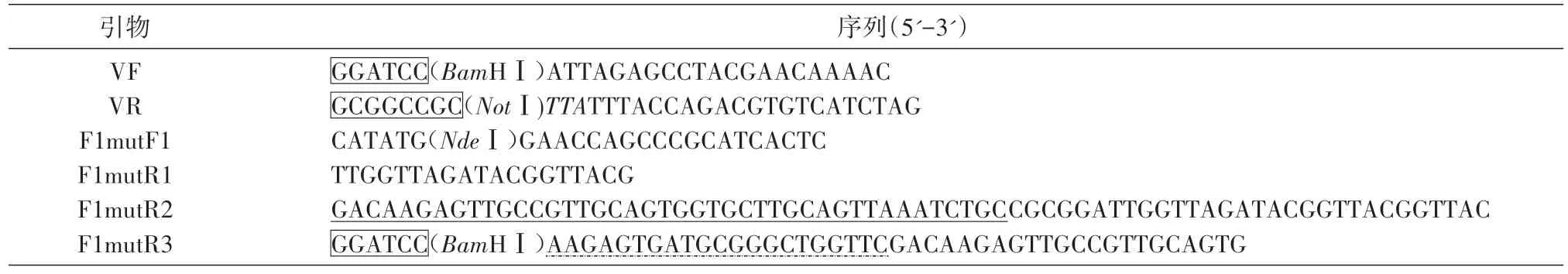
表1 引物及序列
1.5 分级硫酸铵沉淀
发酵料液于4℃、8000 r/min 离心10 min,弃上清,收集菌体沉淀,每克菌体加入10 mL 缓冲液A(50 mmol/L Tris,2 mmol/L EDTA,5%甘油,pH9.0)重悬,冰浴超声波破碎菌体,4℃、12 000 r/min 离心30 min,收集上清,加入终浓度为60%的硫酸铵,冰浴搅拌30 min,10 000 r/min 离心30 min,弃上清,沉淀用缓冲液A洗3次后重悬,用0.45μm的滤膜过滤后待用。
1.6 阴离子交换层析
采用Source 30Q 阴离子交换柱(XK26/20 柱体积CV=20 mL),用平衡缓冲液A 平衡后上样,继续用缓冲液A 淋洗至基线,再采用线性梯度30%B 10CV 洗脱,B 泵为缓冲液B(50 mmol/L Tris,1 mol/L NaCl,pH9.0),根据SDS-PAGE 收集合并目的蛋白组分,进入下一步纯化。
1.7 Phenyl疏水层析
收集液先用NaCl 母液(50 mmol/L Tris,4 mol/L NaCl,pH9.0)调节电导后,4℃、10 000 r/min 离心30 min。采用Phenyl HP 疏水交换柱(XK26/20柱体积CV=20 mL),用平衡缓冲液C(50 mmol/L Tris,2 mol/L NaCl,pH9.0)平衡后上样,继续用缓冲液C 淋洗至基线,再采用线性梯度100%B 10CV 洗脱,B 泵为缓冲液D(50 mmol/L Tris,pH9.0),根据SDSPAGE收集合并目的蛋白组分,进入下一步纯化。
1.8 凝胶过滤层析
采用凝胶过滤预装柱HiLoad 26/60 Superdex 75 prep grade(CV=318 mL),缓冲液为E(20 mmol/L PB,0.15 mol/L NaCl,pH7.2),将目的蛋白进行精纯的同时完成缓冲液的置换,根据SDS-PAGE 收集合并目的蛋白组分。
1.9 rF1mut-V的鉴定
将纯化的rF1mut-V,本室制备的重组F1、V 蛋白,没有改构的重组F1-V 蛋白分别加入5×SDSPAGE 加样缓冲液,100℃变性5 min,离心,行15%SDS-PAGE,电泳结束后转到硝酸纤维素膜上,化学发光法显色,用Image Quant LAS4000mini化学发光成像系统曝光。
非还原型SDS-PAGE 用于检测蛋白纯度,上样量为10μg,将SDS-PAGE 结果经扫描仪扫描后,用Bandscan软件分析纯度。内毒素测定采用凝胶限度试验,方法见2010 年版《中华人民共和国药典》三部附录ⅫE)。结果判定,凝固为内毒素阳性,未凝固为内毒素阴性。检测灵敏度为0.5 EU/mL。
2 结果
2.1 F1mut改构体三级结构模拟
将F1和F1mut 的序列提交到SWISS-MODEL服务器(http://swissmodel.expasy.org/),模拟结果见图1。由图1A、B可以看到F1的三级结构主要是由4个反向平行的β折叠形成类似三明治结构,疏水核心部分暴露在一个狭长的疏水深裂中。其中一个F1蛋白的3个β折叠形成上述缝隙,而另一个F1蛋白N端的β折叠作为“供体”嵌入该缝隙中,最终形成高分子量的线性F1 纤维结构。但该结构在形成过程中需要外膜引导蛋白Caf1A和伴侣蛋白Caf1M 的共同作用,引导F1 蛋白的正确折叠[16-18]。而在外源系统中过度表达F1 抗原时,由于缺失Caf1A和Caf1M,F1会形成不可控的聚集,并容易形成包涵体。
我们将N 端1~14 个氨基酸转移到C 端,以期单独的F1mut 蛋白即可形成上述三明治结构(图1C、D),因此在外源系统表达该蛋白时,不再需要Caf1A和Caf1M即可形成可溶的单体结构。
2.2 目的基因的PCR扩增
10 g/L 琼脂糖凝胶电泳表明扩增产物与F1mut及V基因大小相符,分别约为486和992 bp(图2)。
2.3 克隆载体pMD18-T-F1mut和pMD18-T-V 的菌落PCR鉴定
PCR 获取F1mut及V基因片段后,将其克隆到pMD18-T 载体中,转化大肠杆菌Top10,菌落PCR 鉴定,并对阳性克隆进行测序分析。结果表明阳性克隆的基因片段长度及测序结果与F1mut及V基因一致(图3、4)。
2.4 pET-32a-F1mut-V原核表达载体的构建及鉴定
图1 通过SWISS-MODEL预测的F1和F1mut的三级结构模型
pET-32a 双酶切载体片段依次与pMD18-TF1mut和pMD18-T-V 克隆载体的双酶切回收的基因片段(图5)连接,转化大肠杆菌Top10 感受态细胞,37℃培养后挑取单菌落培养,经菌落PCR 鉴定可看到部分克隆扩增到约1500 bp的目的条带(图6)。
2.5 rF1mut-V改构体的表达与纯化
将发酵液离心重悬后超声波裂解,离心收集上清、沉淀,等体积重悬。上清采用硫酸铵分级沉淀,在60%饱和硫酸铵时离心分离上清、沉淀,沉淀用上样缓冲液清洗后重悬,目的蛋白绝大部分被沉淀下来,纯度提高到60%以上(图7A),随后经Source 30Q、Phenyl HP和Superdex 75 三步层析柱纯化,目的蛋白纯度达95%以上。但目前经硫酸铵分级沉淀后发现仍然存在二聚体形式,经上述三步纯化,尤其是Superdex 75,可将单体和二聚体完全分开(图7D)。
2.6 rF1mut-V的初步鉴定

图2 PCR扩增F1mut1、F1mut2、F1mut及V基因

图3 pMD18-T-F1mut转化TOP10的菌落PCR鉴定
图4 pMD18-T-V转化TOP10的菌落PCR鉴定
将纯化后的蛋白分别进行纯度、浓度、内毒素检测和Western 印迹。Western 印迹使用本室制备的rF1、rV和未改构的rF1-V 抗原为阳性对照,结果表明rF1mut-V 抗原与抗V、F1 抗体均有特异性结合(图8)。同时将本室制备的rF1-V、rF1、rV和rF1mut-V 分别进行非还原和还原型SDS-PAGE(图9),发现rF1、rV和未改构的rF1-V 均有不同程度的聚集,尤其是rF1和rF1-V 的聚集体呈不均一分布,但都可被还原为均一的单体形式。相比于rF1-V,rF1mut-V 主要有单体和二聚体形式,且还原后相对分子质量与rF1-V 的单体一致。从图9 还可以看出rV 抗原在非还原状态下存在二聚体,由于rF1mut-V仅对F1 序列进行改构,而保留了天然V 抗原第273位的半胱氨酸位点,这会导致rF1mut-V 产生同V 抗原一样的分子间二硫键,从而形成同源二聚体[19]。
用Bandscan 软件分析非还原型SDS-PAGE 结果,纯度大于95%。内毒素含量检测表明阴性对照及各样品均为阴性,阳性对照为阳性。
3 讨论
目前鼠疫亚单位疫苗的主要候选抗原为F1 抗原、V 抗原、鼠疫菌外膜蛋白(Y.pestisouter membrane protein,Yops)和纤溶酶原激活物/凝固酶(plasminogen activator/coagulase,Pla)。其中,由英国PharmAthene UK Limited 研发的rF1+rV 疫苗、美国DynPort Vaccine Company LLC 研发的rF1-V 融合蛋白疫苗均已进入临床试验阶段(ClinicalTrials.gov Identifier:NCT00246467,NCT00332956),但目前还没有一种重组亚单位疫苗获批上市,这与之前描述的F1 抗原天然结构造成的缺陷不无关系,因为其会为产品质控和大规模生产带来巨大挑战。

图5 pMD18-T-F1mut和pMD18-T-V质粒的酶切鉴定

图6 pET-32a-F1mut-V转化Top10的菌落PCR鉴定

图7 rF1mut-V纯化过程分析图
图8 Western印迹图谱
本研究在基因水平上对F1 的结构进行改变,通过3轮PCR,将F1蛋白N端前14个氨基酸移到C端,然后将改构的F1mut 与V 蛋白融合表达,得到了序列正确且能够可溶表达的重组F1mut-V 融合蛋白,目的蛋白占全菌蛋白的25%以上。这为后期大规模生产奠定了良好基础,省却了繁琐且容易造成蛋白失活的变性-复性过程。经过硫酸铵分级沉淀、阴离子交换层析、疏水相互作用层析和凝胶过滤层析,分别得到了纯度符合要求的rF1mut-V 单体和二聚体。在纯化中,均采用商品化的层析填料,并且纯化流程衔接顺畅,不需要换液、稀释等中间步骤,便于操作和放大。并进行了Western印迹鉴定,证明融合蛋白与天然结构的rF1-V 一样,均与F1、V 抗原有特异性结合。但相比于rF1-V,改构后rF1mut-V 的性质更为稳定,不会发生如图9 所示的不规则聚集。虽然冻干、低温保存、加入还原剂等手段可以在生产重组F1-V融合蛋白的过程中抑制聚集的发生,但一旦盐浓度提高、温度改变剧烈或去除还原剂,不可控的聚集很快就会发生,甚至有可能会导致沉淀[11]。因此,rF1mut-V 有望成为新一代亚单位疫苗的有效成分。

图9 抗原的SDS-PAGE图谱
[1]Perry R D,Fetherston J D.Yersinia pestis-etiologic agent of plague[J].Clin Microbiol Rev,1997,10:35-66.
[2]Rosenzweig J A,Jejelowo O,Sha J,et al.Progress on plague vaccine development[J].Appl Microbiol Biotechnol,2011,91:265-286.
[3]Kool J L.Risk of person-to-person transmission of pneumonic plague[J].Clin Infect Dis,2005,40:1166-1172.
[4]Meyer K F.Pneumonic plague[J].Bacteriol Rev,1961,25:249-261.
[5]Galimand M,Guiyoule A,Gerbaud G,et al.Multidrug resistance in Yersinia pestis mediated by a transferable plasmid[J].N Engl J Med,1997,337:677-680.
[6]Russell P,Eley S M,Hibbs S E,et al.A comparison of Plague vaccine,USP and EV76 vaccine induced protection against Yersinia pestis in a murine model[J].Vaccine,1995,13:1551-1556.
[7]Smiley S T.Current challenges in the development of vaccines for pneumonic plague[J].Expert Rev Vaccines,2008,7:209-221.
[8]Anderson G W Jr,Worsham P L,Bolt C R,et al.Protection of mice from fatal bubonic and pneumonic plague by passive immunization with monoclonal antibodies against the F1 protein of Yersinia pestis[J].Am J Trop Med Hyg,1997,56:471-473.
[9]Debord K L,Anderson D M,Marketon M M,et al.Immunogenicity and protective immunity against bubonic plague and pneumonic plague by immunization of mice with the recombinant V10 antigen,a variant of LcrV[J].Infect Immun,2006,74:4910-4914.
[10]Williamson E D,Flick-Smith H C,Waters E,et al.Immunogenicity of the rF1+rV vaccine for plague with identification of potential immune correlates[J].Microb Pathog,2007,42:11-21.
[11]Powell B S,Andrews G P,Enama J T,et al.Design and testing for a nontagged F1-V fusion protein as vaccine antigen against bubonic and pneumonic plague[J].Biotechnol Prog,2005,21:1490-1510.
[12]Wolfe L L,Shenk T M,Powell B,et al.Assessment of a recombinant F1-V fusion protein vaccine intended to protect Canada lynx(Lynx canadensis)from plague[J].J Wildl Dis,2011,47:888-892.
[13]Goodin J L,Nellis D F,Powell B S,et al.Purification and protective efficacy of monomeric and modified Yersinia pestis capsular F1-V antigen fusion proteins for vaccination against plague[J].Protein Expr Purif,2007,53:63-79.
[14]Anderson G W Jr,Heath D G,Bolt C R,et al.Short-and long-term efficacy of single-dose subunit vaccines against Yersinia pestis in mice[J].Am J Trop Med Hyg,1998,58:793-799.
[15]Mizel S B,Graff A H,Sriranganathan N,et al.Flagellin-F1-V fusion protein is an effective plague vaccine in mice and two species of nonhuman primates[J].Clin Vaccine Immunol,2009,16:21-28.
[16]Knight S D.Structure and assembly of Yersinia pestis F1 antigen[J].Adv Exp Med Biol,2007,603:74-87.
[17]Zavialov A V,Berglund J,Pudney A F,et al.Structure and biogenesis of the capsular F1 antigen from Yersinia pestis:preserved folding energy drives fiber formation[J].Cell,2003,113:587-596.
[18]Zavialov A V,Kersley J,Korpela T,et al.Donor strand complementation mechanism in the biogenesis of non-pilus systems[J].Mol Microbiol,2002,45:983-995.
[19]Derewenda U,Mateja A,Devedjiev Y,et al.The structure of Yersinia pestis V-antigen,an essential virulence factor and mediator of immunity against plague[J].Structure,2004,12:301-306.

