顺铂联合鸦胆子油乳对人卵巢癌裸鼠原位移植瘤生长的影响
赵楠,韩凤娟,王桂媛,李玉花
1.黑龙江中医药大学 附属第一医院,黑龙江 哈尔滨 150040;2.东北林业大学,黑龙江 哈尔滨 150040
顺铂是中心以二价铂同2 个氯原子和2 个氨分子结合的重金属络合物,具有较强的广谱抗癌作用,可抑制DNA的复制过程,高浓度时抑制RNA及蛋白质合成。临床上顺铂可以与多种抗肿瘤药协同作用,且无交叉耐药特点,为当前联合化疗中最常用的药物之一,一般多用于生殖系统肿瘤如卵巢癌、前列腺癌、睾丸癌,头颈部癌如鼻咽癌、头颈部鳞癌、甲状腺癌,对肺癌、乳腺癌等也有一定的功效。鸦胆子油乳由中药鸦胆子[Brucea javanica(L.)Merr.]干燥的成熟果实提取的脂肪油经乳化作用制成,其主要活性成分油酸及亚油酸具有很强的抗癌活性,与肿瘤细胞膜有特异的亲和力[1],能抑制肿瘤细胞的DNA合成。研究表明,鸦胆子油乳作为临床应用较广的一种中药,对多种恶性肿瘤细胞均具有诱导凋亡的作用,并可逆转多种癌细胞的多药耐药,临床上多采用鸦胆子油乳作为逆转剂与常用抗癌药合用治疗产生耐药性的肿瘤。
1 材料和方法
1.1 材料
BALB/c(nu/nu)裸小鼠,雌性,鼠龄4~8 周,体重18~22 g,SPF 级,购于哈尔滨医科大学实验动物中心[合格证号:11400700054740],恒温(25℃±2℃)、恒湿(45%~50%)饲养于无菌实验室的净化空气层流架中。人卵巢癌SKOV3 细胞株购自哈尔滨医科大学附属第二医院;鸦胆子油乳剂购自浙江九旭药业公司,10 mL/支;顺铂购自山东齐鲁制药厂,50 mL/支;新生胎牛血清、DMEM 培养液、胰蛋白酶购自Sigma 公司;二甲亚飒(DMSO)购自北京化学试剂厂;DAB 显色试剂盒、兔抗人整合素α5、MRP-1/CD9免疫组化试剂盒、免疫组化SP 试剂盒均购自北京博奥森生物工程有限公司。
1.2 人卵巢癌细胞株的培养
人卵巢癌SKOV3 细胞株培养于含10%小牛血清的培养液中,在98%相对湿度、37℃、5%的CO2培养箱内传代培养。常规消化收集处于对数生长期的细胞,计数活细胞数,读出细胞浓度,将细胞分装入离心管,12 000 r/min 离心5 min,去其上清液,并调整细胞浓度为(1~3)×107/mL。
1.3 肿瘤动物模型的建立
常规消毒裸鼠,将浓度为1×107/mL 的SKOV3 细胞0.2 mL 注射于裸鼠后背部皮下,待接种成功的原代接种瘤生长至直径1~1.5 cm,颈椎脱臼法处死裸鼠,剥取皮下肿瘤浸入4℃的生理盐水中漂洗,并切成1 mm3大小。常规麻醉、消毒裸鼠,将准备好的皮下肿瘤组织小块小心放置在卵巢破口深处,滴注适量医用生物蛋白胶固定,观察有无出血,逐层关腹。
1.4 动物给药及处理
裸鼠接种2 周后,测得裸鼠的体重为18~24 g,给予药物干预。用随机数字表将32 只裸鼠完全随机分为4组,每组8只,分别为空白对照组、鸦胆子油乳组、顺铂组和鸦胆子油乳顺铂联合组。空白对照组给予生理盐水0.2 mL/只,鸦胆子油乳组给予鸦胆子油乳0.2 mL/20 g,顺铂组给予顺铂0.2 mL(按3 mg/kg计算),联合组给予鸦胆子油乳注射液0.2 mL/20 g 加顺铂0.2 mL。每隔3 d 给药1 次,共计腹腔给药6次。
1.5 实验观察指标
1.5.1 移植瘤裸鼠生长情况 每日观察裸鼠的精神状态、活动、饮食、排便、对外界的反应等,以及移植瘤表面有无红肿及破溃面,其大小、形态、质地、硬度、活动度,并触及有无搏动。
1.5.2 移植瘤生长参数测定 ①肿瘤体积测量:移植瘤裸鼠处死后剥瘤块取出肿瘤组织,电子天平称重,并用游标卡尺测量瘤体最长径(a/mm)与最短径(b/mm),根据公式V=ab2/2计算肿瘤体积。②肿瘤抑制率检测:肿瘤抑瘤率(%)=(1-治疗组肿瘤组织平均重量/空白组肿瘤组织平均重量)×100%。③相对肿瘤增殖率(T/C)的计算:相对肿瘤增殖率(T/C)=(TRTV/CRTV)×100%。TRTV 为治疗组相对肿瘤体积,CRTV为阴性对照组相对肿瘤体积,RTV(相对肿瘤体积)=V/V0(V0为给药前肿瘤体积,V为处死前肿瘤体积)。疗效评价标准:T/C>60%为无效;T/C≤60%,并经统计学处理P<0.05为有效。
1.5.3 血细胞指标检测 末次给药后将各组裸鼠眼眶取血后处死,收集血液于EP 管中,加入肝素抗凝剂,取300μL用血细胞分析仪检测白细胞及血小板数目;取500μL 静置30 min,离心取血清,检测各组裸鼠血清中谷丙转氨酶(ALT)、乳酸脱氢酶(LDH)、血肌酐(CR)的变化。
1.6 统计学方法
采用SPSS19.0 软件进行数据分析,计量资料用x±s 表示,进行正态性及方差齐性分析,两组间均数使用独立样本t检验,两组用药前后使用配对t检验,多组比较采用单因素方差分析,组间比较采用多重比较LSD 法。以α=0.05 为检验水准,P<0.05 视为差异显著,有统计学意义。
2 结果
2.1 SKOV3裸鼠移植瘤模型的建立
观察发现,一般接种2~3 d 后裸鼠后背即可出现界限清晰、质地柔软的“假瘤样”皮下结节;1~2 周后部分移植瘤表面出现破溃,部分可见血管;当移植瘤直径达1.5 cm 后,肿瘤生长速度逐渐减慢,裸鼠精神萎靡、消瘦、厌食、怕光、烦躁,一般生存期为37~42 d。
2.2 卵巢癌SKOV3原位肿瘤的形成
移植原位肿瘤后常规饲养裸鼠。一般可见,移植28 d 后原位肿瘤生长速度减慢,荷瘤鼠逐渐表现出消瘦、萎靡、厌食等症状。剖腹探查原位肿瘤的形成,发现肿瘤直径为1.0~2.0 cm,有1 只发生肠系膜腹腔转移。见图1。
2.3 不同药物对SKOV3裸鼠移植瘤体积的影响
给药前各组裸鼠肿瘤体积差异无统计学意义(P>0.05)。随着治疗天数的增加,治疗结束后,各组裸鼠肿瘤体积产生明显差异,各治疗组与对照组相比差异显著(P<0.01),说明鸦胆子油乳组、顺铂组、联合组均可有效遏制肿瘤细胞生长(表1)。
2.4 不同药物对SKOV3 裸鼠移植瘤重量的抑制作用及抑瘤率比较
鸦胆子油乳组、顺铂组、联合组的抑瘤率分别为23.56%±3.67%、42.57%±3.45%、48.36%±3.08%,联合组的抑瘤率明显高于鸦胆子油乳组和顺铂组,可以有效遏制肿瘤组织的生长(表2)。
2.5 不同药物对SKOV3裸鼠移植瘤体积、RTV 与T/C的影响
腹腔注射给药后,鸦胆子油乳组、顺铂组与联合组肿瘤体积、RTV和T/C 明显下降,T/C 均低于60%,根据抗肿瘤药效学指导原则中的疗效评价标准,揭示其体内抗肿瘤活性较强,且与阴性对照组比较差异有统计学意义(P<0.05)(表3)。
2.6 不同药物对SKOV3 裸鼠白细胞及血小板的影响
通过检测裸鼠血小板和白细胞数量来观察各治疗组的变化,发现与对照组相比,鸦胆子油乳组血小板、白细胞数量均减少,其中血小板的减少差异不显著(P>0.05),而白细胞数量减少的差异具有统计学意义(P<0.01);而顺铂组、联合组的血小板、白细胞数量均明显减少,且差异均具有统计学意义(P<0.01)(表4)。
2.7 不同药物对SKOV3裸鼠肝肾功能的影响
与空白对照组比较,鸦胆子油乳组治疗后裸鼠ALT 值无显著差异,不具有统计学意义(P>0.05),LDH、CR 值差异显著(P<0.01);与鸦胆子油乳组比较,顺铂组与联合组的ALT、LDH、CR 值均有所升高,差异有统计学意义(P<0.01)(表5)。
表1 不同药物对SKOV3裸鼠移植瘤体积的影响(n=8,)

表1 不同药物对SKOV3裸鼠移植瘤体积的影响(n=8,)
表2 不同药物对SKOV3裸鼠移植瘤重量的抑制作用及抑瘤率比较(n=8,)
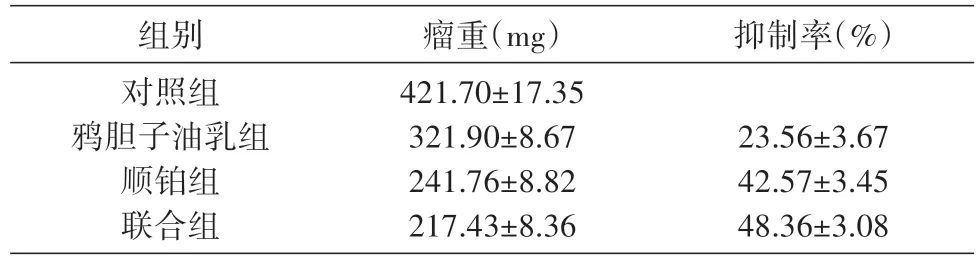
表2 不同药物对SKOV3裸鼠移植瘤重量的抑制作用及抑瘤率比较(n=8,)
表3 不同给药组裸鼠瘤体积的RTV及T/C值(n=8,)

表3 不同给药组裸鼠瘤体积的RTV及T/C值(n=8,)
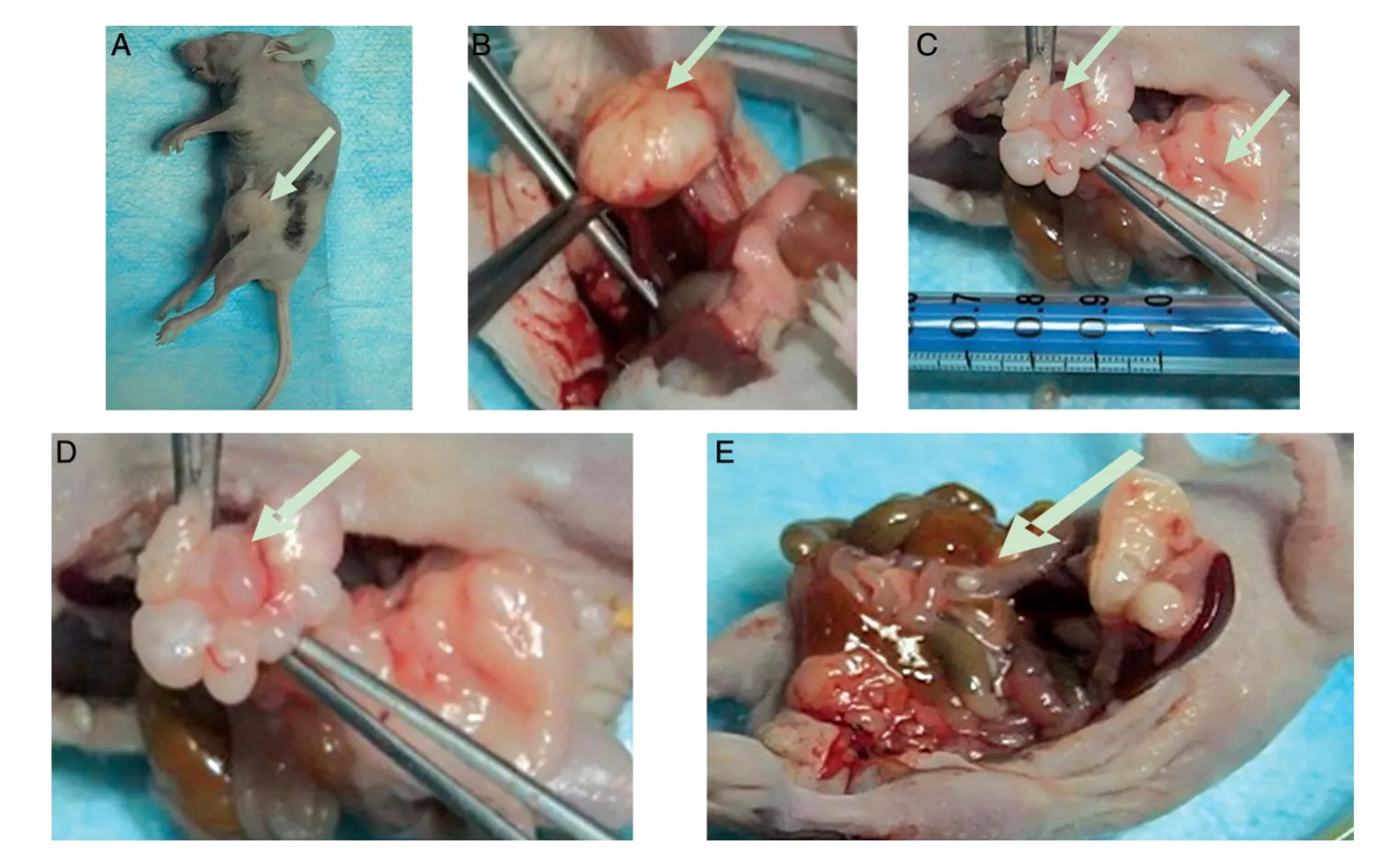
图1 原位肿瘤的形成(A)、形态(B)、大小(C)、正面形态(D)及肠系膜转移(E)
表4 不同药物对SK0V3裸鼠白细胞及血小板的影响(n=8,)

表4 不同药物对SK0V3裸鼠白细胞及血小板的影响(n=8,)
表5 不同药物对SKOV3裸鼠肝肾功能的影响(n=8,)

表5 不同药物对SKOV3裸鼠肝肾功能的影响(n=8,)
3 讨论
卵巢癌是女性生殖系统三大恶性肿瘤之一,发病率居于妇科恶性肿瘤第三位,死亡率居于妇科恶性肿瘤之首,五年生存率为15%~30%[2-3],严重威胁着女性健康及生命。肿瘤细胞减灭术、铂类化疗药物和紫杉醇联合化疗的综合治疗,仍是目前临床上治疗卵巢癌的主要方式。上世纪60 年代开始采用腹腔灌注化疗治疗卵巢癌,主要针对患者术后残余及腹腔转移的病灶进行治疗,可以有效清除游离癌细胞及微小癌灶,防治术后腹腔复发及肝脏转移,提高患者生存率,改善生存质量。
我们的前期体外实验研究已证实鸦胆子油乳及其联合顺铂可以抑制人卵巢癌SKOV3 细胞的生长,促进其凋亡。随着药物浓度的增加及作用时间的延长,细胞生长抑制率呈上升趋势。在此基础上,我们将体外实验引入体内,将肿瘤细胞悬液皮下注射成瘤后,取成型的皮下肿瘤进行组织块原位移植,建立人卵巢癌裸鼠原位移植瘤模型,分组给予药物干预,进一步观察鸦胆子油乳及其联合顺铂对人卵巢癌SKOV3细胞裸鼠皮下移植瘤生长的影响。
3.1 人卵巢癌SKOV3裸鼠原位移植瘤模型的建立
自1969年丹麦学者Rygaard和Povlsen首次建立了人结肠癌组织裸鼠皮下移植瘤模型后,裸鼠移植瘤模型实验技术日臻完善。裸鼠移植瘤模型成为探索肿瘤的发生发展规律、检测抗肿瘤药物的敏感性、研发新型抗肿瘤药物的有效实验手段[4]。卵巢癌裸鼠移植瘤模型按肿瘤的来源不同,可以分为切除标本实体瘤和卵巢癌细胞株;按接种部位的不同,可以分为皮下移植裸鼠模型、腹腔种植裸鼠模型和裸鼠体内原位移植模型[5]。
1993 年Fidler 建立了第一个人卵巢癌原位移植模型,该方法保留了人肿瘤的遗传学及卵巢原发瘤灶、局部浸润、对侧卵巢转移、腹腔大网膜和脏器表面种植、盆腔淋巴结转移、腹水形成等卵巢癌的生物学特性[6-7],能够更客观、真实地反映人卵巢癌的临床发展过程。手术切除标本实体瘤模型病例结构更接近人卵巢癌,但建模时间长、难度大,成功率多为28%~40%[8-9],而细胞株建立模型的原代移植成功率则高达90%,肿瘤组织块鼠间传代的移植成功率高达100%[10]。所以,采用肿瘤细胞株培养后建模的方法较为理想。
我们通过将人体肿瘤细胞接种到免疫缺陷小鼠BALB/c(nu/nu)体内的移植方法,建立了人卵巢癌SKOV3 裸鼠原位移植瘤模型。该模型成瘤率高且稳定,实验周期短,干预措施易于实施,且样本的均一性及实验结果的重复性较为客观,样本脱落少,更能准确真实地反映肿瘤在体内的发生演变过程。
3.2 鸦胆子油乳联合顺铂腹腔给药治疗卵巢癌的疗效性分析
中药鸦胆子油乳注射液是由鸦胆子干燥的成熟果实提取的脂肪油经乳化作用制成的水包油型乳剂,具有抗癌活性的油酸及亚油酸是其主要活性成分,并且可以与肿瘤细胞膜发生细胞特异性亲和。鸦胆子油乳的有效成分具有细胞周期非特异性抗肿瘤作用,能够抑制肿瘤细胞的DNA 合成,使肿瘤细胞变性、破裂、坏死,同时作用于机体免疫调节系统,改善细胞免疫状态。这可能是其发挥抗肿瘤作用的机制之一。鸦胆子油乳主要通过质膜系统和线粒体系统直接杀伤癌细胞,其活性成分不饱和脂肪酸可以通过降低肿瘤细胞的-SH 基含量,使细胞膜变薄,从而增加对抗癌药物的通透性,提高细胞内药物浓度,有利于抗癌药物的渗透。因此,在临床上多采用鸦胆子油乳与常用抗癌药联合放化疗治疗肿瘤。
1978 年美国首先批准临床采用顺铂治疗肿瘤,其具有高效广谱抗癌的特点,抗肿瘤主要机制是可与肿瘤细胞DNA 结合,并破坏DNA 功能,阻断其复制,导致肿瘤细胞的生长受到抑制[11]。此外,顺铂还参与肿瘤细胞的跨膜转运、水合解离、靶向迁移[12],均与其抗肿瘤效应相关。临床上顺铂联合化疗仍是目前应用广泛的治疗方案,其在提高患者生存率的同时,也存在一定的毒性作用[13]。顺铂一般容易引起消化道反应、骨髓抑制、肾毒性、耳毒性及周围神经毒性等副反应。
我们通过测量裸鼠移植瘤体积、抑瘤率等,发现鸦胆子油乳及其联合顺铂对SKOV3 移植瘤的生长具有抑制作用;检测裸鼠白细胞、血小板数目及肝肾功能的改变,显示鸦胆子油乳相对于顺铂对人卵巢癌SKOV3 细胞裸鼠白细胞及血小板、肝肾功能(ALT、LDH、CR)的影响较小,具有低毒作用,在一定程度上可以避免顺铂化疗药物所致的不良反应,在临床上具有广泛的应用前景。
[1]Pan L,Chin Y W,Chai H B,et al.Bioactivity-guided isolation of cytotoxic constituents of Brucea javanica collected in Vietnam[J].Bioorg Med Chem,2009,17(6):2219-2224.
[2]Jemala A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[3]Bernstein B J.Docetaxel as an alternative to paclitaxel after acute hypersensitivity reactions[J].Annals Pharmacother,2000,34(11):1332-1335.
[4]Klostergaard J,Leroux M E,Auzenne E,et al.Hyperthermia engages the intrinsic apoptotic pathway by enhancing upstream caspase activation to overcome apoptotic resistance in MCF-7 breast adenocarcinoma cells[J].J Cell Biochem,2006,98:356-369.
[5]Huang X,Lin T,Gu J,et al.Combined TRAIL and Bax gene therapy prolonged survival in mice with ovarian cancerxenograft[J].Gene Ther,2002,9(20):1379-1382.
[6]高国兰,邹春芳,邹学森,等.人卵巢上皮癌裸鼠皮下移植瘤模型的建立及生物学性状的鉴定[J].实用癌症杂志,2004,19(5):454-457.
[7]Turner J H,Rose A H,Glancy R J,et al.Orthotopic xenografts of human melanoma and colonic and ovarian carcinoma in sleep to evaluate radioimmotherapy[J].Br J Cancer,1998,78:486-494.
[8]陈爱平,王和,彭芝兰,等.人卵巢癌裸鼠移植瘤和腹水瘤模型的建立及形态学观察[J].肿瘤,2001,21(2):82-84.
[9]Malik S T,East N,Boraschi D,et al.Effects of intraperitoneal recom-binant interleukin-1 beta in intraperitoneal human ovarian cancer xenograft models:comparisonwith the effects of tumour necrosis factor[J].Br J Cancer,1992,65(5):661.
[10]闫忠鑫,韩凤娟,翟小龙,等.卵巢癌裸鼠移植瘤模型对比和可视化研究进展[J].世界中西医结合杂志,2012,7(7):636-638.
[11]Wang D,Lippard S J.Cellular processing of platinum anticancer drugs[J].Nat Rev Drug Discov,2005,4(4):307-320.
[12]Saad A A,Youssef M I,El-shennawy L K.Cisplatin induced damage in kidney genomic DNA and nephrotoxicity in malerats:The protective effect of grape seed proanthocyanidin extract[J].Food Chem Toxicol,2009,47(7):1499-1506.
[13]Launay-Vacher V,Rey J B,Isnard-Bagnis C,et al.Prevention of cisplatin nephrotoxicity:state of the art and recommendations from the Eurpean Society of Clinical Pharmacy Special Interest Group on Cancer Care[J].Cancer Chemother Pharmacol,2008,61(2008):903-909.

