人抑癌基因NKX2-3真核表达载体的构建及其对肿瘤细胞生长的作用
冯滢滢,郭靖,刘家宏,徐小洁,张云静,陈云萍,叶棋浓,赵克
1.第二炮兵总医院 结直肠肛门外科,北京 100088;2.军事医学科学院 生物工程研究所,北京 100850;
3.解放军总医院第一附属医院 肿瘤一科,北京 100048;4.解放军180医院 内3科,福建 泉州 362000
NK2转录因子相关基因位点3(NKX2-3)是同 源结构域转录因子NKX家族中的重要成员,可调节细胞特异性基因的表达,参与组织分化和发育[1-3]。研究显示NKX2-3不仅影响肠道免疫炎症反应,是炎性肠病(IBD)相关性基因[4-5],而且可能通过调节Wnt信号通路实现调节细胞增殖、生长及肿瘤形成等作用,从而参与散发性和IBD相关结直肠癌的发病[6]。因此,我们决定构建带Flag标签的NKX2-3真核表达载体,并探讨其对结肠癌、肝癌细胞生长的影响,为后续研究做准备。
1 材料和方法
1.1 材料
人结肠癌HCT-116细胞系、人肝癌HepG2细胞系、人胚肾293T细胞系、大肠杆菌DH5α、带Flag标签的pcDNA3.0载体由本室传代培养;人乳腺文库由本室保存;限制性内切酶,T4DNA连接酶为TaKaRa公司产品;PCR回收试剂盒、质粒提取、胶回收试剂盒为Promega公司产品;VigoFect为威格拉斯生物技术有限公司产品;胎牛血清、DMEM为Gibco公司产品;引物由北京赛百盛生物技术有限公司合成;测序由北京博迈德生物技术有限公司完成;HRP标记的小鼠抗Flag M2标签单克隆抗体为Sigma公司产品。
1.2 Flag-pcDNA3.0-NKX2-3重组质粒的构建与测序
根据在NCBI网站查询的NKX2-3编码序列(NC_000010.11)合成上游引物(5'-CGGGATCCAT GATGTTACCAAGCCCGGTCA-3')和下游引物(5'-CCGCTCGAGCTACCAGGCCCGGATGCCCTGC-3'),PCR扩增人NKX2-3的编码序列(扩增条件:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸150 s,30个循环;72℃再延长7 min),4℃保存,胶回收试剂盒回收PCR产物;用BamHⅠ和XhoⅠ双酶切带Flag标签的pcDNA3.0载体,经37℃、12 g/L琼脂糖凝胶电泳4 h后,胶回收载体大片段;将PCR片段用XhoⅠ和BamHⅠ双酶切,形成带有粘端的双链,用T4DNA连接酶与带Flag标签的pcDNA3.0载体连接,转化大肠杆菌DH5α,挑取阳性克隆,振荡培养后对菌液PCR鉴定阳性的提取质粒,经XhoⅠ和BamHⅠ双酶切鉴定,鉴定正确的克隆送北京博迈德生物技术有限公司测序。
1.3 转染人胚肾293T细胞和Western印迹检测
将人胚肾293T细胞接种于2块6 cm皿中,皿中载有含1%双抗、10%胎牛血清的DMEM培养基,接种量以转染时70%~80%的细胞密度为宜,转染前1 h 换液。将 4 μL VigoFect与 200 μL NaCl溶液混合,静置 5 min;期间将 10 μg重组质粒与 200 μL NaCl溶液混合,轻柔吹打混匀后将上述2种溶液混匀,室温静置15 min后均匀加入6 cm皿中,同法转染Flag-pcDNA3.0载体作为对照;37℃、5%CO2常规培养,4~6 h换液,24 h后收取细胞,3000 r/min离心5 min,弃上清,加2倍细胞量的RIPA,冰上裂解20~30 min,继续加入等量2×SDS上样缓冲液,沸水煮15 min,12 000 r/min离心 2 min,取上清液进行SDS-PAGE,再电转移至硝酸纤维素膜上;用5%脱脂奶粉于4℃封闭1 h,用HRP标记的抗Flag标签鼠单克隆抗体室温孵育1 h,抗体用5%脱脂奶粉1∶5000稀释,1×TBST洗膜3次,5 min/次;化学发光法显色10 min,压片显影。
1.4 生长曲线实验
Flag-pcDNA3.0-NKX2-3 质粒分别转染 HCT-116、HepG2细胞24 h后,与转染Flag-pcDNA3.0空载体的对照HCT-116、HepG2细胞同时以3000/孔的密度接种于5块96孔板,每组设3个复孔,每孔含培养基100 μL,分别在第0、1、2、3、4 d同一时间吸弃原培养基,加入含10 μL CCK-8的培养基100 μL,37℃、5%CO2孵育1 h,测定D450nm值。以培养时间为横轴、D450nm值平均值为纵轴绘制生长曲线。
2 结果
2.1 Flag-pcDNA3.0-NKX2-3重组质粒的构建与鉴定
根据NCBI查询的NKX2-3编码序列合成上、下游引物后PCR扩增人NKX2-3的编码序列,获得长约1080 bp的DNA片段,与预期一致(图1)。将PCR产物用XhoⅠ和BamHⅠ双酶切后,与同样经XhoⅠ和BamHⅠ酶切的Flag-pcDNA3.0载体连接,转化大肠杆菌DH5α,挑选克隆进行菌液PCR鉴定,若获得与目的条带1080 bp大小接近(图2)的克隆,则初步认为是带有人NKX2-3基因的阳性重组克隆。将所得阳性克隆提质粒,经酶切鉴定,可切出2条长度分别约为5000和1080 bp的条带,而相应的空载体酶切只见大片段,符合预期结果(图3)。DNA序列测定结果表明,插入的DNA序列与人NKX2-3基因的编码序列完全一致(数据略)。

图1 PCR扩增人NKX2-3的编码序列M:DL2000 DNA marker;1:PCR扩增产物

图2 重组质粒Flag-pcDNA3.0-NKX2-3的菌液PCR结果电泳图谱M:DL2000 DNA marker;1:阴性对照(无模板的PCR扩增);2:以乳腺文库为模板PCR扩增的阳性对照;3~5:Flag-NKX2-3的1~3号克隆的菌液PCR结果
2.2 Western印迹检测Flag-NKX2-3在293T细胞中的表达
将构建的Flag-NKX2-3重组质粒和空载体分别转染293T细胞系,24 h后提蛋白进行SDS-PAGE,Western印迹检测Flag-NKX2-3蛋白的表达。结果如图4所示,转染重组质粒后,Flag-HRP抗体在相对分子质量约43×103处检测到明显特异性条带,而空载体无条带,说明Flag-NKX2-3能够在293T细胞系中正确表达,而空载体不表达。
2.3 CCK8法检验Flag-NKX2-3对肿瘤细胞系生长的抑制作用
有研究显示,NKX2-3基因主要有调节细胞增殖、生长及肿瘤形成的作用。我们将Flag-NKX2-3真核表达载体及Flag-pcDNA3.0载体转染结肠癌HCT-116细胞系、肝癌HepG2细胞系,用CCK8法检测细胞生长曲线。结果如图5所示,NKX2-3能抑制这2种细胞的生长。
3 讨论
NKX2-3作为NKX同源转录因子家族成员,主要表达于肠道和脾脏中胚层起源的组织细胞,如肠道黏膜固有层和黏膜下层的微血管内皮细胞以及平滑肌细胞,在脾脏和肠道集合淋巴结中可影响B细胞成熟和T细胞依赖性免疫反应。NKX2-3缺陷小鼠实验揭示了NKX2-3在脾脏、小肠形成和发展中的重要作用,以及对黏膜定居因子细胞黏附分子1(MADCAM-1)的重要意义[1,7-9],许多研究也证实其在炎性肠病发病中举足轻重的作用[5,10]。在本研究中,我们首次发现NKX2-3能抑制结肠癌HCT-116细胞、肝癌HepG2细胞的生长,可能是一个抑癌基因。这与近几年的研究结果相符。
Phiel曾在2001年报道NKX2-3可能在平滑肌肉瘤形成中发挥作用[11]。2008年Wang报道NKX2-3在散发性肠癌患者癌组织中较正常组织低表达,可能是一个抑癌基因[12]。转录因子可以调节下游基因,2009年Yu发现NKX2-3在Crohn病患者病变肠道组织中高表达[13],于是他在2株肠癌细胞株(散发性结肠癌细胞株和炎性肠病相关性肠癌细胞株)中筛选检测所有受NKX2-3影响的基因,发现分别有1677和1375个基因受其调控,其中至少7个基因是Wnt信号通路上的,Wnt信号通路的失调是结肠癌形成机制中的重要事件,推测NKX2-3通过调节Wnt信号通路参与了炎性肠病相关的肠癌和散发性肠癌的发病过程[6]。同年,Leja在研究胃肠道神经内分泌肿瘤过程中也发现NKX2-3在肝转移癌组织中的表达比在正常肠黏膜组织和原发肿瘤组织中明显低,推测NKX2-3可能参与了肿瘤的侵袭转移过程[14]。
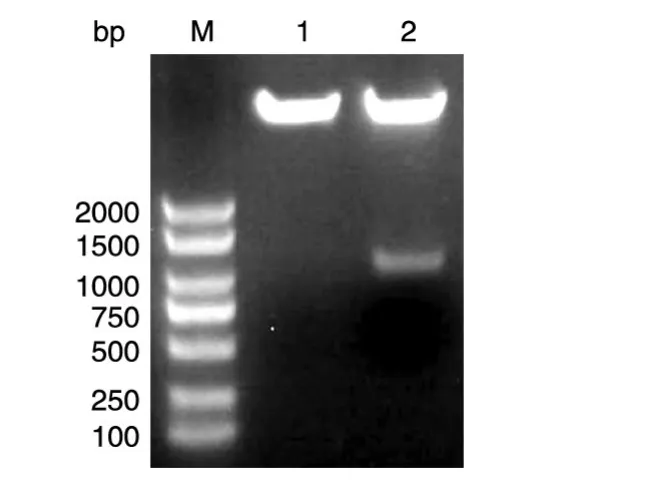
图3 重组质粒Flag-NKX2-3的XhoⅠ和BamHⅠ双酶切电泳图谱M:DL2000 DNA marker;1:空载体Flag-pcDNA3.0-NKX2-3;2:重组质粒Flag-NKX3-2

图4 Western印迹检测Flag-NKX2-3蛋白的表达1:转染空载体质粒的293T细胞;2:转染重组质粒Flag-NKX2-3的293T细胞

图5 NKX2-3抑制肿瘤细胞生长
除此之外,Yu在2011年的另一项研究中再次证实受NKX2-3调节的基因至少有1000个,涉及众多信号通路,其中最重要的有G蛋白偶联受体通路、ERK/MAPK信号通路、VEGF-PI3K/AKT通路,参与了免疫炎性反应,血管形成,细胞的增殖、生长和肿瘤形成,代谢过程,细胞黏附、转移等,并且证实NKX2-3的下调激活了MAPK信号通路[15]。这和我们的实验结果一致,也解释了NKX2-3抑制肿瘤细胞生长可能与抑制MAPK通路有关,但还须进行深入研究。
综上所述,NKX2-3是一个与癌症关系密切的多功能抑癌基因。我们构建的Flag-NKX2-3重组质粒在真核细胞中获得了表达,易于检测,表达的NKX2-3蛋白能够抑制结肠癌、肝癌细胞的生长,与文献报道一致,这为进一步了解NKX2-3在肿瘤发生、发展中的作用及机制奠定了基础。
[1] Krumlauf R. Hoxgenes in vertebrate development[J]. Cell,1994,78:191-201.
[2] Pabst O,Schneider A,Brand T,et al.The mouse Nkx2-3 ho⁃meodomain gene is expressed in gut mesenchyme during preand postnatal mouse development[J].Dev Dyn,1997,209:29-35.
[3] Pabst O,Zweigerdt R,Arnold H H.Targeted disruption of the homeobox transcription factor Nkx2-3 in mice results in postnatal lethality and abnormal development of small intes⁃tine and spleen[J].Development,1999,126:2215-2225.
[4] Franke A,Balschun T,Karlsen T H,et al.Replication of sig⁃nals from recent studies of Crohn's disease identifies previous⁃ly unknown disease loci for ulcerative colitis[J].Nature Genet⁃ic,2008,40:713-715.
[5] Yamazaki K,Takahashi A,Takazoe M,et al.Positive associa⁃tion of genetic variants in the upstream region of NKX2-3 with Crohn's disease in Japanese patients[J].Gut,2009,58:228-232.
[6] Yu W,Lin Z,Pastor D M,et al.Genes regulated by Nkx2-3 in sporadic and inflammatory boweldisease-associated colorectalcancercelllines[J].Dig DisSci,2010,55:3171-3180.
[7] Fu Y,Yan W,Mohun T J,et al.Vertebrate tinman homo⁃logues XNkx2-3 and XNkx2-5 are required for heart forma⁃tion in a functionally redundant manner[J].Development,1998,125:4439-4449.
[8] Wang C C,Biben C,Robb L,et al.Homeodomain factor Nkx2-3 controls regional expression of leukocyte homing core⁃ceptor MAdCAM-1 in specialized endothelial cells of the vis⁃cera[J].Dev Biol,2000,224:152-167.
[9] Tarlinton D,Light A,Metcalf D,et al.Architectural defects in the spleens of Nkx2-3-deficient mice are intrinsic and as⁃sociated with defects in both B cell maturation and T cell-de⁃pendent immune responses[J].J Immunol,2003,170:4002-4010.
[10]Franke A,Balschun T,Karlsen T H,et al.Replication of sig⁃nals from recent studies of Crohn's disease identifies previous⁃ly unknown disease loci for ulcerative colitis[J].Nat Genet,2008,40:713-715.
[11]Phiel C J,Gabbeta V,Parsons L M,et al.Differential bind⁃ing of an SRF/NK-2/MEF2 transcription factor complex in normalversus neoplastic smooth muscle tissues[J].J Biol Chem,2001,276:34637-34650.
[12]Wang X,Zbou C,Qiu G,et al.Screening of new tumor sup⁃pressor genes in sporadic colorectal cancer patients[J].Hepato-Gastroenterology,2008,55:2039-2044.
[13]Yu W,Lin Z,Kelly A A,et al.Association of a Nkx2-3 polymorphism with,Crohn's disease and expression of Nkx2-3 is up-regulated in B cell lines and intestinal tissues with Crohn's disease[J].J Crohns Colitis,2009,3:189-195.
[14]Leja J,Essaghir A,Essand M,et al.Novel markers for en⁃terochr-omaffin cells and gastrointestinal neuroendocrine car⁃cinomas[J].Modern Pathol,2009,22:261-272.
[15]Yu W,Hegarty J P,Berg A,et al.NKX2-3 transcriptional regulation of endothelin-1 and VEGF signaling in human in⁃testinal microvascular endothelial cells[J].PLoS One,2011,6(5):1-10.

