卷柏多糖抗肠道病毒71型活性及机制研究
夏燕平,马腾,齐向云,李庆军 ,王升启 ,杨静
1.河南中医学院 药学院,郑州 河南 450008;2.军事医学科学院 放射与辐射医学研究所,北京 100850;
3.航天中心医院 心脏病诊疗科,北京 100049
肠道病毒71型(enterovirus type 71,EV71)为单股正链RNA病毒,是小RNA病毒科肠道病毒属A组肠道病毒,也是引起手足口病的主要病原体。与其他引起手足口病的肠道病毒不同之处在于EV71具神经嗜性,可引起无菌性脑膜炎、脑干脑炎和神经源性肺水肿等疾病[1]。目前,人类是EV71惟一已知的自然宿主[2],5岁以下婴幼儿为易感人群[3]。该病毒自1969年首次被报道以来,已经引发全球范围内10多次暴发与流行,给人类特别是婴幼儿健康造成了巨大的威胁[4]。中药卷柏为卷柏科植物卷柏(Selagi⁃nella tamariscina)或垫状卷柏的干燥全草,其性辛味平,具有活血通经、化瘀止血之功效[5]。现代研究发现卷柏具有抗肿瘤[6~8]、抗病毒[9-10]、抗炎抑菌[11-13]、抗过敏[14]、降血糖[15]、抗氧化[16]和抗衰老[17]等诸多药理活性。文献报道卷柏抗病毒的有效成分主要为黄酮类[9-10],而本实验室前期研究发现卷柏多糖有很好的抗EV71导致的RD细胞病变效应,其中30%和50%醇沉卷柏多糖抑制作用显著,80%和95%醇沉卷柏多糖抑制作用不明显[18]。目前临床上尚无特效的抗EV71药物,主要采用对症治疗和利巴韦林等广谱类抗病药物。我们以利巴韦林为阳性对照[19],通过噬斑法和细胞病变效应法(cytopathic effect,CPE)检测了醇沉卷柏多糖在Vero细胞中的体外抗EV71活性,筛选出选择指数(selection index,SI)最高的卷柏多糖醇沉部位,并初步探索其对EV71的直接杀灭作用及对病毒生活周期的影响,研究卷柏多糖抗病毒活性的作用机制。
1 材料与方法
1.1 材料
非洲绿猴肾细胞(Vero细胞)由中国药品与生物制品研究所赠送,用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的MEM培养液,在37℃和5%CO2条件下培养,2 d传代1次;EV71为国际标准BrCr株,由本实验室于-70℃保存。
新鲜卷柏采自河南省西峡县,制备方法参照文献[18]:用10倍量水煮沸2 h,过滤;滤渣用8倍量水煮沸2 h,过滤;合并2次滤液,减压浓缩至相对密度约1.1左右得总部位稠膏;用适量水溶解,依次用乙醚、乙酸乙酯、正丁醇萃取,剩余部分低温减压浓缩,真空干燥得到水部位干燥物;取适量水部位干燥物水溶后用80%乙醇醇沉2次,过滤,沉淀先后用无水乙醇、丙酮、乙醚洗涤,60℃真空干燥,得棕色卷柏多糖;多糖用适量水加热溶解后,分别用30%、50%乙醇分级醇沉,得到30%、50%醇沉多糖。使用时用MEM培养液配制成10 g/L母液过滤除去滤渣,0.2 μm微孔滤膜过滤除菌,置4℃备用。
利巴韦林注射液(ribavirin,RBW)(国药准字H19993467,批号12121312)为国药集团荣生制药有限公司产品;羟乙基哌嗪乙磺酸缓冲液(HEPES,1 mol/L)、双抗(青霉素1×104U/mL,链霉素1×104μg/mL)和MEM培养液均购自迈晨生物科技公司;胎牛血清(FBS)为兰州百灵生物技术有限公司产品;0.25%胰酶-EDTA和MEM干粉为GIBCO公司产品;甲基纤维素(MC)购自Sigma公司;细胞计数试剂盒(CCK8法)购自DoJoDo公司;病毒RNA提取试剂盒(DP315)和Quant One Step qRT-PCR(Probe)检测试剂盒(KR113)购自天根生化科技(北京)有限公司;引物和探针序列均由上海生工生物工程股份有限公司合成。
CO2细胞培养孵箱、生物安全柜和超净工作台均为Thermo Forma公司产品;mili-Q超纯水系统为Millipore公司产品;倒置显微镜为Olympus公司产品;低温高速离心机为Sigma公司产品;酶标仪(Model 680型)和荧光定量PCR仪(CFX96型)为Bio-Rad公司产品;细胞培养瓶为NUNC公司产品;0.22 μm针式灭菌滤器为PALL公司产品。
1.2 药物对Vero细胞的毒性实验
Vero细胞接种于96孔细胞培养板,待次日细胞生长覆盖率达70%~80%,将30%和50%醇沉卷柏多糖及RBW在0~4000 mg/L范围内分别用含2%FBS的MEM培养液(维持液)稀释至所需浓度后加入细胞,并设空白对照组,每组3个复孔,37℃、5%CO2条件下培养72 h,镜下观察细胞形态变化,并用CCK8法检测药物对Vero细胞的毒性作用。
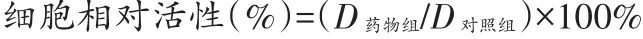
1.3 药物对EV71致Vero细胞病变的影响实验
Vero细胞接种于96孔板,待次日细胞生长覆盖率达70%~80%,用EV71感染细胞(MOI=1),37℃、5%CO2条件下吸附1 h后吸弃病毒稀释液,分别加入含不同浓度药物的维持液,设空白对照组和病毒感染对照组,每组3个复孔,37℃、5%CO2条件下培养72 h后收集细胞上清液于-20℃保存,同时用CCK8法检测细胞活性。

1.4 噬斑法检测药物对培养液中EV71滴度的影响
Vero细胞接种于12孔板,待次日细胞生长覆盖率达100%时,取上一步骤中收集的细胞培养上清液稀释至1/10后感染细胞(400 μL/孔),37℃、5%CO2条件下吸附1 h后吸弃病毒稀释液,加入营养覆盖物(含1%MC、2%FBS、100 U/mL青霉素、100 μg/mL链霉素的10 mmol/L的HEPES缓冲液),每日观察噬斑情况,待噬斑不再增多且直径较大时用4%甲醛溶液固定,1%结晶紫溶液染色。2×培养液的配制方法由本实验室前期实验摸索得到[19]。按下式计算噬斑数:

1.5 50%醇沉卷柏多糖对EV71的直接灭活作用[9]
用病毒稀释液直接稀释50%醇沉卷柏多糖(0、6.25、12.5、25、50和100 mg/L),37℃、5%CO2条件下共同孵育1、3、6 h,用噬斑法测定病毒滴度的变化。
1.6 50%醇沉卷柏多糖不同时间点加药实验[20-21]
Vero细胞接种于12孔板,待次日细胞生长覆盖率达70%~80%,用EV71感染细胞(MOI=10),37℃、5%CO2条件下吸附1 h后吸弃病毒稀释液,换成维持液继续培养,分别在病毒感染的-1、0、1、3、6和9 h加药,设空白对照组和病毒感染对照组,37℃、5%CO2条件下培养12 h,观察CPE并在镜下拍照。
1.7 空斑法检测50%醇沉卷柏多糖对病毒吸附环节的影响
参照文献[21-22]设计50%醇沉卷柏多糖对病毒吸附环节的影响,其作用原理是病毒在4℃时基本上只吸附到细胞上而不穿入细胞内部。Vero细胞接种于12孔板,待次日细胞生长覆盖率达100%时,4℃下放置2 h,病毒稀释后与不同浓度的药物预混,置冰上冷却后接种细胞(400 μL/孔),置4℃继续孵育1 h,用预冷的 PBS(pH7.3)洗 2 次,加入营养覆盖物,37℃、5%CO2条件下培养,噬斑法测定药物对病毒滴度的影响。
1.8 空斑法检测50%醇沉卷柏多糖对病毒进入环节的影响
Vero细胞接种于12孔板,待次日细胞生长覆盖率达100%时,4℃放置2 h以上,病毒稀释后(预先置冰上预冷)接种细胞,继续置4℃孵育1 h,吸弃病毒稀释液,用pH7.3的PBS洗2次,加入不同浓度的药物,于37℃、5%CO2条件下分别孵育1 h,用pH11.0的碱性磷酸盐缓冲液灭活病毒1 min,用pH3.0的酸性磷酸盐缓冲液中和,弃中和液,用pH7.3的PBS洗1次,加入营养覆盖物,37℃、5%CO2条件下培养,噬斑法测定药物对病毒滴度的影响[21-22]。
1.9 实时荧光定量PCR法检测50%醇沉卷柏多糖对病毒复制和释放环节的影响
Vero细胞接种于24孔培养板,待次日细胞生长覆盖率达70%~80%,用EV71感染细胞(MOI=10),37℃、5%CO2条件下吸附1 h后弃病毒稀释液,加入含不同浓度药物(0、6.25、12.5、25、50 和 100 mg/L)的维持液,37℃、5%CO2条件下分别培养6、9和12 h后收集培养液和细胞。参照TIANamp Virus RNA Kit试剂盒操作说明书分别提取培养液和细胞中的RNA,用文献[18]所述引物和探针,按照Quant One Step qRT-PCR(Probe)检测试剂盒操作说明书进行实验。反应体系为20 μL,反应条件为反转录(50℃)30 min,起始模板变性(92℃)3 min。扩增条件:92℃ 10 s,55℃ 20 s,68℃ 20 s,共40个循环。每个样品重复3次,用构建的标准品做标准曲线,将得到的各组病毒RNA的拷贝数进行统计学分析。
1.10 统计学处理
所有实验数据以x±s表示,用SPSS17.0统计学软件进行统计分析。各实验组与对照组样本均数采用单因素方差分析,两两比较采用q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 药物的细胞毒性
CCK8检测结果显示,在0~2000 mg/L浓度范围内,30%和50%醇沉卷柏多糖未显示出显著的毒性作用;而RBW在62.5 mg/L浓度时细胞增殖开始受到抑制,随着浓度的增大,细胞毒性增加(图1)。计算三者对Vero细胞毒性的CC50(半数中毒浓度)分别为>4000、>4000和3908.3±8.15 mg/L。
2.2 不同浓度药物对EV71致Vero细胞病变的影响
将不同浓度的30%和50%醇沉卷柏多糖及RBW加入EV71感染的Vero细胞中,48 h后检测药物对病毒CPE的影响,发现三者对EV71所致CPE抑制率最高分别可达88%、89%和66%(图2)。计算三者的IC50(半数抑制浓度)分别为23.62±2.50、10.43±0.38 和 38.66±4.91 mg/L,SI分别为>169、>384 和101。其中RBW对病毒CPE的抑制作用与文献[23]结果一致。
2.3 药物对Vero细胞培养液中病毒滴度的影响
空斑实验结果显示,6.25~100 mg/L的30%和50%醇沉卷柏多糖均能显著降低培养液中的病毒滴度(P<0.01),并呈现剂量依赖;同等剂量的30%醇沉卷柏多糖抑制病毒滴度效果与RBW相当;同等剂量的50%醇沉卷柏多糖抑制病毒滴度的效果较RBW显著增高(图3)。
2.4 50%醇沉卷柏多糖对EV71的直接灭活作用
设置不同剂量的50%醇沉卷柏多糖与病毒共同孵育1、3、6 h后,噬斑法测定各组的病毒滴度,结果显示各组间无统计学差异(图4)。
2.5 50%醇沉卷柏多糖不同时间点加药对EV71致Vero细胞病变的影响
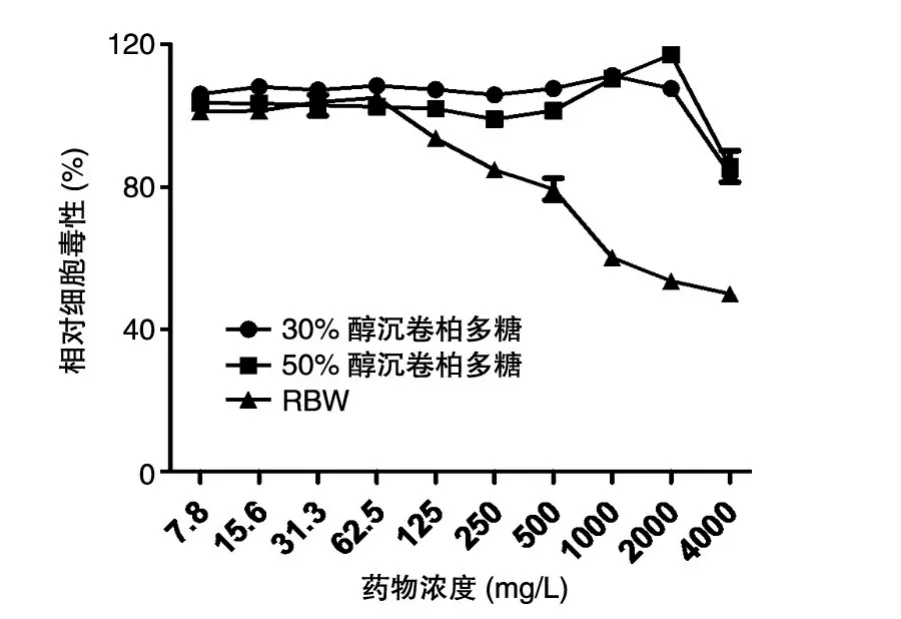
图1 不同浓度药物对Vero细胞的毒性
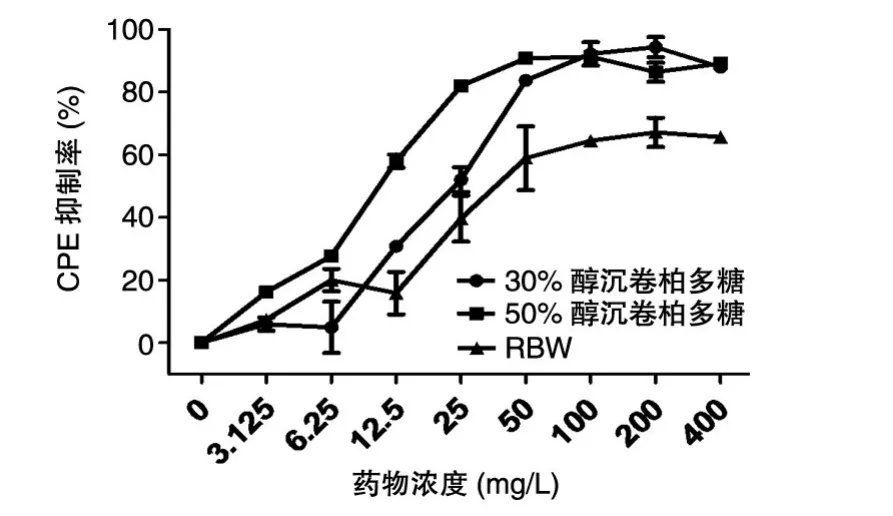
图2 不同浓度药物抑制EV71致Vero细胞的CPE作用
在单复制周期水平上设计不同时间点加药实验,结果显示提前1 h(-1 h)至感染后3 h加药对病毒导致的Vero细胞病变均有抑制作用(图5)。其中-1 h加药和感染后0 h加药(加入病毒的同时加入药物,吸去病毒的同时吸去药物)相当,说明50%醇沉卷柏多糖对EV71感染Vero细胞的预防环节不明显;感染后0和1 h加药明显优于感染后3 h加药,说明50%醇沉卷柏多糖对EV71感染Vero细胞的早期环节(吸附或穿入)有明显作用。感染后6和9 h加药对EV71引起的细胞病变基本无作用,说明50%醇沉卷柏多糖对EV71感染Vero细胞的复制和释放环节基本无影响。不同时间点加药实验只能初步说明药物对EV71感染Vero细胞生活周期的影响,还须进一步验证。
2.6 50%醇沉卷柏多糖对EV71感染Vero细胞吸附和进入环节的影响
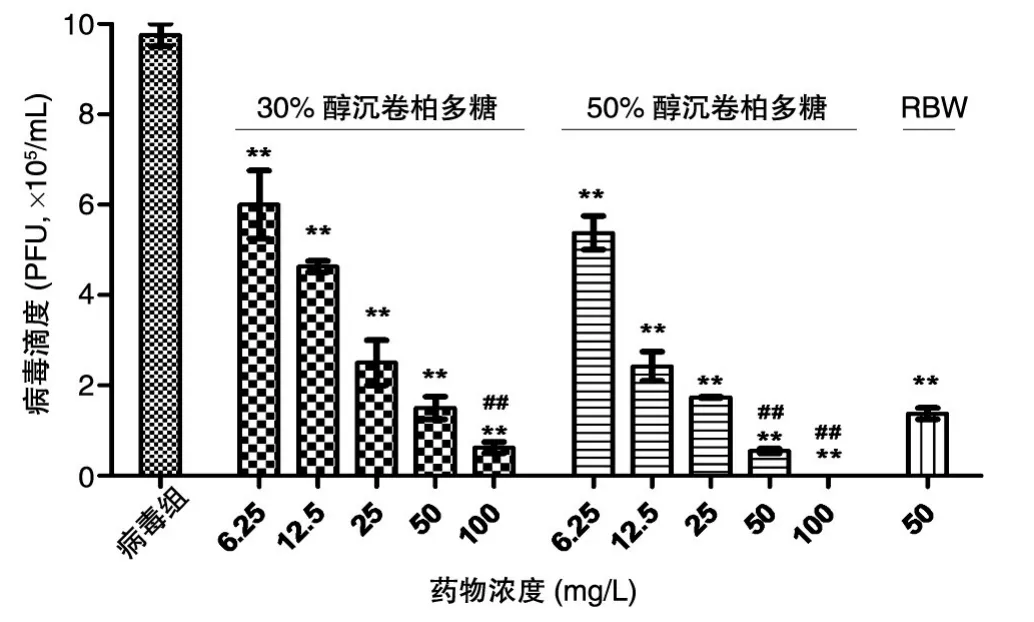
图3 各组培养液上清中的病毒滴度(x±s,n=3)**P<0.01,与病毒感染对照组比较;##P<0.01,与RBW组比较
药物对病毒吸附影响实验结果表明,25、50和100 mg/L剂量的50%醇沉卷柏多糖均能显著降低病毒滴度(P<0.05)(图6A);而药物对病毒进入环节影响实验结果显示与病毒感染对照组对比无显著性差异(图6B)。
2.7 50%醇沉卷柏多糖对EV71复制和释放环节的影响
根据文献[24]设计实验,检测50%醇沉卷柏多糖是否通过抑制EV71的复制和释放环节而具有抗病毒活性。结果显示,与病毒感染对照组相比,各用药组细胞内和细胞外检测攻毒后6、9和12 h病毒RNA拷贝数均无显著性差异,各用药组的病毒RNA拷贝数胞内外比值无显著性差异(图7),说明50%醇沉卷柏多糖对EV71的复制和释放环节无明显作用。
3 讨论
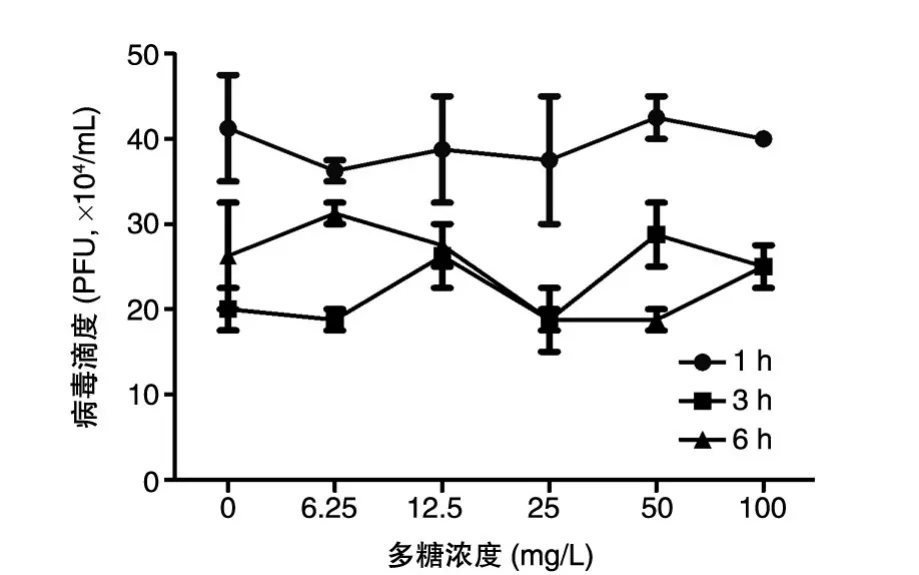
图4 50%醇沉卷柏多糖与EV71共同孵育后测定的病毒滴度

图5 50%醇沉卷柏多糖不同时间点加药对EV71引起Vero细胞病变的抑制作用
本实验室前期研究发现30%和50%醇沉卷柏多糖能够显著抑制EV71导致的RD细胞病变效应,本研究证明了30%和50%醇沉卷柏多糖能够显著抑制EV71导致的Vero细胞病变效应。针对中药多糖类抗病毒作用机制,已见报道的有抑制病毒吸附[25]和增强宿主机体免疫功能[26]。EV71在活细胞内的生活周期约为12 h,其中病毒感染细胞后的前3 h主要是病毒吸附于宿主细胞上并进入细胞,第3~6 h病毒RNA开始大量复制,感染后第9 h病毒RNA拷贝数出现最高峰,感染后第12 h病毒颗粒基本包装完成,进入大量释放环节[20]。病毒感染复数(MOI)值越大,细胞增殖一代的周期相对越短,在较低MOI值的情况下,EV71的增殖动力学曲线相对较平缓[20]。我们根据病毒的生活周期设计实验,探讨卷柏多糖对EV71的直接灭活作用以及对EV71吸附、穿入、复制和释放环节的作用。结果表明,50%醇沉卷柏多糖在体外不具有直接灭活病毒的作用;50%醇沉卷柏多糖浓度(>25 mg/mL)与模型组比可显著抑制EV71感染Vero细胞的吸附环节,对进入环节无影响,对EV71在Vero细胞中的复制和释放环节无显著抑制作用。
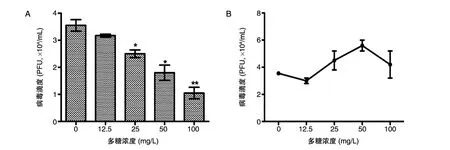
图6 50%醇沉卷柏多糖对病毒吸附(A)和进入环节(B)的影响(x±s,n=3)*P<0.05,**P<0.01,与病毒感染对照组比较
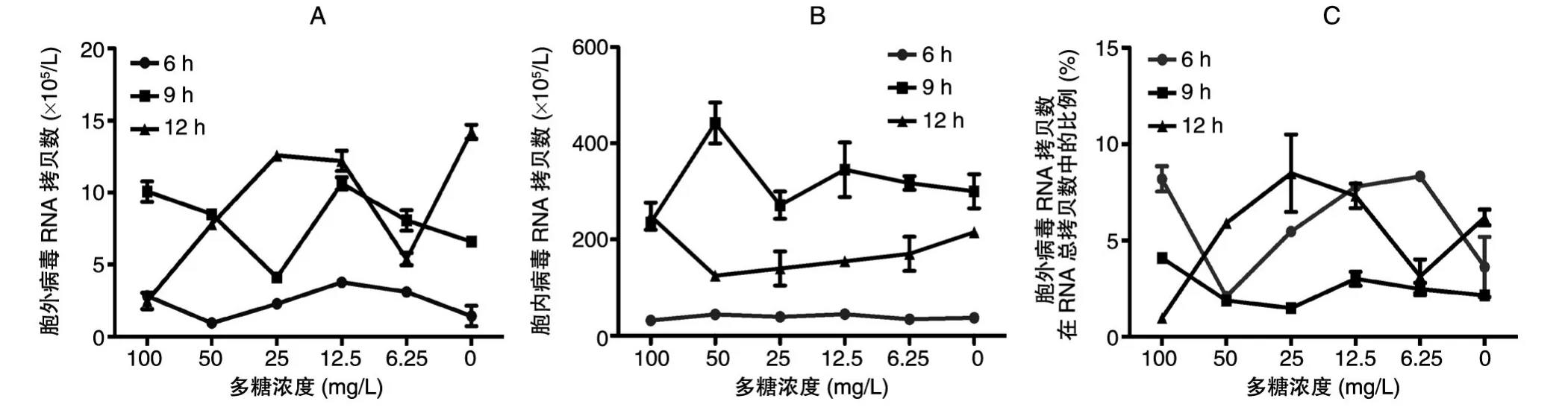
图7 50%醇沉卷柏多糖对EV71复制和释放作用的影响A:培养液中病毒RNA拷贝数;B:细胞内病毒RNA拷贝数;C:培养液中RNA拷贝数占RNA总拷贝数的百分比
以上仅对卷柏多糖抗EV71的体外活性及其作用机制做了初步探索,体内药效学作用研究还未完成。卷柏的有效成分为多糖,如能进一步阐明口服吸收是否会被胃肠道破坏、哪种给药途径最佳等问题,将为临床应用该药或其提取物防治EV71感染性疾病提供实验依据,也可为抗EV71新药的开发提供科学依据。这也是我们进一步研究的方向。
[1] Chi C Z,Sun Q Y,Wang S,et al.Robust antiviral response stoenterovirus 71 infection in human intestinalepithelial cells[J].Virus Res,2013,176:53-60.
[2] 张燕,朱贞,祝双利,等.利巴韦林注射液在细胞水平上抑制EV71病毒复制的初步研究[J].中华实验和临床病理学杂志,2004,23:44-46.
[3] Wang S M,Liu C C.Enterovirus 71:epidemiology,pathogene⁃sis and management[J].Expert Rev Anti Infect Ther,2009,7(6):735-742.
[4] Solomon T,Lewthwaite P,Perera D,et al.Virology,epidemiolo⁃gy,pathogenesis,and control of enterovirus 71[J].Lancet Infect Dis,2010,10(11):778-790.
[5]中华人民共和国卫生部药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:210-211.
[6] Le M H,Do T T,Hoang T H,et al.Toxicity and anticancer effects of an extract from Selaginella tamariscina on a mice model[J].Nat Prod Res,2012,26(12):1130-1134.
[7] Lee J S,Lee M S,Oh W K,et al.Fatty acid synthase inhibi⁃tion by amentoflavone induces apoptosis and antiproliferation in human breast cancer cells[J].Biol Pharm Bull,2009,32(8):1427-1432.
[8] Hsin C H,Wu B C,Chuang C Y,et al.Selaginella tamarisci⁃naextractsuppressesTPA-induced invasion and metastas⁃isthrough inhibition of MMP-9 in human nasopharyngeal carci⁃noma HONE-1 cells[J].BMC Complement Altern Med,2013,13(1):234.
[9] 殷丹,陈科力.江南卷柏提取物的体外抗柯萨奇病毒实验[J].中国医院药学杂志,2009,29(4):262-264.
[10]金楠,陈科力,陈刚,等.卷柏属药用植物提取物体外抗疱疹病毒1型的研究[J].医药导报,2009,28(4):415-418.
[11]Pokharel Y R,Yang J W,Kim J Y,et al.Potent inhibition of the inductions of inducible nitric oxide synthase and cyclo⁃oxygenase-2 by taiwaniaflavone[J].Nitric Oxide,2006,15(3):217-225.
[12]Lee C W,Choi H J,Kim H S,et al.Biflavonoids isolated from Selaginella tamariscina regulate the expression of matrix metalloproteinase in human skin fibroblasts[J].Bioorg Med Chem,2008,16(2):732-738.
[13]Lee J,Choi Y,Woo E R,et al.Isocryptomerin,a novel mem⁃brane-active antifungal compound from Selaginellatamariscina[J].Biochem Biophys Res Commun,2009,379(3):676-680.
[14]Dai Y,But P P,Chu L M,et al.Inhibitory effects of Selagi⁃nella tamariscina on immediate allergic reactions[J].Am J Chin Med,2005,33(6):957-966.
[15]Zheng X K,Zhang L,Wang W W,et al.Anti-diabetic activi⁃ty and potential mechanism of total flavonoids of Selaginella tamariscina(Beauv.)Spring in rats induced by high fat diet and low dose STZ[J].J Ethnopharmacol,2011,137(1):662-668.
[16]Zheng X K,Wang W W,Zhang L,et al.Antihyperlipidaemic and antioxidant effect of the total flavonoids in Sela.ginella tamariscina(Beauv.)Spring in diabetic mice[J].J Pharm Phar⁃macol,2013,65(5):757-766.
[17]王晨静.新型炔酚类化合物selaginellin抗内皮细胞衰老及神经生物学功能研究[D].长沙:中南大学,2010.
[18]韩明明,杨静,高秀梅,等.卷柏多糖对肠道病毒71型复制的体外抑制作用[J].国际药学研究杂志,2013,40(1):58-62.
[19]艾碧琛.甘露消毒丹及其残方体外抗EV71及对EV71感染miR-146a、miR-155,TLR4mRNA表达影响的研究[D].长沙:湖南中医药大学,2013.
[20]齐向云,李康,夏燕平,等.肠道病毒71型在RD细胞和Vero细胞中的增殖动力学特征[J].生物技术通讯,2014,25(3):333-336.
[21]Chang C W,Leu Y L,Horng J T,et al.Water-soluble ex⁃tracts act on enterovirus 71 by inhibiting viral entry[J].Virus⁃es,2012,4:539-556.
[22]李玉环.格尔德霉素的抗病毒作用和抗单纯疤疹病毒1型作用机制的研究[D].北京:中国协和医科大学,1998.
[23]Liu M S,Tao L,Chau S L,et al.Folding fan mode countercurrent chromatography offers fast blind screening for drug dis⁃covery.Case study:finding anti-enterovirus 71 agents from Anemarrhena asphodeloides[J].JChromatogrA,2014,1368:116-124.
[24]Lu J,He Y Q,Yi L N,et al.Viral kinetics of enterovirus 71 in human habdomyosarcoma cells[J].World J Gastroenterol,2011,17(36):4135-4142.
[25]Chiu Y H,Chan Y L,Li T L,et al.Inhibition of Japanese encephalitis virus infection by the sulfated polysaccharide ex⁃tracts from Ulva lactuca[J].Mar Biotechnol(NY),2012,14(4):468-478.
[26]Yang T,Jia M,Zhou S,et al.Antivirus and immune enhance⁃ment activities of sulfated polysaccharide from Angelica sinen⁃sis[J].Int J Biol Macromol,2012,50(3):768-772.

