鸦胆子油乳制剂对宫颈癌Hela细胞的抑制效果及作用机制研究
罗 琦,杨 静
(武汉大学基础医学院,湖北 武汉 430000)
鸦胆子油乳制剂对宫颈癌Hela细胞的抑制效果及作用机制研究
罗 琦,杨 静
(武汉大学基础医学院,湖北 武汉 430000)

目的 探讨鸦胆子油乳制剂对宫颈癌Hela细胞的抑制效果及作用机制。方法 观察不同浓度(5,10 μg/mL)鸦胆子油乳处理Hela细胞后的形态改变;检测不同浓度鸦胆子油乳(2.5,5,10,20,40 μg/mL)处理后对Hela细胞的抑制率,并观察鸦胆子油乳处理浓度分别为10,20 μg/mL时细胞周期的变化情况。结果 鸦胆子油乳处理宫颈癌Hela细胞后出现凋亡小体,且细胞毒作用随时间延长毒性增强;在处理48 h后,研究组的抑制率均>60%,72 h后抑制率均>80%;伴随鸦胆子油乳浓度的增加,G0~G1期细胞比率降低,S期及G2~M期细胞比率明显增加。10 μg/mL和20 μg/mL鸦胆子油乳处理48 h后细胞凋亡率分别为60%与70%。结论 鸦胆子油乳能够明显抑制宫颈癌Hela细胞的增殖,且呈时间依赖性,能够诱导细胞凋亡,且使Hela细胞阻滞于S期。
宫颈癌Hela细胞;鸦胆子油乳;抑制增殖;巴氏染色;细胞凋亡
宫颈癌为女性常见的生殖道恶性肿瘤,手术联合放化疗是临床上常用的有效治疗方法。但大部分放化疗药物均具有较大的毒副作用,给宫颈癌女性带来了严重伤害,故探寻一种毒副作用小的辅助放化疗药物迫在眉睫。鸦胆子油乳提取于苦木科植物鸦胆子成熟果实,其主要富含油酸与亚油酸。鸦胆子油乳对肿瘤细胞生长具有显著的抑制作用,临床上用于配合肿瘤的放化疗过程,具有一定的增效减毒功效[1-3]。本研究观察了鸦胆子油乳处理宫颈癌Hela细胞后的形态及生长周期等的变化情况,旨在探讨鸦胆子油乳对Hela细胞的抑制效果及机制,为该药物进一步应用于宫颈癌的临床治疗提供科学的理论依据。
1 实验资料
1.1试剂与药品 鸦胆子油乳购自沈阳药大药业有限责任公司, 胰蛋白酶与小牛血清均由沈阳宝信生物制品有限公司提供,宫颈癌Hela细胞株为本实验室长期保存,3-(4,5-二甲基噻-2)-2,5-二苯基四氮唑(MTT)、碘化丙啶(PI)、RPMI 1640培养液与二甲基亚砜(DMSO)等均购自美国西格玛公司。
1.2Hela细胞培养 将冻存的Hela细胞进行复苏,使用含10%小牛血清的RPMI1640培养液进行培养,设定温度为37 ℃,将其置于CO2饱和湿度为5%的培养箱中,配置含有0.02%乙二胺四乙酸(EDTA)的0.25%胰酶进行消化并传代培养。
1.3鸦胆子油乳处理Hela细胞后的形态观查 将传代24 h且生长状态良好的细胞分为对照组、研究一组与研究二组,对照组不加鸦胆子油乳,研究一组与研究二组中分别添加5,10 μg/mL的鸦胆子油乳。使用倒置显微镜密切观察Hela细胞的生长状况。处理48 h后,分别收集3组Hela细胞,使用甲醛进行固定,用Harris苏木精染液、EA36染液、橙黄-G6染液及梯度浓度乙醇进行巴氏染色,查看Hela细胞的形态变化情况。
1.4MTT法分析鸦胆子油乳作用于Hela细胞的效果 设计5个不同浓度的鸦胆子油乳(2.5,5,10,20,40 μg/mL)的研究组与阴性对照组,阴性对照组不加鸦胆子油乳。通过MTT法对细胞增殖抑制率进行检测。将处于对数生长期的细胞移至96孔板中,各孔细胞液均为200 μL,细胞数量约1×104个,设定温度为37 ℃,浓度为5%的CO2饱和湿度下继续培养24 h。再将药物分别加进研究孔内,设定6个复孔,进行24,48及72 h培养,各孔添加20 μL的MTT,孵育4 h后,弃去上清液,加入150 μL DMSO后匀速振荡10 min,在波长为490 nm处使用酶标仪测定光密度(D)。细胞生长抑制率(%)=(1-研究组D/对照组D)×100%。
1.5鸦胆子油乳处理Hela细胞后的细胞周期检查 将传代24 h后生长状态良好的Hela细胞分成正常细胞对照组与研究1组与研究2组。对照组中不添加鸦胆子油乳,研究1组、研究2组中分别加入质量浓度为10,20 μg/mL的鸦胆子油乳。再进行孵育48 h,按时取不同处理的Hela细胞,分析单细胞悬液,计数细胞数在1×109L-1以上,使用PBS彻底清洗后进行离心,再加入-20 ℃预冷后的无水乙醇进行30 min固定。经离心后将乙醇弃去,再用PBS进行洗涤,再加入400 μL的碘化丙啶溶液,4 ℃处理20 min后使用流式细胞仪进行检测。

2 结 果
2.1鸦胆子油乳处理后Hela细胞的形态学观察 鸦胆子油乳浓度与细胞生长密度成反比,正常的多边形细胞中异形细胞数目变多。鸦胆子油乳处理12 h后,细胞体积缩小,生长密度降低,生长受到抑制,皱缩细胞数目增多,上述现象研究二组比研究一组更为明显。随着处理时间继续延长,大量无规则且膨大细胞从瓶壁上脱落最终降解为细胞碎片。巴氏法染色后发现对照组的细胞轮廓清晰,胞膜边界完整,各细胞间的结构十分紧密,见图1。研究一组的Hela细胞体积缩小并皱缩,细胞间基本无连接, 核为溶解状态,染色质朝向核膜聚集并显示出凝块状态,部分细胞呈发泡状的凋亡小体。研究二组同样可见染色质浓缩及边缘化,可清晰显示出染色质固缩于核膜周边,出现发泡状态的凋亡小体,见图2。

图1 对照组Hela细胞形态(400×)
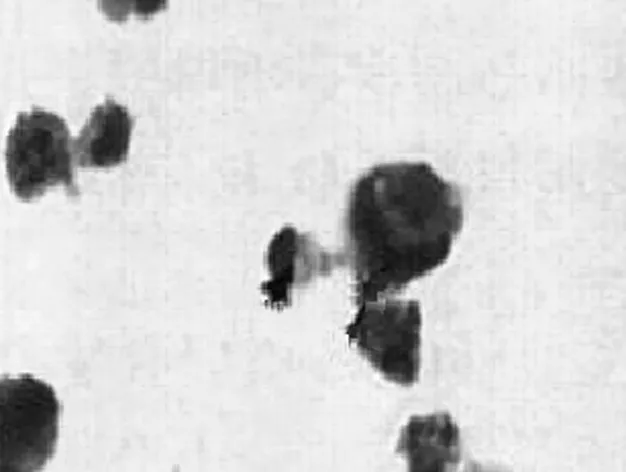
图2 研究组Hela细胞形态(400×)
2.2鸦胆子油乳处理Hela细胞后抑制细胞增殖情况 相同浓度的鸦胆子油乳处理Hela细胞24,48,72 h后,细胞抑制率比较差异有统计学意义(P均<0.01)。相同时间点,不同浓度间的细胞抑制率略微增高,但差异无统计学意义。鸦胆子油乳处理Hela细胞后的细胞毒作用随时间延长毒性增强,在处理48 h后研究组的抑制率均>60%,72 h后抑制率均>80%。见表1。

表1 鸦胆子油乳处理Hela细胞后抑制细胞增殖情况
2.3鸦胆子油乳处理Hela细胞后对细胞周期影响 伴随鸦胆子油乳浓度的增加,G0~G1期细胞比率降低,S期和G2~M期细胞比率明显增加。研究1组和研究2组细胞凋亡率分别为60%与70%。见表2。
3 讨 论
宫颈癌是临床常见的恶性肿瘤,近年来全球宫颈癌的发病率与病死率呈现出日益增长之势,特别是处于生育期的女性所占比例最大, 据统计,10%~15%的宫颈癌发生在育龄阶段[4]。在欧洲国家的一些女性,在生育前即被诊断出患有宫颈癌,而有些手术措施不能保留生育能力[5-6]。

表2 鸦胆子油乳处理后对细胞周期的影响 %
注:①与0 μg/mL浓度比较,P<0.05。
鸦胆子油乳主要由油酸与亚油酸组成,在抗肿瘤与增强机体免疫力方面效果显著[7]。鸦胆子油乳与肿瘤的放化疗联合使用已应用于肝癌[8]、胰腺癌[9]、肺癌[10]、脑瘤[11]、食管癌[12]等各类恶性肿瘤;还能够治疗由HPV所导致的寻常疣、扁平疣、尖锐湿疣以及喉乳头状瘤等,但是将该药应用于宫颈癌治疗则鲜有报道。本研究旨在研究鸦胆子油乳对宫颈癌Hela细胞的抑制效果,结果显示鸦胆子油乳在体外可以显著抑制宫颈癌Hela细胞的增殖,而且鸦胆子油乳处理Hela细胞后的细胞毒作用随时间延长毒性随之增强,在处理48 h后研究组的抑制率均>60%,72 h后抑制率均>80%。
细胞凋亡出现异常与肿瘤的发生及发展密切相关,大多数化疗药物都是通过诱导肿瘤细胞凋亡来发挥作用的。王芳等[13]的研究显示鸦胆子油乳可以诱导HL-60肿瘤细胞发生凋亡。本研究结果显示,鸦胆子油乳处理Hela细胞后,细胞核固缩,染色质出现浓缩聚集在核膜下,呈半月状,最终形成凋亡小体。而且通过流式细胞仪检测表明,鸦胆子油乳在10 μg/mL和20 μg/mL浓度下对Hela细胞均出现凋亡峰。上述结果均证实鸦胆子油乳抑制Hela细胞增殖的作用机制可能是诱导Hela细胞进入了凋亡程序。
细胞周期中存在几个检查点即调定点,其中以G1~S期转换与G2~M期转换最为关键。因为基因组的稳定性差,肿瘤细胞可以通过上述2个关键的检查点,故而体现出细胞周期运行失控的特点,最终导致肿瘤细胞无限增殖以及细胞分化受阻。有报道显示,一般G2~M检查点被认为对肿瘤治疗的敏感性起决定性作用[14]。本研究应用鸦胆子油乳处理Hela细胞,使其细胞周期分布发生变化,伴随药物浓度的不断增加,S期与G2~M期细胞数量也显著增加,G0~G1期细胞数明显减少,表明鸦胆子油乳阻滞S期转为G2~M期,使肿瘤细胞分裂能力下降,抑制肿瘤细胞的增殖。总之,鸦胆子油乳诱导细胞凋亡并将其阻滞于S期,能够有效抑制宫颈癌Hela细胞的增殖。
[1] 吴国兰,申屠建中,刘健,等. 鸦胆子油乳联合化疗治疗非小细胞肺癌疗效和安全性的Meta分析[J]. 中国临床药理学杂志,2013,29(1):70-72
[2] 韩凤娟,蔡冬燕,吴效科,等. 鸦胆子油乳抗肿瘤机制的研究进展[J]. 现代肿瘤医学,2013,21(3):669-671
[3] 徐月娟,邱少敏. 鸦胆子油联合放射治疗骨转移癌的临床疗效观察[J]. 中药药理与临床,2012,28(1):171-173
[4] 智艳芳,李肖甫,邱翠,等. 液基薄层细胞学联合高危型人乳头状瘤病毒检测在宫颈癌前病变筛查中的应用[J]. 新乡医学院学报,2014,31(4):264-268
[5] Anttila A,Pukkla E,Sderman B,et al. Effect of organized screening on cervical cancer incidence and mortality in Finland,1963-1995: recent increase in cervical cancer incidence[J]. Int J Cancer,1999,83(1):59-65
[6] Tibaldi C,Ricci S,Russo F,et al. Increased dose-intensity of gemcitabine in advanced non small cell lung cancer (NSCLC): a multicenter phase?study in elderly patients from the/polmone toscano group0(POLTO)[J]. LungCancer,2005,48(1):121-127
[7] Quoix E,Breton JL,Ducolone A,et al. First line chemotherapy with gemcitabine in advanced non-small cell lung cancer elderly patients:a randomized phase study of 3-week versus 4-week schedule[J]. Lung Cancer,2005,47(3):405-412
[8] 李刚,刘良忠,熊德明,等. 三维适型放疗联合鸦胆子油乳介入治疗原发性肝癌的临床研究[J]. 重庆医学,2012,41(3):238-241
[9] 徐红,高远,王庆才,等. 应用HIFU联合中药鸦胆子乳剂扶正抗癌治疗晚期胰腺癌[J]. 苏州大学学报:医学版,2006,6(6):1027-1029
[10] 胡梦玮,姚扬伟,王海琴. 鸦胆子油乳剂对43例肺癌化疗患者疗效及免疫功能的影响[J]. 实用肿瘤杂志,2011,26(3):306-308
[11] 龙新兵,韩富,谢才军,等. 鸦胆子油乳针辅助治疗脑转移癌32例[J]. 广东医学,2007,28(7):1175-1176
[12] 曾旭东,何源萍. 微波配合鸦胆子油治疗成人喉乳头状瘤的临床体会[J]. 中国耳鼻咽喉颅底外科杂志,2005,11(5):362-363
[13] 王芳,曹玉,刘红岩,等. 鸦胆子油乳诱导HL-60细胞凋亡的研究[J]. 中国中药杂志,2003,28(4):760-762
[14] Qiu R,Chen J,Sima J,et al. NS398 induces apoptosis in non-small cell lung cancer cells[J]. J Cancer Res Clin Oncol,2012,138(1):119-124
Study on the inhibition effect and the mechanism of brucea javanica oil emulsion preparation in cervical cancer Hela cells
LUO Qi, YANG Jing
(Wuhan University School of Basic Medicine Sciences, Wuhan 430000, Hubei, China)
Objective It is to observe the inhibitory effect of Brucea javanica oil emulsion preparation on cervical cancer Hela cells, and approach its mechanism. Methods The morphology change of Hela cell after treated with different concentrations (5, 10 μg/mL) of brucea javanica oil was observed. The inhibition rate of Hela cells after treatment by different concentrations (2. 5, 5, 10, 20, 40 μg/mL) of brucea javanica oil emulsion on Hela cell were detected, and the change of cell cycle of Hela cell treated by 10 and 20 μg/mL of brucea javanica oil emulsion was observed. Results Apoptotic bodies was founder after treatment of brucea javanica oil emulsion in cervical cancer Hela cells, and the cytotoxic effect was increased with prolonged time; each group had more than 48% of inhibition rate after treated 48-hour,, and more than 80% after 72-hour; with the increase of brucea javanica oil emulsion concentration, the ratio of G0to G1phase cells was decreased, S phase and G2to M phase cell ratio were increased significantly. The cell apoptosis rate after treated with 10 and 20 μg/mL of brucea javanica oil emulsion for 48-hour were 60% and 70%. Conclusion Brucea javanica oil emulsion can obviously inhibit the proliferation of cervical cancer Hela cells, and was time dependent, it can induce cell apoptosis, and arrest the Hela cell cycle in S phase.
cervical carcinoma Hela cell; brucea javanica; proliferation inhibition; Papanicolaou staining; cell apoptosis
罗琦,女,主管药师,研究方向为新药研究与评价、抗肿瘤药物药理和药物毒理学。
10.3969/j.issn.1008-8849.2015.06.002
R965
A
1008-8849(2015)06-0574-03
2014-09-01

