野艾蒿提取物对肝癌细胞系HepG2增殖的影响
张启梅,卢东东
(1. 青海省湟中县第二人民医院,青海 湟中 811600;2. 广西柳州市工人医院,广西 柳州 545000)
野艾蒿提取物对肝癌细胞系HepG2增殖的影响
张启梅1,卢东东2
(1. 青海省湟中县第二人民医院,青海 湟中 811600;2. 广西柳州市工人医院,广西 柳州 545000)

目的 探讨野艾蒿提取物对肝癌细胞系HepG2增殖的影响及对肝癌细胞系HepG2细胞内Bcl-2、Bax及Caspase-3基因表达的影响。方法 给予不同浓度的野艾蒿提取物(0,200,400,800 μg/mL)处理肝癌细胞系HepG2 24,48,72 h,采用MTT法检测不同浓度的野艾蒿提取物对肝癌HepG2细胞增殖的影响;用RT-PCR法检测肝癌细胞HepG2中Bax、Bcl-2以及Caspases-3基因的表达情况。结果 给予野艾蒿提取物400,800 μg/mL处理72 h后,Bax表达水平明显低于0 μg/mL浓度(P<0.05);给予野艾蒿提取物800 μg/mL处理24,48,72 h后,Bcl-2、Caspases-3基因表达水平均明显低于0 μg/mL浓度(P均<0.05)。结论 野艾蒿提取物对肝癌细胞系HepG2的增殖有一定的抑制作用,其机制是野艾蒿提取物可抑制Bcl-2基因表达,上调Bax、Caspases-3基因的表达。
野艾蒿提取物;肝癌细胞;增殖
肝细胞癌(Hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,也是导致人群死亡的主要原因之一,尽管其诊断及治疗方法仍在不断的改进完善,但其发病率和病死率仍表现为逐渐增加的趋势,这一趋势在亚洲国家尤为明显[1-2]。目前一些抗癌药物在治疗肝癌患者的同时也带来了其他一些不良反应,故寻求新的治疗靶点是目前防治肝细胞癌的重点,也是研究的热点之一。野艾蒿为多年生草本植物,有艾叶、野艾之称,而在广西多称之为苦艾,其在全国大部分地区均有分布,是传统的食物及药用植物。张璐敏等[3]研究提示野艾蒿具有抑制Hela癌细胞增殖的作用,提示野艾蒿对细胞增殖凋亡具有一定的影响。但野艾蒿对肝癌细胞HepG2的影响目前尚未明确,本课题拟通过给予不同浓度的野艾蒿提取物处理体外培养的肝癌细胞系HepG2,以了解野艾蒿提取物对肝癌细胞增殖的影响,为野艾蒿的开发利用提供一定的实验依据。
1 实验资料
1.1细胞株与药物 肝癌细胞系HepG2购自中国科学院上海生命科学研究所;野艾蒿采于广西柳州。
1.2主要试剂、耗材与仪器 DMEM培养基(美国Gibco公司);96孔板(美国Corning公司);谷氨酰胺(美国Sigma公司);胰蛋白酶、噻唑蓝(MTT)、二甲基亚砜(DMSO)、新生小牛血清(购自北京久峰润达生物技术有限公司);总RNA提取试剂盒(北京久峰润达生物技术有限公司);cDNA第一链合成试剂盒、Taq DNA聚合酶(北京天恩泽生物技术有限公司);Bcl-2、Bax、Caspase-3及GAPDH引物(上海生物工程有限公司合成)。酶联免疫检测仪(美国Bio-Rad公司),低温超速离心机(德国Eppendorf公司),凝胶成像系统(美国Bio-Rad公司),倒置显微镜(日本Olympus公司),电泳仪(北京六一仪器厂),冷冻干燥仪(北京博医康仪器公司),二氧化碳培养箱(日本SANY公司)。
1.3方法
1.3.1野艾蒿提取物的制备 新鲜野艾蒿叶100 g浸入800 mL 95%乙醇溶液中,使用索氏提取器回流提取8 h,蒸馏液旋蒸浓缩后冰冻干燥;将干燥药物粉末溶于二甲基亚砜(DMSO),使用蒸馏水分别配置成0,200,400,800 μg/mL浓度的溶液,使用0.22 μm过滤器过滤后备用。
1.3.2细胞培养 肝癌细胞系HepG2在含10%新生小牛血清的RPMI1640(含20 mmol/L Hepes,100 mol/mL青霉素/链霉素)培养液中培养,使用贴壁细胞传代方法,2~3 d传代1次。在倒置显微镜下观察细胞生长情况。
1.3.3MTT细胞毒性试验 取对数生长期的肝癌细胞系HepG2细胞悬液,以每孔1 000~10 000个细胞接种于96孔培养板,每孔体积200 μL,分为药物组和对照组,药物组加入不同浓度的野艾蒿提取物(每一浓度设6个复孔),处理24,48,72 h后,每孔加入5% MTT 20 μL,继续孵育4 h后终止培养,小心吸弃孔内培养上清液,每孔加200 μL DMSO,振荡10 min,在490 nm波长处测定各孔吸光值(OD),记录结果。细胞存活率计算公式:细胞存活率=(药物组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.4RT-PCR检测目的基因表达情况 所使用的引物及其序列见表1。使用RNA快速提取试剂盒提取肝癌细胞系HepG2中总RNA,取1.0 μg总RNA,逆转录成cDNA,取1 μL逆转录产物行PCR反应。反应条件:94 ℃预变性4 min,94 ℃变性30 s,58~62 ℃退火45 s(不同引物的退火温度略有不同),72 ℃延伸1 min,72 ℃最终延伸10 min,共35次循环。PCR反应结束后取2 μL反应产物+10 μL 6×Loading Buffer在1.7%琼脂糖凝胶中电泳,电泳结束后在凝胶成像系统下拍照,用Image J软件分析各条带灰度值。

表1 引物名及其序列

2 结 果
2.1不同浓度野艾蒿提取物对肝癌细胞系HepG2增殖的影响 给予200 μg/mL野艾蒿提取物及400 μg/mL处理72 h后,肝癌细胞系HepG2细胞存活率均明显低于24 h时(P均<0.05);给予800 μg/mL野艾蒿提取物处理48 h、72 h后,肝癌细胞系HepG2细胞存活率明显低于24 h时(P均<0.05)。见表2。
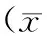
表2 不同浓度野艾蒿提取物对细胞存活率影响±s,%)
注:①与同一时点0 μg/mL比较,P<0.05;②与同一药物浓度24 h比较,P<0.05。
2.2不同浓度野艾蒿提取物对肝癌细胞系HepG2中Bcl-2、Bax及Caspase-3基因表达的影响 给予野艾蒿提取物400,800 μg/mL处理72 h后,Bax表达水平明显低于0 μg/mL浓度(P<0.05);给予野艾蒿提取物800 μg/mL处理48,72 h后,Bax表达水平明显低于24 h时(P均<0.05)。给予野艾蒿提取物800 μg/mL处理24,48,72 h后,Bcl-2和Caspases-3基因表达水平均明显低于0 μg/mL浓度(P均<0.05);给予野艾蒿提取物800 μg/mL处理72 h后,Bcl-2和Caspases-3基因表达水平均明显低于24 h时(P均<0.05);给予野艾蒿提取物400 μg/mL处理48,72 h后,Caspases-3基因表达水平明显低于0 μg/mL浓度(P均<0.05)。见表3~5及图1~3。
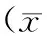
表3 不同时间及药物浓度处理后Bax表达灰度值±s)
注:①与同一时点0 μg/mL组比较,P<0.05;②与同一药物浓度24 h时比较,P<0.05。
3 讨 论
尽管遗传事件在肝细胞癌的发生和进展过程中的作用尚未十分明确,但目前的相关研究表明这一过程中至少涉及3种致癌途径:p53、视网膜母细胞瘤肿瘤抑制蛋白 (Rb)和Wnt/β-连环蛋白(Wnt/β-catenin )信号通路[4]。在正常情况下,Beclin-1是被一个复杂的相互抑制的Bcl-2/Bcl-xL途径所抑制的,而一旦p53绑定到Bcl-2时,被抑制的Beclin-1功能即可得到解放,从而导致了细胞死亡[5]。由Bcl-2和Bax介导的细胞凋亡作用已被大量研究所证实。
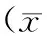
表4 不同时间及药物浓度处理后Bcl-2表达灰度值±s)
注:①与同一时点0 μg/mL组比较,P<0.05;②与同一药物浓度24 h时比较,P<0.05。
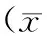
表5 不同时间及药物浓度处理后Caspases-3基因表达灰度值±s)
注:①与同一时点0 μg/mL组比较,P<0.05;②与同一药物浓度24 h时比较,P<0.05。

图1 肝癌细胞系HepG2中Bax基因的表达情况

图2 肝癌细胞系HepG2中Bcl-2基因的表达情况
Bcl-2和Bax是Bcl-2家族中2个调节细胞凋亡的关键因子,分别在抗细胞凋亡和促细胞凋亡过程中有重要的作用[6]。Bcl-2是一种位于线粒体外膜的抗凋亡因子,而Bax是一种位于线粒体基质的促凋亡因子,二者通过控制蛋白酶和核酸酶的活性而发挥调节凋亡作用,而Bcl-2对抗Bax的作用主要是通过抑制线粒体通透性转换孔的开放来实现的[7-8]。同时,有研究提出,细胞凋亡的敏感性是由Bcl-2/Bax的比率来决定的,通过细胞线粒体来实现细胞凋亡的调控也是细胞凋亡的关键因素[9]。高表达的Bcl-2细胞凋亡率相应降低,而高表达的Bax细胞凋亡率相应升高。近年来Bcl-2基因被认为是直接或者间接设计抗癌药物的靶点[10]。而本实验也表明野艾蒿提取物对Bcl-2基因有一定的抑制作用,通过Bcl-2抗凋亡作用的抑制,从而导致细胞增殖受到影响,表现在给予800 μg/mL野艾蒿提取物处理72 h后,肝癌细胞HepG2细胞存活率明显低于0 μg/mL浓度。
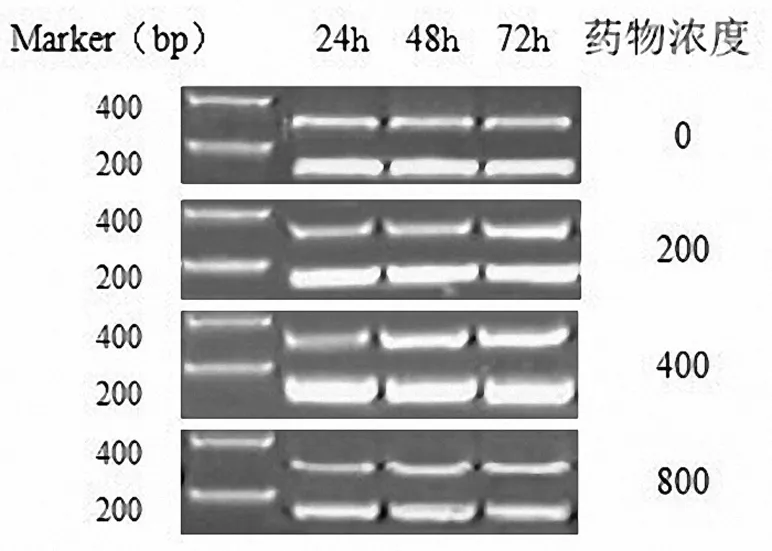
图3 肝癌细胞系HepG2中Caspases-3基因的表达情况
细胞凋亡的主要递质是半胱氨酸天冬蛋白酶家族(Caspases)的半胱氨酸蛋白水解酶类[11]。Degterve等[12]指出细胞凋亡诱导途径包括复杂的感应信号以及Caspases的激活,在线粒体凋亡通路中,这一复杂的级联反应包括了细胞色素C的释放以及结合凋亡蛋白酶激活因子-1(Apaf-1)、ATP,然后激活前体Caspases-9诱导凋亡小体的形成,而最后的细胞凋亡则是由Caspases-3的激活来实现的[13],在这一过程中,Caspases-3是一个重要的关键因子,Caspase-3最终的激活诱导了细胞凋亡。
本实验结果显示,野艾蒿对肝癌细胞系HepG2细胞的增殖有一定的影响,并在细胞凋亡过程中能上调促凋亡基因Bax和Caspases基因的表达,并抑制了抑制凋亡基因Bcl-2的表达,提示野艾蒿提取物可调节Bcl-2和Bax的表达,使Bcl-2/Bax比率发生改变,促进了HepG2细胞的凋亡,同时通过参与调节细胞凋亡级联反应,促进Caspases-3的表达,导致HepG2细胞凋亡的发生,而这种作用与野艾蒿提取物的药物浓度有一定关联,在野艾蒿提取物浓度升高时这种作用较为明显。张璐敏等[13]的相关实验结果也证实了不同浓度的野艾蒿提取物对Hela癌细胞可发挥诱导凋亡和坏死的作用,与本实验的结果一致。但是野艾蒿作为中草药,其成分较为复杂,提取物中含有多种复合物成分,故野艾蒿中对细胞增殖有影响的具体有效成分及其影响细胞增殖的具体机制仍有待进一步实验加以明确。
[1] Jemal A,Bray F,Center MM,et al. Global cancerstatistics[J]. CA Cancer J Clin,2011,61(2):69-90
[2] Forner A,Llovet JM,Bruix J. Hepatocellular carcinoma[J]. Lancet,2012,379(9822):1245-1255[3] 张璐敏,吕学维,邵邻相,等. 野艾蒿挥发油对HeLa癌细胞形态与结构的影响[J]. 广西植物,2014,34(3):393-397
[4] Buendia MA. Genetics of hepatocellular carcinoma[J]. Cancer Biol,2000,10(3):185-200
[5] Lorin S,Pierron G,Ryan KM,et al. Evidence for the interplay between JNK and p53-DRAM signalling pathways in the regulation of autophagy[J]. Autophagy,2010,6(1):153-154
[6] Kanthan R,Seger JL,Diude A. Maliggnant mixed Mullerian tumors of the uterus: histopathological evaluation of cell cycle and apototic regulatory proteins[J]. World J Surg Oncol,2010(8):60
[7] Ola MS,Nawaz M,Ahsan H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J]. Mol Cell Biochem,2011,351(1/2):41-58
[8] Reed JC. Proapoptotic multidomain Bcl-2/Bax-family proteins: mechanisms,physiological roles,and therapeutic opportunities[J]. Cell Death Differ,2006,13(8):1378-1386
[9] Zhao LW,Zhong XH,Yang SY,et al. Inotodiol inhabits proliferation and induces apoptosis through modulating expression of cyclinE, p27,bcl-2, and bax in human cervical cancer heLa cells[J]. Asian Pac J Cancer Prev,2014,15(7):3195-3199
[10] Burmakin M,Shi Y,Hedström E,et al. Dual targeting of wild type and mutant p53 by small molecule RITA results in the inhibition of N-Myc and key survival oncogenes and kills neuroblastoma cells in vivo and in vitro[J]. Clinical Cancer Research,2013,19(18):5092-5103
[11] Petrucci E,Pasquini L,Petronelli A,et al. A small molecule Smac mimic potentiates TRAIL-mediated cell death of ovarian cancer cell[J]. Gynecol Oncol,2007,105(2):481-492
[12] Degterve A,Boyce M,Yuan J. A decade of caspases[J]. Onco-gene,2003,22(53):8543-8547
[13] Wang G,Jiang MY,Meng Y,et al. Cellular mechanisms of a new pyrazinone compound that induces apoptosis in SKOV-3 cells[J]. Asian Pac J Cancer Prev,2014,15(2):797-802
Effect of extractive from Artemisia lavandulaefolia DC on hepatocelular carcinoma HepG2 cells proliferation
ZHANG Qimei1, LU Dongdong2
(1. The Second People’s Hospital of Huangzhong County, Huangzhong 811600, Qinghai, China; 2. The Worker’s Hospital of Liuzhou, Liuzhou 545000,Guangxi, China)
Objective It is to approach the influence of extractive from Artemisia lavandulaefolia DC on hepatocelular carcinoma HepG2 cells proliferation and the expression of Bax, Bcl-2, Caspases-3. Methods The HepG2 cells were treated with different concentrations (0, 200, 400, 800 μg/mL) of the extractive from Artemisia lavandulaefolia DC for 24, 48 and 78 hours; then the influence on cell proliferation of different concentrations of Artemisia lavandulaefolia DC were detected by MTT; the expression of Bax, Bcl-2, Caspases-3 gene in HepG2 cells were detected by RT-PCR. Results After treated with 400, 800 μg/mL of extractive form Artemisia lavandulaefolia DC for 72 hours, the expression of Bax gene was higher than 0 μg/mL group significantly (P<0.05). After treated with 800 μg/mL of Artemisia lavandulaefolia DC for 24, 48 and 72 hours, the expression of Bcl-2 and Caspases-3 gene were lower than 0 μg/mL group (allP<0.05). Conclusion The extractive of Artemisia lavandulaefolia DC have certain inhibitory effect on the proliferation of hepatoma HepG2 cells, the mechanism is to inhibit the expression of Bcl-2 and up-regulation the expression of Bax, Caspasese-3.
Artemisia lavandulaefolia DC; hepatoma carcinoma cell; proliferation
张启梅,女,主治医师,主要从事临床内科工作。
10.3969/j.issn.1008-8849.2015.06.005
R965
A
1008-8849(2015)06-0583-04
2014-09-01

