乳腺胶原小体病与原发乳腺腺样囊性癌的诊断与鉴别诊断
宋秀平,王士娜,刘爽,王翠芳
(1.新民市人民医院病理科,辽宁 新民 110300;2.沈阳医学院附属中心医院病理科)
乳腺胶原小体病是一种发生于乳腺终末导管小叶单位的良性病变,由Clement等[1]1987年首先描述,常伴随于乳腺其它良、恶性病变,故多在镜下偶然被发现。因其镜下显示的筛孔状结构与筛状型乳腺腺样囊性癌非常相似,在病理诊断特别是冰冻诊断中非常困难,故本文分别对乳腺胶原小体病与筛状型乳腺腺样囊性癌的形态和免疫组化特点进行比较和鉴别,并结合文献进行分析和讨论,以提高病理医师特别是年轻病理医师对此两种病变的认识,避免误诊。
1 材料与方法
1.1 材料 从新民市人民医院病理科和沈阳医学院附属中心医院病理科的乳腺诊断病例中,挑选出乳腺胶原小体病和原发筛孔型乳腺腺样囊性癌标本各2例。
1.2 方法 标本均经10%甲醛固定,常规石蜡包埋,HE 和免疫组化染色。免疫组化采用SP 法,由罗氏全自动免疫组化染色系统完成,一抗均为即用型单克隆抗体,包括CK5/6、CKH、P63、SMA、Vim、ER、PR、Ki67。试剂均购于福州迈新生物技术开发有限公司,操作按产品说明书进行,使用日本Olympus BX41 显微镜。
2 结果
2.1 镜检 镜下乳腺胶原小体病中腺管明显扩张,上皮增生,呈大小相对一致的圆形或卵圆形筛孔,孔中有界限清楚无细胞性的球形嗜酸性或双嗜性小体,有的呈基膜样;而原发筛状型乳腺腺样囊性癌内也可见到与之相似的筛状结构,且两者筛孔内均可见到胶原球样物见图1、图2。
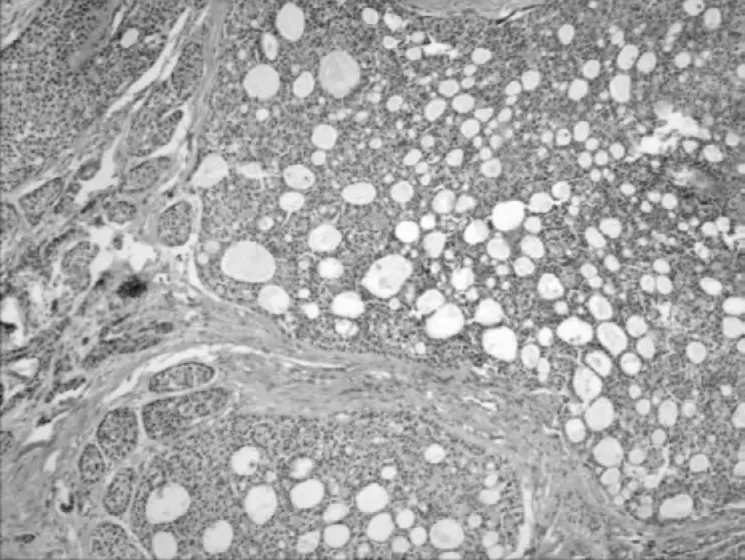
图1 乳腺腺样囊性癌的筛网状结构(HE 染色,×100)
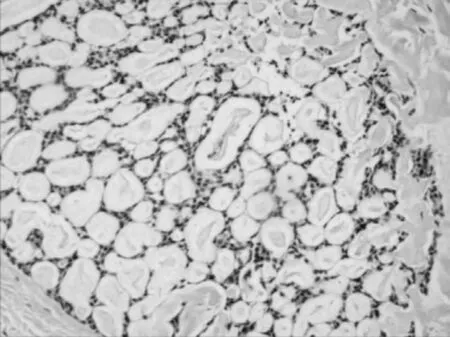
图2 乳腺胶原小体病的筛网状结构(HE 染色,×100)
2.2 免疫组化及特殊染色
2.2.1 免疫组化 在胶原小体病中,CK5/6、P63、SMA 及CKH 均显示在筛状结构周边有完整的肌上皮细胞,Vimentin 腺管外层细胞及纤维间质细胞阳性,瘤细胞S-100 (-),Ki67 (<5% +);乳腺腺样囊性癌中CK5/6 (-),P63、SMA 及CKH 灶状阳性,说明肌上皮不连续或部分缺失,Vim 纤维性间质(+),癌细胞S-100 (+),Ki67(50% +)。激素受体ER、PR 在乳腺胶原小体病灶状细胞核阳性,在乳腺腺样囊性癌中均为阴性表达。2 种病变CK5/6 及Ki67 表达见图3~6。
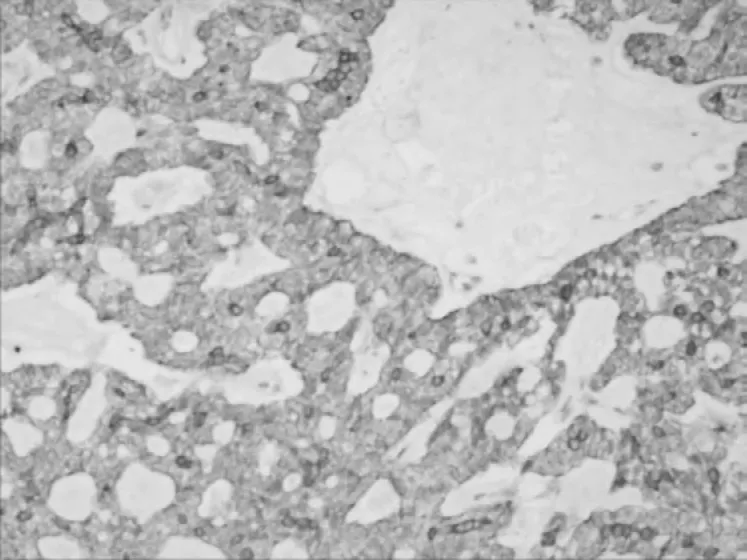
图3 乳腺胶原小体病中CK5/6 的阳性表达(SP 染色,×200)
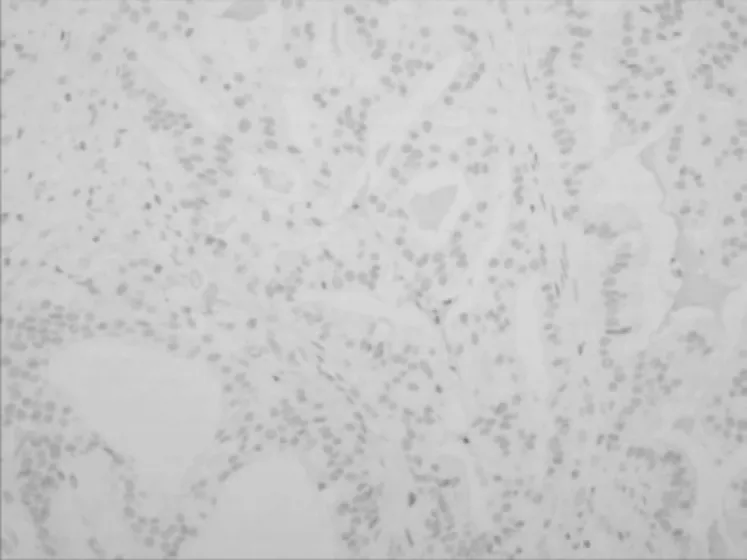
图4 乳腺腺样囊性癌中CK5/6 的阴性表达(SP 染色,×200)

图5 乳腺胶原小体病中Ki67 的表达(SP 染色,×100)
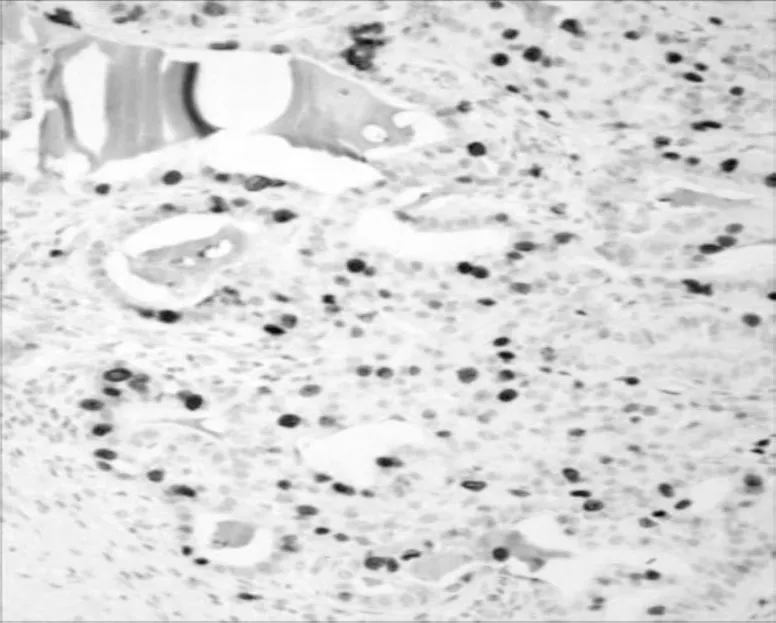
图6 乳腺腺样囊性癌中Ki67 的表达(SP 染色,×200)
2.2.2 特殊染色 乳腺胶原小体病筛孔中的小体AB-PAS 均阳性(AB 分布在小体中部,PAS 分布在小体周围部),乳腺腺样囊性癌中的小体结构仅显示PAS 阳性。
3 讨论
乳腺胶原小体病是一种由于导管和(或)腺泡上皮肌上皮细胞增生的良性病变,产生丰富的基膜样物质,形成特殊的形态学图像,腺管上皮呈筛状增生,筛孔中间有界限清楚无细胞性的球形小体(20~100 μm),治疗简单,只要局部切除就可以达到治疗目的[2];而原发筛状型乳腺腺样囊性癌为一种浸润性乳腺癌,镜下可见到筛状的假腺样或腺样结构,且孔内也见有嗜酸性小体样结构,但其临床处理需采用乳腺切除的治疗方法,甚至选择性进行腋窝淋巴结清扫。
3.1 临床特点 乳腺胶原小体病通常为镜下偶然发现,常与乳腺导管内乳头状瘤、硬化性腺病、腺肌上皮瘤、不典型导管增生伴随,少数情况与乳腺导管/小叶原位癌或浸润性癌并存[3],临床可触及单发或多发性包块,钼靶可显示不规则结节影,有时伴有微钙化。原发筛状型乳腺腺样囊性癌在临床可触及明显肿块并伴随相应的临床症状和体征。
3.2 组织病理学特点 本文报道的2例乳腺胶原小体病和文献[4]中的描述相似,镜下为较小的单灶或多灶分布,累及终末乳腺小叶单位的导管或腺泡,受累腺腔不同程度扩张,低倍镜下见上皮增生,呈大小相近的筛孔状,孔中见无细胞的嗜酸性物质;高倍镜下筛孔腔隙内的嗜酸性小体为均质细丝状,星状/放射状,少数球形小体中心可见嗜酸性透明球,有的病变小体出现退行性变,呈皱缩或黏液微囊性变,小体周围肌上皮和腺上皮细胞增生,细胞无异型性;原发筛状型乳腺腺样囊性癌低倍镜下病变范围较大,筛网状结构排列拥挤,形状大小各异,并于间质内呈浸润性生长,筛孔多呈大小不等的圆形或卵圆形,大部分筛孔为假性腺腔,腔内物为一致的透明小体,但缺乏细丝状、放射状结构特点,为不含胶原成分的间质或黏液成分,在某些区域,这些胶原成分和胶原化的间质可相通,衬覆筛孔的上皮为胞质较少的基底样细胞或胞质丰富的腺上皮细胞,且细胞具有异型性,可帮助鉴别诊断,此外,在基底样细胞周围,可见肌上皮细胞,该细胞核大小一致,细胞边界不清,胞质透亮或双嗜性,有的细胞核成角,而成角状的细胞核可帮助作出腺样囊性癌的诊断[5]。
3.3 免疫表型 乳腺胶原小体病可能是乳腺定向干细胞的增生、分化及多向分化,小体周围的细胞主要为肌上皮细胞,在本文选择的2例病例中,肌上皮标志物CK5/6、P63、SMA 及CKH 小体周围连续阳性也证实了胶原小体病的小体周围的细胞大部分为肌上皮细胞,而腺上皮细胞却分布较少。乳腺腺样囊性癌的筛状结构由基底细胞样细胞、肌上皮细胞和导管上皮细胞构成,筛孔大部分是假腺管型的孔,由肌上皮增殖形成,所以肌上皮标记物分布在外层或小孔周围肌上皮分布区域,而内层或部分小孔区域上皮细胞分布区显示阴性,因此,P63、SMA 及CKH 阳性表达常不连续或不确定,且本文的病例CK5/6 表达明确阴性,也提示了其与良性病变的本质差别。有文献报道,细胞表面肽酶CD10 在正常乳腺的肌上皮中表达良好,但不表达于腺样囊性癌的肌上皮,因此可作为胶原小体病与筛状型腺样囊性癌的可靠鉴别指标[6-7],但本文病例CD10 在乳腺胶原小体及腺样囊性癌中均为阴性表达,与前人报道存在差异,差异的产生可能是由于试验选用病例存在个体化特征造成的,是否存在普遍性尚需扩大样本量进行验证。有文献报道,S-100 在原发乳腺腺样囊性癌中呈胞质和胞核的阳性表达[5],本文S-100 在胶原小体病中则呈阴性表达,这可能也可以作为鉴别不同来源肿瘤的一个关键点,但仍需要大样本资料研究的支持。此外,我们更看重的是两者在激素受体及细胞增殖活性方面的表达,乳腺胶原小体病本身就是乳腺良性增生性病变,所以ER、PR 在腺上皮分布区域体现为阳性,点、簇状分布,细胞增殖活性较低(Ki67 阳性小于5%)。而在乳腺腺样囊性癌中ER、PR 均阴性表达,这与文献论证的ER、PR 在乳腺和涎腺的腺样囊性癌中呈阴性表达[8]的结果一致,且由于其恶性生物学行为的存在,细胞增殖活性较高(Ki67 阳性在本文2例中均高于15%)。
综上所述,乳腺胶原小体病是上皮细胞及肌上皮细胞共同增生的良性病变,和发生在乳腺的筛状型腺样囊性癌在HE 染色及冰冻切片中极其相似,其临床处理和预后完全不同,两者的鉴别诊断有着重要意义。因此在实际工作中,需要通过仔细观察,首先在显微镜下对两者细胞的组织病理差异进行分辨,再通过对筛孔内的球形小体进行观察,辅以AB-PAS 染色进行辨别、免疫组化肌上皮标记物、S-100、细胞增殖活性指数Ki67 及激素受体ER、PR 标记相结合,即能协助乳腺胶原小体病和原发筛状型乳腺腺样囊性癌的鉴别诊断,因此,两者的鉴别是形态学与免疫组化综合性分析的结果。
[1]Clement PB,Yong RH.Collagenous spherulosis of breast [J].Am J Surg Pathol,1987,11 (6):411-417.
[2]刘彤华.诊断病理学[M].3 版北京:人民卫生出版社,2006:656.
[3]姜云惠,柯昌庶,袁小星.乳腺胶原小体病2例报道[J].诊断病理学杂志,2013,20 (4):243-244.
[4]李静,丁华野.乳腺胶原小体病临床病理分析[J].诊断病理学杂志,2006,13 (3):211-213.
[5]杨文涛,张延缪,沈铭昌,等.乳腺腺样囊性癌临床病理特点及文献复习[J].2005,21 (1):10-13.
[6]Neves Cde D,SoaresAB,Costa AF,et al.CD10 (neutral endopeptidase)expression in myoepitthelithelial Cells of salivary neoplasms [J].Appl Immunohistochem Mol Morphol,2010,18 (2):172-1728.
[7]李静,杨光之,金华,等.乳腺胶原小体病的临床病理学观察[J].中华病理学杂志,2013,42 (11):735-738.
[8]Locati LD,Perrone F,Losa M,et al.Treatment relevant target immunophenotyping of 139 salivary gland carcinomos (SGCs)[J].Oral Oncol,2009,45 (11):986-989.