雄激素依赖性前列腺癌细胞中雄激素受体上调EphA3表达
刁小伟,李园,皮玉瑞,李同辉,刘平,卢山
细胞与分子生物学
雄激素依赖性前列腺癌细胞中雄激素受体上调EphA3表达
刁小伟,李园,皮玉瑞,李同辉,刘平,卢山△
目的探讨雄激素依赖性前列腺癌细胞中促红细胞生成素产生肝细胞A型受体(EphA)3表达和雄激素受体(AR)信号通路的关联。方法首先通过逆转录聚合酶链式反应(RT-PCR)和蛋白免疫印迹实验(Western blot)分别检测前列腺癌细胞LNCaP和22Rv1中EphA3和AR的mRNA及蛋白水平,然后用双氢睾酮(DHT)刺激48 h,测定细胞EphA3、AR和前列腺特异抗原(PSA)表达水平的变化。同时,将成功构建的荧光素酶报告基因重组质粒EphA3-Luc(-789~+146)与AR表达质粒pcDNA3.1(+)-AR或AR特异性小分子干扰RNA(siAR)共转染22Rv1细胞,分析AR对EphA3转录活动的影响。结果EphA3在前列腺基质细胞WPMY-1中表达水平极低,但在前列腺癌细胞LNCaP和22Rv1中则明显升高,与AR表达模式相似。10 nmol/L DHT不仅明显上调22Rv1细胞中AR、PSA和EphA3表达水平,也显著升高LNCaP细胞中相关基因和蛋白水平。而且细胞内不同AR表达水平会显著影响EphA3启动子活性。结论AR通过提高EphA3启动子活性上调EphA3表达水平。
促红细胞生成素产生的肝细胞A型受体3;双氢睾酮;受体,雄激素;前列腺肿瘤;调节
促红细胞生成素产生肝细胞(Erythropoietinproducing hepatocellular,Eph)A型受体(Type A recep⁃tor,A)3是重要受体酪氨酸激酶(Receptor tyrosine ki⁃nases,RTK)家族中第一个被克隆出来的Eph受体亚族成员[1],不仅参与调控正常细胞的生理活动[2],还高表达于多种肿瘤,如胃癌、结直肠癌、黑色素瘤和肉瘤等[3-5],在与癌症发生发展相关联的血管生成、干细胞维持和细胞转移等方面具有重要作用[2,6]。因此,
近年来被认为是抑制肿瘤细胞生长、治疗癌症的重要靶点[6-7]。然而,在肺癌中却观察到EphA3能够显著抑制肿瘤细胞生长[8];在出现衰老特征的人视网膜色素上皮细胞中EphA3被认为是抑癌候选基因[9]。上述研究结论的矛盾性说明EphA3可能针对不同肿瘤在表达及功能上有其特异性,但迄今为止,前列腺癌中有关EphA3的表达与调控,EphA3与前列腺癌发生、发展中起关键作用的雄激素受体(Androgen receptor,AR)信号通路的关联及调控机制鲜见报道。因此,本研究借助分子生物学方法检测了雄激素非依赖性前列腺癌细胞中EphA3表达水平以及双氢睾酮(Dihydrotestosterone,DHT)刺激条件下相关基因水平的变化,并构建EphA3启动子荧光素酶报告基因重组载体与AR表达质粒或AR特异性siRNA(AR siRNA,siAR)共转染前列腺癌细胞,探讨AR对EphA3表达的影响,为前列腺癌的诊治提供新的理论依据。
1 材料与方法
1.1 细胞培养将WPMY-1细胞(上海复祥生物科技)、LN⁃CaP细胞和22Rv1细胞(南京军区总院王建东博士馈赠)接种于含有100 U/mL青霉素(Hyclone)、100 g/mL链霉素(Hy⁃clone)和10%胎牛血清(Fetal bovine serum,FBS,Gibco)的RPMI-1640培养基(Wisent)中,置37℃、5%CO2培养箱里培养。
1.2 DHT刺激待细胞覆盖率达60%时,换入含有10% Charcoal-stripped FBS(SFBS,HyClone)的phenol-free RPMI-1640培养基(Gibco)。饥饿3 d后,加入不同浓度DHT(北京百灵威科技)刺激48 h。
1.3 逆转录聚合酶链反应(RT-PCR)RT(HiScript Q RT Su⁃per Mix for qPCR)和PCR(2×Taq Master Mix)试剂均来自南京诺唯赞生物科技公司。利用Trizol(Invitrogen)提取细胞总RNA,逆转录成cDNA,再进行PCR扩增。AR[10]、PSA[11]、EphA3[3]和β-actin特异性引物(FW:5′-GAGCTACGAGCT⁃GCCTGACG-3′;RV:5′-CCTAGAAGCATTTGCGGTGG-3′)均由上海捷瑞生物工程公司合成。反应条件为94℃5 min;94℃30 s,60℃30 s,72℃30 s,共35个循环;72℃延伸5 min。
1.4 Western blot采用RIPA裂解液(江苏碧云天)收集细胞总蛋白,并根据本实验室方法[12]测定蛋白浓度,进行SDSPAGE凝胶电泳、转膜。然后,分别孵育一抗和二抗,再加入ECL化学发光试剂(上海天能科技),使用化学发光成像系统(上海天能科技)检测目的蛋白表达水平。β-actin、AR、EphA3、Sp1和辣根过氧化物酶(HRP)标记的羊抗兔IgG抗体均购自Santa Cruz公司,PSA抗体则来源于Dako公司。
1.522 Rv1细胞基因组DNA的分离将胰酶消化的细胞收集于40 mL蔗糖裂解液[0.32 mol/L蔗糖、10 mmol/L Tris-HCl(pH7.5)、5 mmol/L MgCl2和1%Triton X-100]中,离心移去部分上清,与重悬缓冲液[0.1 mol/L NaCl、10 mmol/L Tris-HCl(pH7.5)和1.5 mmol/L MgCl2]混匀。二次离心后,加入0.5 mL 10×TEN溶液[0.21 mol/L Tris-HCl(pH7.5)、0.29 mol/L EDTA和1 mol/L NaCl],0.25 mL蛋白酶K(2 g/L)和0.5 mL 10%SDS,37℃放置过夜。再用苯酚∶氯仿∶异戊醇(25∶24∶1)、氯仿∶异戊醇(24∶1)、0.4 mol/L NaCl和2倍体积的100%乙醇依次纯化基因组DNA,并溶解于双蒸水中。
1.6 荧光素酶报告基因重组载体的构建利用JASPAR数据库(Copenhagen,Denmark)分析EphA3启动子区域[1],在-615~-601区域发现潜在AR结合位点,即雄激素应答元件(Androgen response element,ARE)。因此,在EphA3启动子序列的-789~+146区域设计上、下游引物,并添加酶切位点和保护碱基,即分别为F-CCGCTCGAGCTCCCTTCCGTAA⁃GATGA和R-CCCAAGCTTCTTTGAAGAGCGTGAGCC(下划线为限制性酶切位点)。以22Rv1细胞的基因组DNA为模板,进行PCR扩增。用XhoⅠ和HindⅢ酶切PCR产物、割胶纯化,与pGL3-Basic线性空载体按比例混合,加入T4 DNA连接酶,过夜后转化入DH5α,挑取单克隆扩大培养,利用碱裂解法提取质粒DNA。所有重组子均经过酶切及测序分析(生工生物工程公司)。
1.7 瞬时共转染实验和双荧光素酶活性测定AR表达质粒,pcDNA3.1(+)-AR为Dr.Huang Haojie(Mayo clinic)馈赠,siAR[13]由上海英骏生物技术公司合成。选用Lipofectamine 2000(Invitrogen)对种植于24孔板中、覆盖率达50%左右的22Rv1细胞分为4组进行转染(n=3)。每孔均加入400 ng荧光素酶重组子和10 ng pRL-TK内参。AR过表达组再加入400 ng AR质粒,对照组为pcDNA3.1(+)空载质粒;AR敲除组则加入20 pmol siAR,对照组为荧光标记的siRNA阴性对照(FAM-siRNA NC)。细胞转染4 h后,更换新鲜培养基。48 h后,严格遵守Dual-Luciferase®Reporter Assay System(Promega)操作,用Thermo Scientific Luminoskan Ascent分析仪测定细胞裂解液的萤火虫(firefly)和海肾(Renilla)荧光素酶活性,启动子的相对活性用两者比值表示,并经相应对照组结果校正。
1.8 统计学方法每个实验至少重复2次以上,选取有代表性的实验结果,以均数±标准差表示。采用Excel和GraphPad Prism 5进行统计分析,2组间的均数比较采用独立样本资料t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 前列腺癌细胞中EphA3表达水平与前列腺正常基质细胞WPMY-1相比,EphA3在高表达AR的雄激素依赖性前列腺癌细胞LNCaP和22Rv1中的mRNA和蛋白水平均显著升高;且EphA3在两种细胞中的表达模式与AR几乎一致,见图1(22Rv1细胞中还存在AR剪切变异体表达的突变蛋白,如图中箭头所示)。因此,推测EphA3表达水平可能与AR调节有关。
2.2 DHT刺激上调EphA3表达当加入一定浓度
DHT后,22Rv1细胞中AR、PSA和EphA3的mRNA水平均明显升高,见图2A;AR、PSA和EphA3在蛋白水平上也出现显著增加,见图2B。同时,LNCaP细胞的AR和PSA蛋白水平也随着DHT浓度上升而增加,当DHT为10 nmol/L时,EphA3蛋白水平升高2倍左右;此外,以在正常培养基中生长的细胞作为阳性对照,其AR、PSA和EphA3蛋白水平也有一定程度增加,见图2C。提示雄激素信号通路的激活能够增加AR表达,提高AR转录活性,还诱导了EphA3表达。
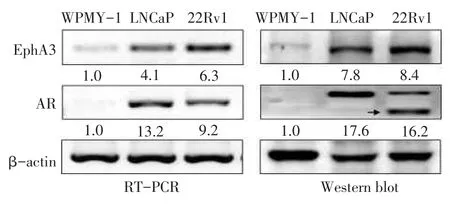
Fig.1The expression levels of EphA3 and AR in androgen-dependent prostate cancer cells图1 前列腺癌细胞中EphA3和AR的表达水平

Fig.2The effects of DHT on AR,PSA and EphA3 expressions inhuman androgen-dependent prostate cancer 22Rv1 and LNCaP cells图2 DHT对前列腺癌细胞LNCaP和22Rv1中AR、PSA和EphA3表达的影响
2.3 EphA3启动子荧光素酶报告基因重组质粒的鉴定结果荧光素酶的报告基因质粒EphA3-Luc(-789~+146)是在pGL3-Basic载体上插入EphA3启动子片段,见图3A。重组质粒的酶切结果显示,泳道1是限制性内切酶XhoⅠ切割pGL3-Basic载体后获得的线性质粒DNA全长片段,约5 000 bp,与理论值4 818 bp基本吻合;泳道2是PstⅠ(位于EphA3启动子-246~-243区域里)单酶切重组质粒获得的片段,推测长度应为5 753 bp,与图中6 000 bp位置基本一致;泳道3则是利用PstⅠ和BamHⅠ(位于pGL3-Basic上)共同作用的产物,基本符合3 394 bp和2 359 bp的预期位置,见图3B。由此,能够初步确认已完成EphA3启动子荧光素酶报告基因质粒的构建。对重组质粒进行正反向测序及DNAMAN软件比对,发现插入片段和EphA3启动子序列完全一致,证实已成功构建EphA3启动子的荧光素酶报告基因质粒,见图4。

Fig.3Construction of luciferase reporter plasmid EphA3 gene promoter图3 EphA3启动子荧光素酶报告基因质粒的构建
2.4 AR的表达水平对EphA3启动子活性的影响EphA3-Luc(-789~+146)与AR表达质粒或siAR共转染22Rv1细胞的双荧光素酶活性检测结果显示,AR过表达能显著提高启动子活性;反之,AR表达受抑制,启动子活性则显著下降,见图5。说明AR能够影响EphA3启动子活性,即AR能够通过影响EphA3转录水平来调节EphA3表达水平。
3 讨论
3.1 AR对EphA3表达水平的影响有文献报道前列腺癌细胞LNCaP中EphA3的mRNA高水平表达[14],本研究不仅证实LNCaP细胞中EphA3的mRNA水平上升,也发现其蛋白水平异常,还在22Rv1细胞中观察到同样现象,EphA3表达水平与细胞中AR表达模式相似。同时,EphA3在前列腺癌22Rv1细胞中无论mRNA还是蛋白水平上均能受到DHT诱导表达;而且,EphA3受DHT诱导的变化趋势与AR作为转录因子调控的PSA水平变化相
一致。此外,DHT刺激LNCaP细胞EphA3后蛋白水平也显著上升。因此,AR能够上调EphA3表达。最近有文献报道雄激素诱导的前列腺亮氨酸拉链基因(Prostate Leucine zipper gene,PrLZ/PC-1)能够促进EphA3表达[15],这也说明AR可能会上调EphA3。但值得注意的是,曾有文献报道针对来源于LNCaP细胞的雄激素依赖性细胞LNCaP-C33和雄激素非依赖性细胞LNCaP-C81进行的基因芯片分析显示,EphA3表达水平在后者中显著升高[16]。尽管LNCaP细胞向雄激素非依赖性转变的过程中,AR作为转录因子调控PSA的作用会受到抑制,但还会涉及到很多其他基因以及信号通路的变化;并且雄激素非依赖性LNCaP细胞中AR表达水平不一定减少;也不能进一步推断雄激素依赖性细胞LNCaP-C33中敲除AR后EphA3表达就会出现上升。所以,雄激素非依赖性前列腺癌细胞中出现这样的结果很可能归因于针对不同前列腺癌进展阶段EphA3的表达和调控都有其特异性,也可能还存在其他EphA3调节通路等,需要进一步研究。

Fig.4Sequencing analysis of EphA3 promoter luciferase reporter plasmid图4 重组EphA3启动子质粒的测序分析
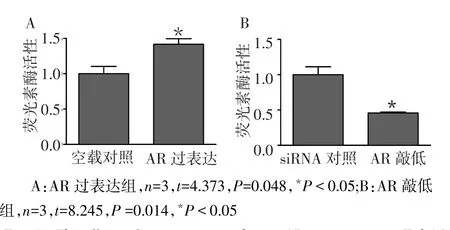
Fig.5The effects of increasing or reducing AR expressions on EphA3 promoter luciferase activity in 22Rv1 cells图5 22Rv1细胞中增加或抑制AR表达水平对EphA3启动子荧光素酶活性的影响
3.2 AR调节EphA3表达的机制AR属于核受体超家族中的类固醇受体,在前列腺癌中高表达。许多研究已证实AR与前列腺癌发生、发展及其信号通路密切关联,且阻断AR的下游信号已成为前列腺癌治疗的新策略[17]。AR通常由4个结构域——N端转录激活区(NTD)、DNA结合区(DBD)、铰链区和配体结合区(LBD)组成。细胞质内处于失活状态的AR能够依赖雄激素等配体的结合而被激活进入核内,再与靶基因启动子上特异性DNA序列ARE位点相结合来调节靶基因的转录活动[18]。对EphA3启动子区域的分析发现在-615~-601处有潜在的ARE结合位点,启动子荧光素酶实验也证实AR表达水平的变化显著影响EphA3启动子活性。因此,推测AR很可能通过与ARE位点结合来直接调节EphA3的表达。但AR对下游基因的调控,除了作为转录因子结合ARE发挥作用外,也可以作为转录辅助因子与其他蛋白结合来调节基因的表达。如AR能与转录因子Sp1蛋白形成复合物依赖Sp1结合位点,共同调节下游基因如细胞周期蛋白依赖性激酶抑制基因p21和血管内皮生长因子(VEGF)[19-20]。因此,EphA3启动子区域ARE位点是否就是AR作为转录因子直接结合区域,还是与其他蛋白共同作用来调节EphA3转录水平以及在此调节过程中EphA3核心启动子区域是否还有其他起关键作用的转录因子结合位点等,都还有待于深入探讨。
AR及其信号通路在前列腺癌的发生发展中发
挥重要的作用,本研究发现雄激素非依赖性前列腺癌细胞高表达EphA3;同时,EphA3的表达水平也能够随AR信号通路的激活而增加;而且EphA3启动子活性能够应答AR表达水平的变化。这些结果说明了EphA3与前列腺肿瘤重要影响因子AR的关联。因此,对EphA3在前列腺癌中的作用进行深入研究,能够为前列腺癌的诊治提供新的理论依据。
[1]Dottori M,Down M,Huttmanna A,et al.Cloning and characteriza⁃tion of EphA3(Hek)gene promoter:DNA methylation regulates ex⁃pression in hematopoietic tumor cells[J].Blood,1999,94(7): 2477-2486.
[2]Janes PW,Slape CI,Farnsworth RH,et al.EphA3 biology and can⁃cer[J].Growth Factors,2014,32(6):176-189.doi:10.3109/ 08977194.2014.982276.
[3]Xi HQ,Wu XS,Wei B,et al.Aberrant expression of EphA3 in gas⁃tric carcinoma:correlation with tumor angiogenesis and survival[J]. J Gastroenterol,2012,47(7):785-794.doi:10.1007/s00535-012-0549-4.
[4]Xi HQ,Zhao P.Clinicopathological significance and prognostic val⁃ue of EphA3 and CD133 expression in colorectal carcinoma[J].J Clin Pathol,2011,64(6):498-503.doi:10.1136/jcp.2010.087213.
[5]Chiari R,Hames G,Stroobant V,et al.Identification of a tumor-spe⁃cific shared antigen derived from an Eph receptor and presented to CD4 T cells on HLA class II molecules[J].Cancer Res,2000,60(17):4855-4863.
[6]Keane N,Freeman C,Swords R,et al.EPHA3 as a novel therapeu⁃tic target in the hematological malignancies[J].Expert Rev Hema⁃tol,2012,5(3):325-340.doi:10.1586/ehm.12.19.
[7]Vail ME,Murone C,Tan A,et al.Targeting EphA3 inhibits cancer growth by disrupting the tumor stromal microenvironment[J].Can⁃cer Res,2014,74(16):4470-4481.doi:10.1158/0008-5472. CAN-14-0218.
[8]Zhuang G,Song W,Amato K,et al.Effects of cancer-associated EPHA3 mutations on lung cancer[J].J Natl Cancer Inst,2012,104(15):1182-1197.doi:10.1093/jnci/djs297.
[9]Lahtela J,Corson LB,Hemmes A,et al.A high-content cellular se⁃nescence screen identifies candidate tumor suppressors,including EPHA3[J].Cell Cycle,2013,12(4):625-634.doi:10.4161/ cc.23515.
[10]Juang HH,Hsieh ML,Tsui KH.Testosterone modulates mitochondri⁃ al aconitase in the full-length human androgen receptor-transfect⁃ed PC-3 prostatic carcinoma cells[J].J Mol Endocrinol,2004,33(1):121-132.
[11]Zhao H,Zhu C,Qin C,et al.Fenofibrate down-regulates the expres⁃sions of androgen receptor(AR)and AR target genes and induces oxidative stress in the prostate cancer cell line LNCaP[J].Biochem Biophys Res Commun,2013,432(2):320-325.doi:10.1016/j. bbrc.2013.01.105.
[12]Dong Y,Tang LL,Lin L,et al.New protein assay with improved tol⁃erability to interferences[J].Chinese Journal of Biotechnology,2012,28(9):1130-1138.[董源,汤灵玲,林林,等.蛋白含量检测的抗干扰新方法[J].生物工程学报,2012,28(9):1130-1138].
[13]Liao X,Tang S,Thrasher JB,et al.Small-interfering RNA-induced androgen receptor silencing leads to apoptotic cell death in prostate cancer[J].Mol Cancer Ther,2005,4(4):505-515.
[14]Fox BP,Tabone CJ,Kandpal RP.Potential clinical relevance of Eph receptors and ephrin ligands expressed in prostate carcinoma cell lines[J].Biochem Biophys Res Commun,2006,342(4):1263-1272.
[15]Wu R,Wang H,Wang J,et al.EphA3,induced by PC-1/PrLZ,con⁃tributes to the malignant progression of prostate cancer[J].Oncol Rep,2014,32(6):2657-2665.doi:10.3892/or.2014.3482.
[16]Singh AP,Bafna S,Chaudhary K,et al.Genome-wide expression profiling reveals transcriptomic variation and perturbed gene net⁃works in androgen-dependent and androgen-independent prostate cancer cells[J].Cancer Lett,2008,259(1):28-38.
[17]Asangani IA,Dommetivl VL,Wang X,et al.Therapeutic targeting of BET bromodomain proteins in castration-resistant prostate can⁃cer[J].Nature,2014,510(7504):278-282.doi:10.1038/na⁃ture13229.
[18]Aragon-ching JB.The evolution of prostate cancer therapy:target⁃ing the androgen receptor[J].Front Oncol,2014,4:295.doi: 10.3389/fonc.2014.00295.
[19]Eisermannk K,Broderick CJ,Bazarov A,et al.Androgen up-regu⁃lates vascular endothelial growth factor expression in prostate can⁃cer cells via an Sp1 binding site[J].Mol Cancer,2013,12:7.doi: 10.1186/1476-4598-12-7.
[20]Lu S,Jenster G,Epner DE.Androgen induction of cyclin-depen⁃dent kinase inhibitor p21 gene:role of androgen receptor and tran⁃scription factor Sp1 complex[J].Mol Endocrinol,2000,14(5): 753-760.
(2015-04-14收稿 2015-06-11修回)
(本文编辑 李鹏)
Androgen receptor up-regulates EphA3 expression in androgen-dependent prostate cancer cell lines
DIAO Xiaowei,LI Yuan,PI Yurui,LI Tonghui,LIU Ping,LU Shan△
1 College of Life Science,Nanjing Normal University,Nanjing 210023,China;2 Jiangsu Provincial Key Laboratory of Molecular Medicine,Nanjing Normal University△
ObjectiveTo evaluate the relationship between liver cell type A receptor(EphA)expression and androgen receptor(AR)signaling in androgen-dependent prostate cancer cells.MethodsRT-PCR and Western blot assay were used to determine mRNA and protein levels of EphA3 and AR in prostate cancer LNCaP and 22Rv1 cells,respectively.The variations of EphA3,AR and prostate specific antigen(PSA)expressions were also measured in these cells after dihydrotes⁃tosterone(DHT)treatment for 48 h.The constructed EphA3-Luc(-789-+146)luciferase reporter plasmid was co-transfect⁃ed with pcDNA3.1(+)-AR or siAR in 22Rv1 cells to analyze the effects of different AR expression levels on EphA3 tran⁃scription activity.ResultsThe expression pattern of EphA3 was similar to AR,showing a lower level in prostate stromal cell line WPMY-1 and a higher level in prostate cancer cell lines LNCaP and 22Rv1.When stimulated with 10 nmol/L DHT,the expression levels of AR,PSA and EphA3 were significantly increased in 22Rv1 cells,and the protein levels of these genes were also increased in LNCaP cells.Moreover,AR expression levels markedly influenced the activity of EphA3 pro⁃moter.ConclusionAR up-regulates EphA3 expression by increasing the activity of EphA3 promoter.
EphA3;dihydrotestosterone;receptors,androgen;prostatic neoplasms;regulation
R737.1,R73-37
A
10.11958/j.issn.0253-9896.2015.11.009
国家自然科学基金资助项目(81172007、81272850)
1南京师范大学生命科学学院(邮编210023);2南京师范大学江苏省分子医学生物技术重点实验室
刁小伟(1988),男,硕士在读,主要从事前列腺癌相关基因转录调控研究
△通讯作者E-mail:lu_shan@hotmail.com

