柠檬苦素类似物的生物活性和构效关系研究进展
韩学青, 朱启华, 王少驰, 徐云根*
(1.中国药科大学天然药物活性组分与药效国家重点实验室,江苏 南京 210009;2.中国药科大学药物化学教研室,江苏 南京210009)
柠檬苦素类似物的生物活性和构效关系研究进展
韩学青1,2, 朱启华1, 王少驰1, 徐云根1,2*
(1.中国药科大学天然药物活性组分与药效国家重点实验室,江苏 南京 210009;2.中国药科大学药物化学教研室,江苏 南京210009)
柠檬苦素类似物是一类高度氧化的四环三萜类植物次生代谢产物,具有镇痛、抗炎、抗肿瘤、昆虫拒食等多种生物活性。对柠檬苦素类似物的结构特点和生物活性进行综述,归纳其构效关系,为该类化合物的进一步结构修饰和改造提供参考。
柠檬苦素类似物;生物活性;构效关系;结构修饰
柠檬苦素类似物(limonoids)是一类高度氧化的四环三萜类植物次生代谢产物,主要存在于芸香科和楝科植物组织中。柠檬苦素类似物主要以有苦味的苷元和无苦味的17-β-D葡糖苷形式存在。人们在探究柑橘类果实的苦味原因时发现了柠檬苦素(limonin,1),随后的科学研究发现柠檬苦素类似物具有镇痛、抗炎、抗肿瘤、昆虫拒食、抗菌、抗病毒等多种活性。本文对柠檬苦素类似物的结构特点和生物活性进行综述,归纳其构效关系,为进一步结构修饰提供参考。
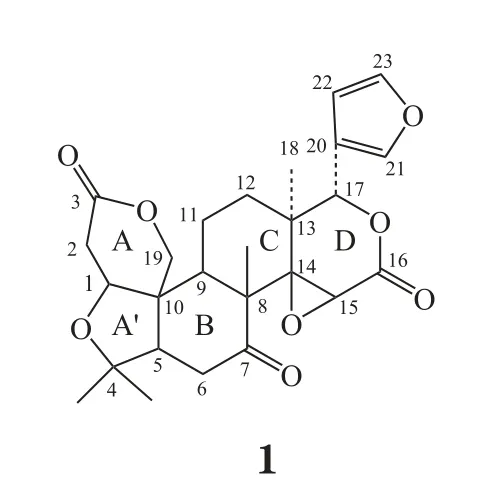
1 柠檬苦素类似物的结构及其特性
柠檬苦素类似物是一类高度氧化、结构典型的萜类物质,分子式为C26H30O8,相对分子质量为470,柠檬苦素类似物的前体含有4,4,8-三甲基-17-呋喃基甾体基本骨架结构。自然界中的柠檬苦素类似物苷元在C-17位有一个呋喃环,在C-3、C-4、C-7、C-16、C-17位均有含氧官能团,除脱氧柠檬苦素外,C-14、C-15位上均有氧桥环。天然存在的柠檬苦素类似物结构变化一般局限在A环和B环,而且在芸香科中比楝科中的变化要少[1]。
2 柠檬苦素类似物的生物活性及构效关系
2.1 镇痛、抗炎活性
Kim等[2]测定了柠檬苦素以及诺米林(nomilin, 2)、去乙酰诺米林(deacetyl nomilin, 3)、去呋喃环诺米林(defuran nomilin, 4)和黄柏酮(obacunone, 5)等柠檬苦素类似物对人主动脉平滑肌细胞中p38MAP激酶活性的影响。实验结果显示,在浓度为50 μmol·L-1时,诺米林对p38MAP激酶活性的抑制率最高,可达38%;柠檬苦素和去乙酰诺米林的抑制率次之,均为19%;去呋喃环诺米林抑制率为17%;而黄柏酮却使p38MAP激酶活性增强了38%。分析结果推测,呋喃环的存在和A环的修饰改造对其抑制p38MAP激酶活性至关重要,诺米林含有呋喃环和C-1位乙酰化的七元A环,其活性最高。
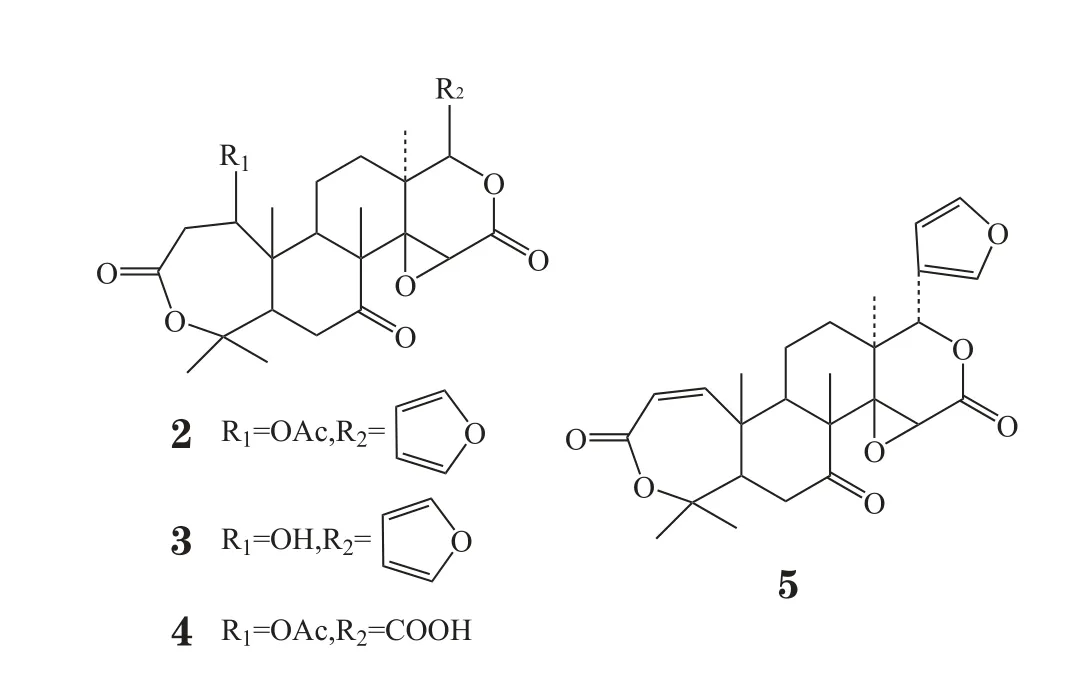
Yang等[3]合成了一系列柠檬苦素的肟醚衍生物并测定其镇痛、抗炎活性。结果显示,剂量为70 mg·kg-1的柠檬苦素肟醚衍生物6对小鼠醋酸扭体抑制率为80%,高于阳性对照药阿司匹林(剂量为200 mg·kg-1时,抑制率为71.8%);剂量为100 mg·kg-1的化合物6对小鼠耳肿胀抑制率为75.4%,高于阳性对照药萘普生(剂量为150 mg·kg-1时,抑制率为36.6%)。相应的脱氧柠檬苦素类似物7则活性明显下降,剂量同为70 mg·kg-1时,其对小鼠醋酸扭体的抑制率仅为33.2%,对小鼠耳肿胀的抑制率仅为18.4%。构效关系研究表明,通过C-7位肟醚化引入叔胺边链可以提高柠檬苦素类似物的水溶性和生物利用度,使其抗炎、镇痛活性增强;同时,C-14、C-15位的氧桥是其镇痛、抗炎活性的关键药效团,当氧桥替换为双键时,镇痛、抗炎活性下降。

2.2 抗肿瘤活性
早期研究表明,柠檬苦素类似物在苯并芘诱导的小鼠早期胃癌和肺癌模型中具有抗肿瘤活性。Miller等(Nutr Cancer,1992年)研究了柠檬苦素类似物葡糖苷对7,12-二甲基苯蒽(DMBA)诱导的仓鼠口腔癌模型的影响。结果显示,质量分数为3.5%时,柠檬苦素葡糖苷(limonin glucose, 8)组肿瘤负荷为(65±15)mm3,空白(蒸馏水)组肿瘤负荷为(147±41)mm3,柠檬苦素葡糖苷能使肿瘤负荷减少55%,其主要通过抑制肿瘤体积实现抗肿瘤效果;而诺米林葡糖苷(nomilin glucose, 9)及诺米林酸葡糖苷(nomilinic acid glucose, 10)在实验中均未显示抗肿瘤活性。Miller等(Carcinogenesis,1989年)之前研究测得,在质量分数为2.5%时,柠檬苦素可以使小鼠口腔癌肿瘤负荷减少60%,其既能使癌细胞数目减少,又能减少肿瘤体积;与之相比,柠檬苦素类似物葡糖苷D环已开环,相应抗肿瘤活性降低或消失。这表明保持D环的完整性是柠檬苦素类似物抗癌活性必不可少的因素。


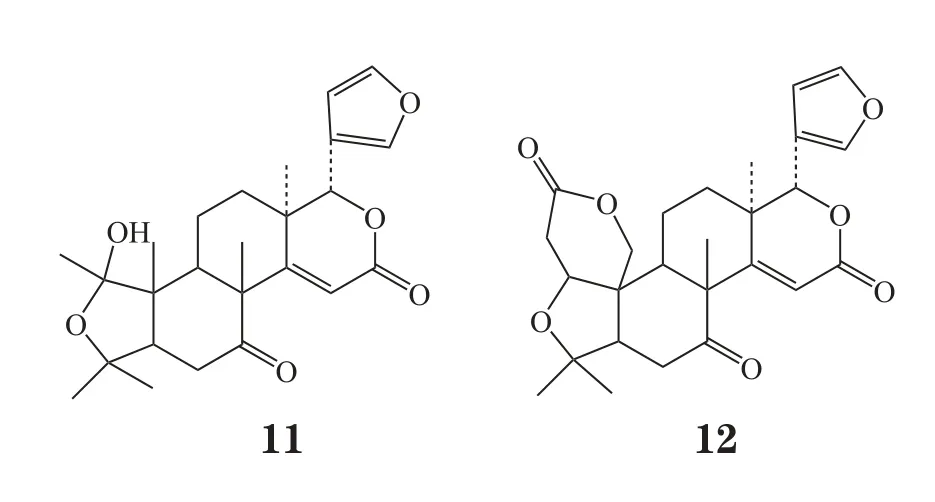
Miller等[4]进一步研究了宜昌根辛(Ichangensin,11)、脱氧柠檬苦素(deoxylimonin, 12)和黄柏酮对仓鼠口腔癌模型的抗肿瘤活性。结果显示,在质量分数为2.5%时,宜昌根辛对肿瘤细胞的形成没有明显作用;脱氧柠檬苦素分别使肿瘤细胞数目和肿瘤负荷减少了30%和40%;黄柏酮分别使两者减少了25%和40%。提示,脱去A环的宜昌根辛不再显示抗肿瘤活性,而脱氧柠檬苦素和黄柏酮均具有抑制癌细胞作用,且活性相当。由此可知,改造柠檬苦素母核中的A环可能会导致其抗肿瘤活性丧失或降低,而D环修饰则对其活性没有明显影响。
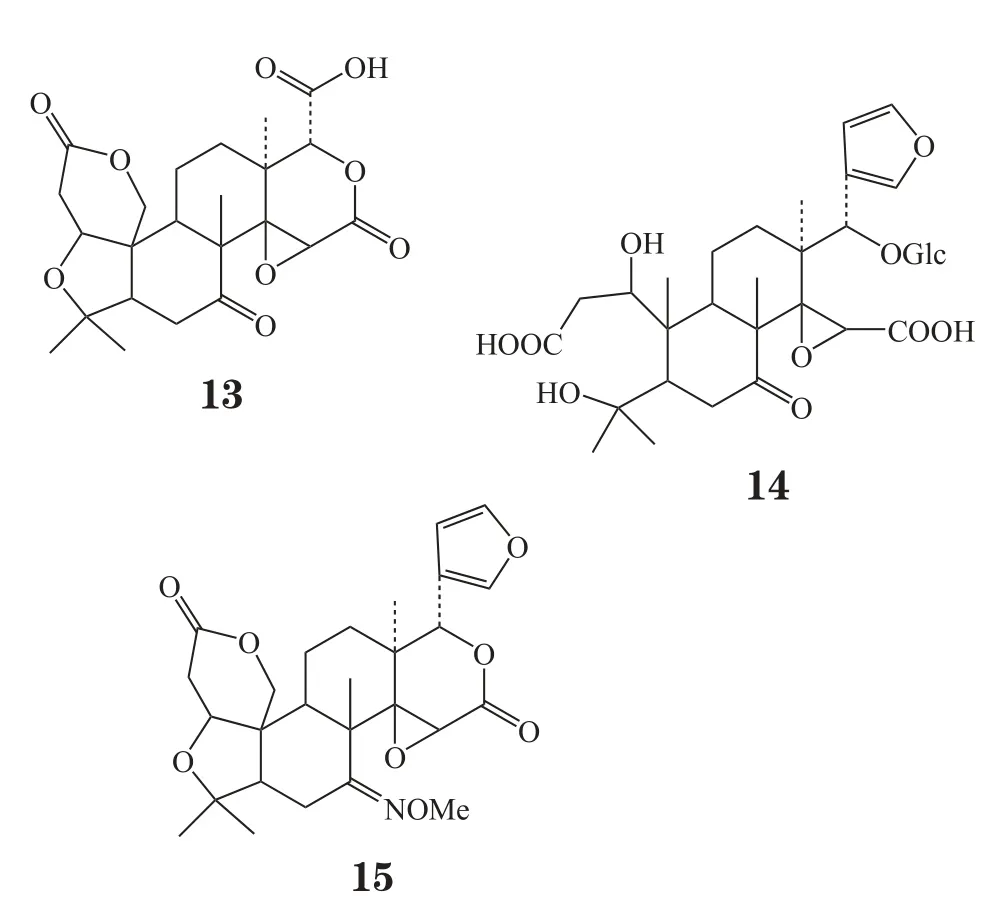
研究表明,柠檬苦素类似物具有抗肿瘤活性的部分原因是其可以激发谷胱甘肽-S-转移酶(GST)的活性。Perez等[5]利用分离得到的柠檬苦素、去呋喃环柠檬苦素(defruan limonin, 13)、脱乙酰诺米林酸葡糖苷(deacetylnomilinic acid glucose, 14)及改造得到的柠檬苦素类似物(15)检测其对Ⅱ相解毒酶GST和醌还原酶(QR)的活性影响。将20 mg化合物用DMSO溶解后,每隔1天给小鼠灌胃,持续10 d后,取肺、胃、肝、小肠等组织进行检测。结果显示,柠檬苦素脱去呋喃环后对GST活性不再具有激发作用,这显示呋喃环可能是激发Ⅱ相解毒酶活性的关键药效团。有研究表明,只有1个A环保持完整的柠檬苦素类似物能很好地激发GST活性,A环和A,环保持完整的柠檬苦素类似物对GST活性的激发作用却并不理想(Lam等,J Agric Food Chem,1989年),该小组在A环和A,环都保持完整的基础上只改造7位得到的柠檬苦素类似物(15)对多个组织的肿瘤细胞却都具有激发GST和QR活性,在4-硝基喹啉-1-氧化物(4NQO)诱导的肝癌细胞中其对GST的激发作用甚至比对照组高出270%。这显示改造柠檬苦素的B环结构也可以显著提高Ⅱ相解毒酶活性。柠檬苦素类似物糖苷不具有激发Ⅱ相解毒酶活性的作用。
同时,柠檬苦素类似物对肿瘤细胞有抑制作用。Tian等[6]发现柠檬苦素、诺米林等多种柠檬苦素类似物均对人乳腺癌MCF-7细胞增殖有明显抑制作用,且呈剂量-时间依赖关系。Murthy等[7]提出了柠檬苦素及其17-β-D葡糖苷诱导结肠癌细胞凋亡的可能机制,即柠檬苦素及其糖苷一方面通过Bcl2家族蛋白和细胞色素介导细胞凋亡,另一方面通过诱导细胞内钙离子浓度增高促进细胞凋亡。
Kim等[8]研究发现,柠檬苦素具有抗芳香化酶的活性,其IC50为5.22 μmol·L-1,同时指出,柠檬苦素类似物抑制细胞增殖的活性与其抗芳香化酶活性无关,而与caspase-7的活化显著相关。研究结果显示,柠檬苦素类似物具有通过caspase-7依赖途径预防雌激素反应性乳腺癌的潜力。
此外,El-Readi等[9]研究发现柠檬苦素、脱乙酰诺米林等能影响耐药性人白血病细胞(CEM/ADR5000)中P糖蛋白的表达。柠檬苦素和脱乙酰诺米林在非毒性浓度(0.32~32 μmol·L-1)下能显著降低P糖蛋白外排,两者均能逆转阿霉素的耐药性,恢复阿霉素的细胞毒性(P<0.001)。其中柠檬苦素的活性优于阳性对照药维拉帕米,能显著提高阿霉素的细胞毒性。该研究表明柠檬苦素类似物能够有效抑制P糖蛋白表达,在癌症化疗中对多药耐药起到抑制作用,能有效提高化疗药物的功效,作为多药耐药逆转剂的先导药物,极具潜力。
2.3 致昆虫拒食作用
Murry等(Entomol Exp Appl,1999年)研究了柠檬苦素类似物对马铃薯甲虫幼虫的拒食作用,结果显示柠檬苦素类似物的呋喃环和C-7位是幼虫拒食活性的关键位点:呋喃环完全氢化后昆虫拒食活性丧失,C-7位羰基被还原后则昆虫拒食活性增强。柠檬苦素葡糖苷无昆虫拒食活性。
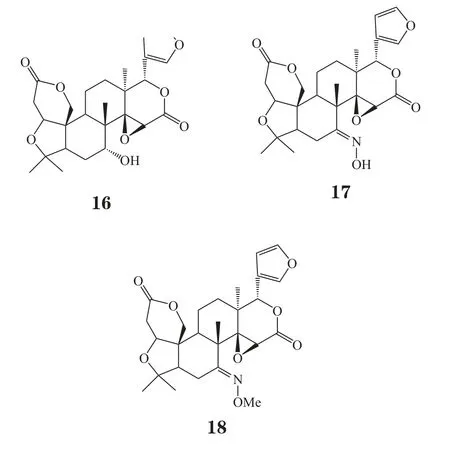
Ruberto等[10]测得草地夜蛾幼虫在质量分数为0.01%的柠檬苦素、诺米林和黄柏酮作用下,其摄食率分别为87%、56%和68%;而C-7位羰基还原后的衍生物中,拒食活性最高分别为柠檬醇(limonol, 16)、7-肟基柠檬苦素(limonin-7-oxime, 17)和7-甲肟柠檬苦素(limonin-7-methoxime, 18),对应的幼虫摄食率分别为68%、68%和76%。上述结果显示,C-7位羰基还原后其抗虫活性并未显著提高,与Murry等人研究结果不符,分析原因可能是柠檬苦素类似物对不同种属昆虫的拒食性有不同的构效影响。
有研究指出,A环是七元环的诺米林和黄柏酮比A环是六元环的柠檬苦素有更高的昆虫拒食活性,而且C-1位被消除的黄柏酮活性更高[11]。
柠檬苦素类似物作为一种绿色环保的抗虫药,在农业应用中前景十分广阔,进一步研究其构效关系,有助于提高其活性,使其得以推广应用。
2.4 抗菌活性
Govindachari等[12]研究了三萜类化合物对真菌的抑制效果,发现柠檬苦素、柠檬醇和诺米林酸(nomilinic acid, 19)等对花生柄锈菌均具有一定的抑制效果,在给药剂量为1 μg·cm-2时,三者抑制脓包形成率分别为67.7%、37.9%和28.5%。由此推测,柠檬苦素类似物A环或B环的修饰和改造均会使其抗菌活性丧失。

Vikram等[13]等研究发现,柠檬苦素类似物能抑制出血性大肠杆菌生物膜的形成,以及阻断大肠杆菌Ⅲ型分泌系统(TTSS)表达,可以用于治疗出血性大肠杆菌感染。他们也证实了A环的存在对柠檬苦素类似物的抗菌活性至关重要。
2.5 抗病毒活性
Battinelli等[14]利用体外培养的外周血单核细胞(PBMC)进行研究后发现,柠檬苦素和诺米林能够抑制人类免疫缺陷1型病毒(HIV-1)复制,且呈一定量-效关系,两者的EC50分别为60.0和52.2 μmol·L-1,其机制可能是柠檬苦素类似物能抑制体外HIV-1蛋白酶活性。该研究同时指出,柠檬苦素和诺米林的结构差异对其抗病毒活性基本没有影响。
Balestrieri等[15]研究发现柠檬苦素和诺米林对人体T细胞白血病/淋巴瘤Ⅰ型病毒(HTLV-1)有明显抑制作用,可以用于治疗成人T细胞白血病,其作用机制可能是通过抑制HTLV-1逆转录酶活性,从而抑制病毒活性。柠檬苦素和诺米林抑制HTLV-1逆转录酶的IC50分别为0.31和2.60 μg·L-1,两者抑制HTLV-1的活性均高于奈韦拉平(IC50>266.30 μg·L-1)。
Yan等[16]采用半叶法研究了一系列柠檬苦素类似物对烟草花叶病毒的影响。质量浓度为50 mg·L-1时,柠檬苦素类似物20~23对烟草花叶病毒的抑制率分别为57.4%、96.7%、94.1%和68.7%,阳性对照药宁南霉素在相同质量浓度下对烟草花叶病毒的抑制率为58.9%。由结果分析,对比化合物20与其他化合物的活性可推测,呋喃环的存在对柠檬苦素类似物的抗病毒活性至关重要;对比化合物23与其他化合物的活性可推测,1、2位的双键基团是柠檬苦素类似物抗病毒活性的关键药效团;结合化合物21与其他化合物的活性可推测,柠檬苦素类似物C-14、C-15位上的氧桥环替换为不饱和双键后抗病毒活性增强。

2.6 保肝作用
Mahmoud等[17]以雄性wistar成年大鼠为模型,D-半乳糖诱导肝毒性,经口给予50 mg·kg-1柠檬苦素时,测得肝脏谷胱甘肽(GSH)含量为34.09 pg·mg-1(每毫克组织中的含量),剂量为100 mg·kg-1时,肝脏GSH含量为47.43 pg·mg-1;给予剂量为100 mg· kg-1的水飞蓟素测得肝脏GSH含量为43.53 pg·mg-1,提示柠檬苦素与水飞蓟素的保肝作用相当。其可能的机制是通过调控Toll样受体(TLR),抑制NF-κB的基因表达,增加抗炎因子白介素(IL)-10浓度,减少炎症和氧化应激,降低组织损伤。Zhu等[18]发现垂齐林类柠檬苦素类似物在浓度为10 μmol·L-1时就能显著增强TNF-α介导的NF-κB荧光素酶活性。柠檬苦素的保肝作用通过其抗炎活性和阻止细胞凋亡介导。Mahmoud等[19]研究发现柠檬苦素能够阻止小鼠肝脏缺血再灌注(I/R)损伤,其通过阻断TLR2、TLR4与接头蛋白相互作用,抑制TLR信号通路,Lian等[20]亦表明通过促进TNF-α释放,抑制TLR4,调控下游接头蛋白的活性,能够实现保肝作用。柠檬苦素通过TLR依赖途径减轻肝缺血再灌注损伤,对肝脏具有保护作用。这些结果表明柠檬苦素可以作为保肝剂应用于肝脏移植或肿瘤切除等手术中。
2.7 对代谢的影响
Ono等[21]以C57BL/6J小鼠为模型,考察柠檬苦素类似物对小鼠新陈代谢的影响。空白组每天每鼠喂食2.17 g高脂饲料,诺米林组每天每鼠混合喂食2.17 g高脂饲料和诺米林(质量分数为0.2%)(黄柏酮组喂养方式与之类似),喂食77 d后测得空白组小鼠血糖、胰岛素质量浓度和附睾质量的平均值分别为2 240 mg·L-1、1.37 μg·L-1、2.06 g,诺米林组相应的平均值分别为1 560 mg·L-1、0.14 μg·L-1、1.23 g;黄柏酮与诺米林活性相当。由数据分析发现,诺米林能显著减轻小鼠体质量,降低其血糖和胰岛素水平,其作用机制可能是激活了胆汁酸膜受体TGR5。而柠檬苦素无法激活TGR5,不具有减肥作用。究其原因可能是A,环的存在阻挡了柠檬苦素与TGR5的结合,而起不到激动作用。对柠檬苦素类似物这一活性进一步深入研究,有望将其应用于治疗肥胖及2型糖尿病等代谢类疾病[22]。
3 展望
柠檬苦素类似物在自然界储量丰富,其诸多的生物活性对人类健康和发展大有益处。但是目前人们对柠檬苦素的研究主要以天然存在的化合物为主,结构改造主要针对其抗肿瘤活性和昆虫拒食活性。进一步研究柠檬苦素类似物的结构与其某一特定生物活性之间的构效关系,将有助于人们针对性地提高其生物活性。另一方面,柠檬苦素的水溶性极差,生物利用度低,严重影响了其临床应用,因此,有必要对柠檬苦素类似物的口服吸收和药动学性质等进行深入研究,以寻找具有良好成药性的柠檬苦素类似物,使柠檬苦素类化合物更好地造福于人类。
[1]Lv M, Xu P, Tian Y, et al. Medicinal uses, phytochemistry and pharmacology of the genus Dictamnus (rutaceae) [J]. J Ethnopharmacol,2015, 171: 247-263.
[2]Kim J, Jayaprakasha G K, Muthuchamy M, et al. Structure-function relationships of citrus limonoids on p38 MAP kinase activity in human aortic smooth muscle cells [J]. Eur J Pharmacol, 2011, 670(1): 44-49.
[3]Yang Y, Wang X, Zhu Q, et al. Synthesis and pharmacological evaluation of novel limonin derivatives as anti-inflammatory and analgesic agents with high water solubility [J]. Bioorg Med Chem Lett,2014, 24(7): 1851-1855.
[4]Miller E G, Porter J L, Binnie W H, et al. Further studies on the anticancer activity of citrus limonoids [J]. J Agric Food Chem, 2004,52(15): 4908-4912.
[5]Perez J L, Jayaprakasha G K, Valdivia V, et al. Limonin methoxylation influences the induction of glutathione S-transferase and quinone reductase [J]. J Agric Food Chem, 2009, 57(12): 5279-5286.
[6]Tian Q G, Miller E G, Ahmad H, et al. Differential inhibition of human cancer cell proliferation by citrus limonoids [J]. Nutr Cancer, 2001,40(2): 180-184.
[7]Murthy K N C, Jayaprakasha G K, Kumar V, et al. Citrus limonin and its glucoside inhibit colon adenocarcinoma cell proliferation through apoptosis [J]. J Agric Food Chem, 2011, 59(6): 2314-2323.
[8]Kim J, Jayaprakasha G K, Patil B S. Limonoids and their antiproliferative and anti-aromatase properties in human breast cancer cells[J]. Food Funct, 2013, 4(2): 258-265.
[9]El-Readi M Z, Hamdan D, Farrag N, et al. Inhibition of P-glycoprotein activity by limonin and other secondary metabolites from citrus species in human colon and leukaemia cell lines [J]. Eur J Pharmacol, 2010,626(2/3): 139-145.
[10]Ruberto G, Renda A, Tringali C, et al. Citrus limonoids and their semisynthetic derivatives as antifeedant agents against Spodoptera frugiperda larvae. A structure-activity relationship study [J]. J Agric Food Chem, 2002, 50(23): 6766-6674.
[11]Bilal H, Akram W, Ali-Hassan S. Larvicidal activity of citrus limonoids against Aedes albopictus larvae[J]. J Arthropod Borne Dis, 2012, 6(2): 104-111.
[12]Govindachari T R, Suresh G, Gopalakrishnan G, et al. Antifungal activity of some tetranortriterpenoids[J]. Fitoterapia, 2000, 71(3): 317-320.
[13]Vikram A, Jesudhasan P R, Jayaprakasha G K, et al. Grapefruit bioactive limonoids modulate E. coli O157:H7 TTSS and biofilm [J]. Int J Food Microbiol, 2010, 140(2/3): 109-116.
[14]Battinelli L, Mengoni F, Lichtner M, et al. Effect of limonin and nomilin on HIV-1 replication on infected human mononuclear cells [J]. Planta Med, 2003, 69(10): 910-913.
[15]Balestrieri E, Pizzimenti F, Ferlazzo A, et al. Antiviral activity of seed extract from Citrus bergamia towards human retroviruses [J]. Bioorgan Med Chem, 2011, 19(6): 2084-2089.
[16]Yan Y, Yuan C M, Di Y T, et al. Limonoids from Munronia henryi and their anti-tobacco mosaic virus activity[J]. Fitoterapia, 2015, doi:10.1016/ j.fitote.2015.09.016.
[17]Mahmoud M F, Hamdan D I, Wink M, et al. Hepatoprotective effect of limonin, a natural limonoid from the seed of Citrus aurantium var. bigaradia, on D-galactosamine-induced liver injury in rats [J]. N-S Arch Pharmacol, 2014, 387(3): 251-261.
[18]Zhu G Y, Bai L P, Liu L, et al. Limonoids from the fruits of Melia toosendan and their NF-κB modulating activities [J]. Phytochemistry,2014, 107: 175-181.
[19]Mahmoud M F, Gamal S, El-Fayoumi H M. Limonin attenuates hepatocellular injury following liver ischemia and reperfusion in rats via toll-like receptor dependent pathway [J]. Eur J Pharmacol, 2014, 740: 676-682.
[20]Lian L H, Jin X J, Wu Y L, et al.Hepatoprotective effects of Sedum sarmentosum on D-Galactosamine/lipopolysaccharide-induced murine fulminant hepatic failure [J]. J Pharmacol Sci, 2010, 114(2): 147-157.
[21]Ono E, Inoue J, Hashidume T, et al. Anti-obesity and anti-hyperglycemic effects of the dietary citrus limonoid nomilin in mice fed a high-fat diet[J]. Biochem Bioph Res Commun, 2011, 410(3): 677-681.
[22]Kelley D S, Adkins Y C, Zunino S J, et al. Citrus limonin glucoside supplementation decreased biomarkers of liver disease and inflammation in overweight human adults [J]. J Funct Foods, 2015, 12: 271-281.
Research Progress in Biological Activity and Structure-activity Relationship of Limonoids
HAN Xueqing1,2, ZHU Qihua1, WANG Shaochi1, XU Yungen1,2
(1.State Key Laboratory of Natural Medicines, China Pharmaceutical University, Nanjing 210009, China; 2.Department of Medical Chemistry, China Pharmaceutical University, Nanjing 210009, China)
Limonoids, typical secondary metabolites in plants, are highly oxygenated tetranortripenoid with a wide range of biological activities,including but not limited to analgesic, anti-inflammatory, antitumor and insect antifeedant activity. Structure characteristics, bioactivities, and structure-activity relationship of limonoids have been reviewed in this article to provide
for further structural modification of these compounds.
limonoid; biological activity; structural-activity relationship; structural modification
R914.4
A
1001-5094(2015)10-0775-06
接受日期:2015-09-24
项目资助:国家自然科学基金(No. 21472242); “重大新药创制”国家科技重大专项(2015ZX09102001)
*通讯作者:徐云根,教授;
研究方向:心脑血管、抗肿瘤及镇痛药物研究;
Tel:025-83271244; E-mail:xyg64@126.com

