肿瘤相关巨噬细胞:在肿瘤演进中的作用及潜在抗肿瘤靶点
董蓉,袁梦,应美丹,曹戟,杨波
(浙江大学药学院药理毒理研究所 浙江省抗肿瘤药物临床前研究重点实验室,浙江 杭州 310058)
肿瘤相关巨噬细胞:在肿瘤演进中的作用及潜在抗肿瘤靶点
董蓉,袁梦,应美丹,曹戟,杨波*
(浙江大学药学院药理毒理研究所 浙江省抗肿瘤药物临床前研究重点实验室,浙江 杭州 310058)
炎症是公认的肿瘤十大特征之一,而肿瘤相关巨噬细胞是肿瘤微环境的重要组成部分,它影响肿瘤的生长、血管生成、免疫抑制、转移和药物抗性。最新研究表明,肿瘤相关巨噬细胞还会影响抗肿瘤治疗的临床疗效。鉴于肿瘤相关巨噬细胞在肿瘤演进中起重要作用,其作为潜在抗肿瘤靶点备受关注。基于最新的研究,对人类癌症中肿瘤相关巨噬细胞的主要功能、作用和特征以及用作新兴肿瘤治疗干预靶点作一综述。
肿瘤相关巨噬细胞;肿瘤演进;炎症;细胞因子;巨噬细胞极化;抗肿瘤靶点
由于观察到肿瘤往往发生在慢性炎症部位,且肿瘤活检样本中也发现有大量的炎性细胞,故在19世纪,人们首次提出炎症和癌症相关[1]。一个多世纪以来,流行病学研究表明,慢性炎症可以促进不同类型癌症的发生,如结肠癌、前列腺癌和肝癌[2-3]。此外,大量研究已经证实,非甾体类抗炎药特别是阿司匹林,对上皮组织来源的肿瘤,例如肠道肿瘤、胃癌、食道癌等,具有一定的化疗预防作用,尤其是对肿瘤的进展具有阻抑作用,但并不是对所有癌症,如肝癌、胆囊癌和胰腺癌等[4-5]。不仅特定的炎性病症患者易得癌症,而且流行病学与炎症无关的肿瘤(例如乳腺癌)中也存在炎性微环境。因此,现在普遍认为,炎症是肿瘤微环境的重要组成部分。癌症相关炎症的主要特征包括白细胞浸润、可溶性介质(细胞因子和趋化因子)的存在、组织重塑和血管生成。
现在普遍认为,癌症相关炎症可促进肿瘤的生长和发展。20世纪70年代后期,人们发现,肿瘤的生长是由肿瘤中浸润白细胞的主要成分肿瘤相关巨噬细胞(TAM)所诱导。而且,在许多但不是所有的人类肿瘤中,大量TAM的浸润与预后不良相关[6]。在这里,将基于最新的研究,对人类癌症中TAM的主要功能、作用和特征以及用作新兴肿瘤治疗干预靶点作一综述。
1 巨噬细胞分类
表型可变和功能多样是巨噬细胞的重要特征[7]。因此,巨噬细胞能根据接收到的微环境信号执行多种多样的功能,如促炎、抗菌、免疫调节、组织重塑和促癌作用[8-9]。
巨噬细胞主要有2种功能表型:经典活化的巨噬细胞(M1型巨噬细胞)和替代性活化的巨噬细胞(M2型巨噬细胞)(见表1)[10]。M1型巨噬细胞主要存在于促炎环境中,由病原微生物刺激产生的炎性介质如脂多糖(LPS)、γ-干扰素(IFN-γ)、TNF-α和粒细胞-巨噬细胞集落刺激因子(GM-CSF)等诱导产生,具有高递呈抗原的能力,并能大量分泌促炎性细胞因子IL-12和IL-23,从而参与Th1型免疫应答,杀伤病原体(细菌和病毒)和肿瘤细胞。M2型巨噬细胞主要参与体内平衡过程,如血管生成、组织重塑、伤口愈合和抗炎,并高表达抗炎性细胞因子IL-10和低表达IL-12,其主要由典型的Th2细胞因子诱导产生,如IL-4、IL-13、糖皮质激素和M-CSF等[11]。此外,M2型巨噬细胞表达典型的M2标记物,如人类的甘露糖受体、清道夫受体、Stabilin-1、CCL18和小鼠的Arg-1,且其可由不同的信号诱导活化成不同的亚型:IL-4和IL-13诱导的M2a型、免疫复合物和Toll样受体激动剂诱导的M2b型以及糖皮质激素和IL-10诱导的M2c型。
虽然M1型和M2型巨噬细胞在肿瘤、肥胖、脓毒症等炎性疾病条件下广泛存在,但生物体内巨噬细胞的极化是一个非常复杂的过程[1]。由于巨噬细胞具有多样性和可塑性,生物体内的巨噬细胞可能经常以不同比例的2种表型同时存在。而且,在免疫应答或病理过程中,巨噬细胞可从一个表型转换成另一表型。因此,一个更合理的说法是,M1型和M2型是病理生理条件下巨噬细胞可能存在的系列功能状态的2个极端[12]。
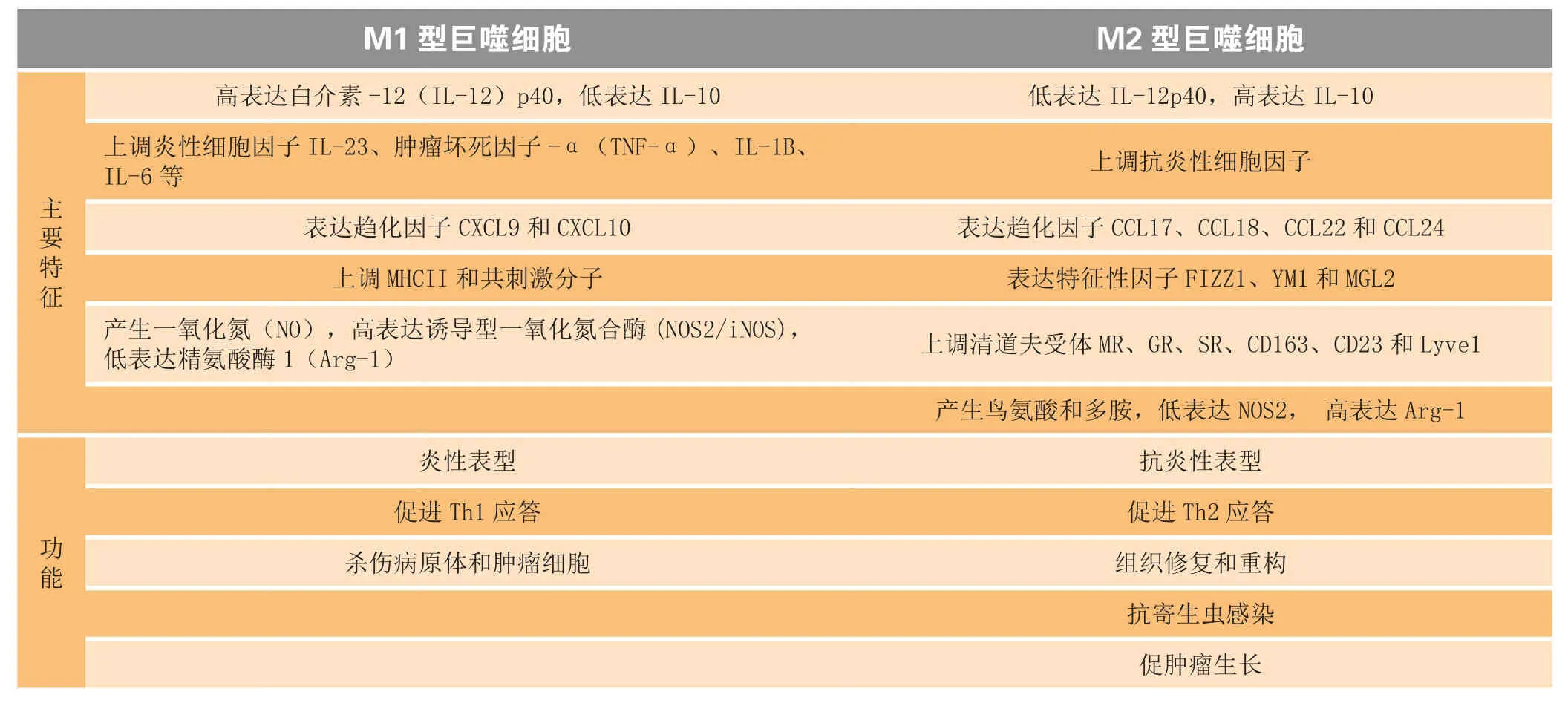
表1 M1型和M2型巨噬细胞的主要特征和功能Table 1 Major characteristics and functions of M1 and M2 macrophages
2 肿瘤相关巨噬细胞功能
如上所述,巨噬细胞表型和功能的多样性使得其具有广泛的生理活性,如参与炎症、营养功能(组织重构)和免疫调节。TAM也拥有这些功能,从而促进癌症发展的每一个标志性过程[13](见图1)。巨噬细胞是大多数实体肿瘤炎性浸润的主要成分,这一现象的发现首次证实了TAM在癌症中的作用。随后,涉及转基因调节鼠肿瘤模型中巨噬细胞数量的实验结果表明,TAM与肿瘤生长相关。例如,小鼠纤维肉瘤细胞中趋化因子CCL2的过表达可加快肿瘤的生长。类似地,在自发多瘤病毒中T癌蛋白(PyMT)诱导的乳腺癌中,CSF1基因的缺失不仅导致TAM的损耗,而且延缓肿瘤的血管生成和进展,减少其肺转移。另外,使用CSF-1 siRNA或氯膦酸盐脂质体清除小鼠肿瘤模型的全身巨噬细胞后,肿瘤的生长和(或)血管生成显著减少。下面将简单介绍TAM的各种功能。
2.1 助力癌症相关炎症
TAM通过释放炎性介质(如RNI/ROI、TNF、IL-6和IL1β)而介导的DNA损伤、致癌性转化、转化细胞的存活和癌症相关炎症,被认为是慢性炎症引起癌发生的原因。条件性敲除IKKβ(炎症主转录因子NF-κB的一个组成成分)的研究特别支持这一观点,此项研究通过敲除化学诱导的肝癌以及结肠炎诱导的结肠癌的髓系细胞中IKKβ发现,炎性细胞(巨噬细胞)通过NF-κB介导的TNF和IL-6等细胞因子的表达在促进肿瘤进展中发挥了核心作用。同样,TAM源性促炎细胞因子IL-23和Th17细胞通路参与了自发结肠癌的演进。值得一提的是,TAM产生的许多炎性细胞因子(如IL-1、IL-6、TNF)对基质细胞的募集以及肿瘤细胞的侵袭、存活和血管生成有着直接影响。无数TAM引起肿瘤相关炎症的研究结果,使得人们认识到炎症可以成为癌症的基本特征之一。
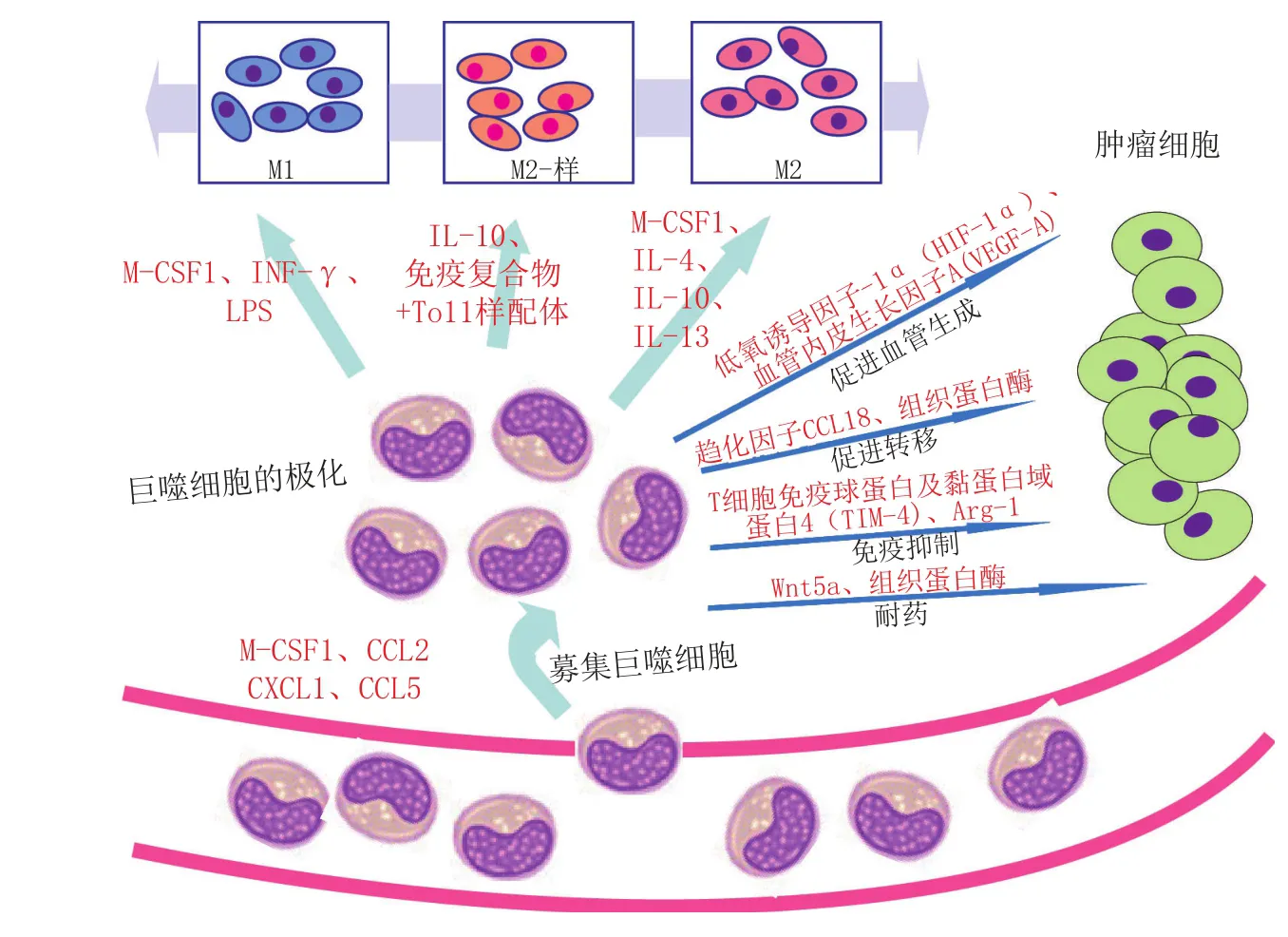
图1 肿瘤微环境招募巨噬细胞并影响其极化Figure 1` Tumor microenvironment recruits macrophages and affects their polarization
2.2 促肿瘤血管生成、侵袭和转移
除了支持癌症相关炎症,TAM还能发挥多种促肿瘤作用,如促肿瘤细胞增殖、血管生成和侵袭[14]。TAM表达多种促血管生成因子,如VEGF-A、表皮生长因子(EGF)和趋化因子CXCL8[15]。事实上,TAM被证明在与自发PyMT乳腺癌模型恶性转变相关的“血管生成开关”的驱动中起直接作用。此外,还有报道称,巨噬细胞可作为“桥梁细胞”发挥促进血管吻合和发芽的作用。在许多人类和小鼠的肿瘤中,Tie-2表达的单核细胞/巨噬细胞(TEM)已被证明具有有效的促血管生成特性[16]。这些细胞的转录分析表明,它们与TAM密切相关。与鼠TEM的促血管生成特性相一致,人血液来源的TEM表达高水平的VEGF和基质金属蛋白酶9(MMP9),并显示出促血管生成特性。而且,TAM还可以通过释放VEGF-C诱导淋巴管的生成[17-18]。
除了促血管生成,众多研究表明,TAM还可通过释放趋化因子、MMP、组织蛋白酶和尿激酶型纤溶酶原激活因子(uPA),促进癌转移。例如,在自发乳腺癌模型中,TAM的清除可以减少其肺转移。在乳腺癌中,肿瘤细胞与TAM之间的CSF1-EGF旁分泌循环涉及肿瘤细胞的侵袭和内渗[19]。最近,CCL2被证明有助于募集单核细胞/巨噬细胞到肿瘤转移部位并停留。因此,具有不同特性的巨噬细胞是肿瘤转移微环境的一个关键组成部分。在皮肤癌的自发模型中,巨噬细胞被发现是恶性进展和转移必不可少的。在胰腺癌中,TAM的高组织蛋白酶活性介导了体内肿瘤生长、血管生成和侵袭。这些发现表明,TAM参与了癌症细胞传播、播种和转移的每一步[20]。
2.3 免疫调节
来自于荷瘤动物的巨噬细胞往往表现出免疫抑制表型。例如,来自不同小鼠肿瘤(如乳腺癌、化学诱导的纤维肉瘤、卵巢癌和Lewis肺癌等)的巨噬细胞表现为促炎性细胞因子IL-12的低表达、自由基RNI和肿瘤杀伤活性的减少及抗炎性细胞因子IL-10的高表达,这种表型类似于M2状态的巨噬细胞,表明TAM本质上属于M2极化群体。有人认为,TAM中IL-12的低表达和IL-10的高表达以及转化生长因子β(TGF-β)与CCL22的上调,驱动了肿瘤的T细胞应答[21]。多种Th2型细胞因子,如IL-4、IL-13和IL-10,可诱导TAM极化成M2表型,如PyMT乳腺癌模型中CD4+T细胞释放的IL-4和IL-13。此外,来自于肿瘤细胞浸润的调节性T细胞(Treg)的IL-10可能触发TAM的PD-L1激活,这将有利于抑制肿瘤特异性T细胞免疫[22]。总之,这些研究成果支持TAM的免疫调节作用,即TAM可通过协调免疫应答和促进免疫逃避来促进肿瘤进展。
2.4 调节新陈代谢
新陈代谢是巨噬细胞表型的重要调节者,反过来,巨噬细胞也可以调节自身微环境的代谢[23-24]。低氧为肿瘤中常见的微环境条件,可诱导TAM中转录因子——HIF-1α的激活[25]。HIF-1α的激活不仅诱导了TAM中多种促肿瘤基因(如VEGF-A和IL-8的基因)的表达,更重要的是诱发了葡萄糖代谢之糖酵解途径的开关,使得TAM适应并存活于肿瘤低氧区域,发挥促肿瘤作用。虽然我们对TAM的可能有利于肿瘤进展的其他代谢变化知之甚少,但对髓源性抑制细胞(MDSC)的研究提供了这方面的直接证据。研究表明,MDSC的氨基酸代谢衍生物,如精氨酸、胱氨酸/半胱氨酸和色氨酸,有助于介导肿瘤的T细胞免疫抑制活性。在代谢水平上了解肿瘤细胞和TAM之间的串扰,对于阐明TAM对肿瘤细胞代谢的影响,是十分重要的。
2.5 影响抗肿瘤治疗响应
最近的研究表明,巨噬细胞能影响化疗的疗效和肿瘤复发[26]。这在大量移植和自发性肿瘤模型实验中都得以验证,其中有研究显示MCF7移植瘤模型中巨噬细胞的清除提高了肿瘤对联合化疗的敏感性,这是支持这一观点的最早发现。随后,对PyMT-MMTV乳腺癌的实验研究表明,TAM可限制紫杉醇的抗肿瘤疗效,而紫杉醇治疗导致的CSF-1表达的增加被认为介导了TAM募集的增多[27]。另一项移植瘤模型研究显示,经多柔比星治疗之后,CCL2表达的增加参与调节移植乳腺癌中CCR2+Gr1+髓性细胞的招募[28]。而CCR2+单核细胞的招募与肿瘤复发和化疗耐药相关。我们可以合理地认为,化疗诱导的趋化因子(如CCL2、CSF1等)以及肿瘤细胞碎片有助于TAM或其前体募集到肿瘤部位。然而,TAM限制化疗疗效的机制可能是多种多样的,如:1)抑制细胞毒性CD8+T细胞[29];2)通过巨噬细胞源性组织蛋白酶介导化学保护效应和肿瘤细胞存活[30];3)改变血管通透性,限制化疗药物输送到肿瘤;4)通过炎性体中IL-1β诱导Th17细胞活化。进一步的研究表明,TAM及其他髓系亚群(如TEM)的作用不仅限于对化疗的影响,而且还可限制其他抗癌疗法如放疗和血管靶向治疗的疗效。在这2种疗法的治疗过程中,CXCL12的增加已被证明有助于TEM的招募,而通过阻断CXCL12/CXCR4来抑制TEM的募集[31],则可以抑制肿瘤放疗后的重新血管化以及提高血管破坏药物的疗效。总的来说,这些发现打开了对TAM促肿瘤特性的新视角,突显了其对抗癌策略的限制作用。
2.6 与干细胞相互作用
TAM与干细胞的相互作用[32],已引起广泛关注。最近的一项研究表明,淋巴瘤源性的骨髓间充质干细胞(MSC)具有肿瘤促进作用,因为MSC可以通过释放CCR2配体来招募CCR2+单核细胞/TAM[33]。肿瘤源性MSC的这一作用依赖于炎性细胞因子TNF对它的激活,这不仅在自发和EL4淋巴瘤而且在B16黑色素瘤和4T1乳腺癌模型中都得到了验证[34]。
肿瘤干细胞(CSC)可以通过各种方式促进肿瘤进展,如种植型转移、化疗抵抗和肿瘤再生长的启动[35]。最近,人们开始关注TAM和CSC之间的相互作用。研究发现,来自小鼠结肠癌和肺癌的CSC能刺激TAM释放乳脂肪球表皮生长因子MFG-E8。而TAM释放的MFG-F8和IL-6被证明是抵抗化疗对CSC的作用并促进CSC致瘤性而必不可少的[36]。TAM与CSC之间的这种相互作用,在非小细胞肺癌患者的样本中也得到了验证[37]。机制研究表明,TAM是通过激活CSC中的STAT3和Sonic Hedgehog信号通路,促进了其化疗抵抗和致瘤性。这在胰腺癌实验研究中也得到验证。研究发现,TAM或炎性单核细胞的清除导致胰腺癌中肿瘤起始细胞(或CSC)的减少。而且,TAM可通过STAT3通路直接唤起胰腺癌细胞的CSC特征[38]。这些研究成果有力地支持TAM对肿瘤微环境中CSC和其他干细胞亚型(如MSC)的诱导、维持和扩张作用。
3 肿瘤相关巨噬细胞在人类癌症中的作用
目前,人们对人类癌症中TAM的了解尚有限。流行病学研究表明,在多种癌症(如乳腺癌、膀胱癌、前列腺癌等)但非所有癌症(如胃癌)中,TAM数量的增加与预后不良相关。这是支持TAM在人类癌症中发挥作用的一个主要证据。
在人卵巢癌中,巨噬细胞在癌症发展中的作用已被广泛研究[39]。研究发现,CD68+TAM是这类癌症的关键浸润细胞,而趋化因子CCL2有助于这些细胞的募集,且TNF-α依赖性下调CCL2受体,会导致CD68+TAM在肿瘤部位的保持/积累(Negus等, Am J Pathol, 1997年)。体外共培养研究显示,人类巨噬细胞对卵巢癌细胞有直接促肿瘤作用,如增强肿瘤侵袭性,反过来,这些肿瘤细胞又通过TNF-α诱导巨噬细胞极化成M2型。卵巢癌患者的活检组织研究表明存在一个TNF-α诱导的IL-17调节基因网络,而小鼠实验证实了TNF-α诱导的IL-17有助于卵巢癌中TAM的募集[40]。总之,这些研究结果表明,卵巢癌作为一种独特的人类癌症,其癌细胞与TAM及其他间质细胞之间存在相互作用。
人肝癌的肿瘤浸润性单核细胞和TAM已被详细描述。在此类癌症中,肿瘤微环境可以改变单核细胞和TAM的发展。癌旁组织中短暂的炎性表型单核细胞诱导的Th17细胞和Tc17细胞可以协同中性粒细胞诱导肿瘤侵袭和血管生成;同时,这些活化的单核细胞中B7-H1表达的上调,也可以抑制抗肿瘤T细胞应答。进一步的分析表明,在肿瘤组织中,单核细胞分化成抑制表型的TAM,从而促进Treg细胞的扩张和免疫抑制。这些发现使人们认识到,虽然这些单核细胞/巨噬细胞在人类肝癌不同区域中的表型和功能上所不同,但最终都通过不同的方式促进肿瘤发展[41]。
在乳腺癌中,TAM的浸润和巨噬细胞特异性生长因子CSF-1及趋化因子CCL2的过表达与预后不良相关。将小鼠TAM的转录谱与来自oncomine数据库的人乳腺癌基因进行基因富集分析,可发现骨桥蛋白和其他相关基因(如组织蛋白酶b和Adam8基因)在乳腺癌中的富集,而这提示了TAM浸润与癌症的不良预后相关。同样,小鼠乳腺癌中炎性Ly6C+单核细胞可成为转移相关巨噬细胞,人CD16-CD14+单核细胞(等同于Ly6C+鼠单核细胞)优先聚集到乳腺癌原位移植瘤的肺转移部位。此外,人CCL2在此类招募中的作用与鼠一致[42]。在另一项研究中,TAM表达的CCL18——一个与人巨噬细胞M2极化相关的趋化因子,被认为能促进乳腺癌转移[43]。总的来说,这些研究成果提供了越来越多的证据证明TAM在人乳腺癌中的促瘤作用,不过仍需进一步开展对TAM性能及促瘤机制的分析与研究。
对人前列腺癌的一项研究认为,整个肿瘤组织中的CD68+TAM是患者术后无病生存的一个独立预测因子。但另一项研究却得到相反结果,前列腺癌患者经激素治疗后,其中TAM较少的病人其无复发生存期显著长于那些TAM数量较多的病人[44]。此外,研究还发现,在人前列腺癌移植瘤中,CCL2通过招募巨噬细胞和破骨细胞到肿瘤部位,促进肿瘤的生长和骨转移;TAM通过IL-6和TNF的串扰,促进前列腺癌细胞在骨中的生长[45]。基于这些研究结果,尚需进一步的研究来明确TAM在前列腺癌中的作用。
研究发现,在其他泌尿系统癌症如膀胱癌和肾癌中,肿瘤源性CCL1参与CCR8+骨髓细胞的招募和增殖,而CCR8+骨髓细胞则可能通过释放炎性细胞因子和促进Treg细胞活化,支持癌症相关炎症以及免疫逃避[46]。在其他人类癌症包括肺、皮肤和脑部癌症中,TAM的贡献也是不可忽视的。
不同于大多数人类癌症,TAM的浸润与结肠癌预后呈正相关。已有研究支持这一观点,如从人大肠癌细胞球体中分离的TAM呈现抗肿瘤表型[47]。一方面,这些巨噬细胞抑制肿瘤细胞的增殖,而另一方面,它们表达促炎性细胞因子/趋化因子,从而帮助招募和促进Th1应答。这一发现,再加上肿瘤中T细胞浸润的强大预后意义,使得人们对大肠癌中TAM的抗肿瘤活性有了进一步的了解。
对人类癌症的一系列研究均表明,TAM参与了调节抗癌治疗的疗效。DeNardo等[27]研究显示,高水平的TAM和低水平的CD8+T细胞与人乳腺癌化疗效果不佳相关。与此观察一致的是,在人头颈部癌症的原位模型以及胶质母细胞瘤中,CD11b+髓样细胞有助于放疗后肿瘤的再生长。总而言之,越来越多的研究证据阐明了在人类肿瘤进展中TAM可发挥多方面的功能。
4 肿瘤相关巨噬细胞异质性及其分子基础
类似于不同组织和器官中巨噬细胞群体的异质性,根据癌症类型、分期、甚至肿瘤内的位置,TAM也显示出表型以及功能的异质性。通过一系列研究总结得到TAM的特点,即其优先发挥“营养”功能,如促肿瘤血管生成、侵袭和增殖以及抗炎细胞因子IL-10的表达,这些特性共同表明TAM呈现一种M2状态。事实上,M2特异性标记物如Arg-1、Mgl2、Fizz1和Ym1在许多TAM中皆已被观察到,而不同的肿瘤浸润性淋巴细胞(如Th2细胞、肥大细胞、Treg、B细胞等)释放的Th2细胞因子(IL-4、IL-13、IL-10等)和免疫球蛋白的复合物以及肿瘤细胞衍生因子(HMGB1、MSF、hyaluronan、CSF1、CCL2、IL-10、TNF、TGFb等)均能诱导巨噬细胞极化成M2表型,这些也被认为与细胞内信号分子如STAT3、STAT6和p50/p50 NF-κB二聚体有关。TEM是另一个M2极化的群体,特点是高表达M2标记物,如CD163、MRC1、MRC2和Arg-1。
相反地,在许多慢性炎症诱发的癌症模型像化学诱导的肝癌、结肠炎相关的结肠癌和腺瘤中,TAM呈现炎性(M1)表型。另据报道,TAM还可呈现M1和M2特征重叠的独特表型。在化学诱导的纤维肉瘤中,人们观察到M1相关趋化因子CXCL10的表达和IL-12低表达/IL-10高表达的M2表型。类似地,人卵巢癌中巨噬细胞表达高水平的促炎和抗炎细胞因子(如TNF、IL-18、TGFb1和CCL22)以及M2标记物(如甘露糖受体和清道夫受体)。在小鼠乳腺癌模型中,荷瘤小鼠的腹腔巨噬细胞呈现有缺陷的炎性细胞因子表达,但它们既不是M1表型也不是M2表型[48]。
除了上述情况之外,TAM表型异质性也体现在同一肿瘤的不同位置。在乳腺腺癌模型中,MHCII高表达的TAM定位于常氧肿瘤组织,并表达M1标记物和抗血管生成趋化因子,而MHCII低表达的TAM在低氧肿瘤组织中被发现,并优先表达M2标记物,表现出较强的促血管生成功能[49]。在人肝癌中也存在类似的情况,HLA-DR和PD1高表达的炎性TAM位于肿瘤间质,而HLA-DR和PD1低表达的抑制性TAMs位于肿瘤部位[50]。在对人乳腺癌组织的研究中发现,根据所处肿瘤内解剖位置(癌基质与癌细胞部分)的不同,TAM在癌症的发展过程中发挥相反的作用[51]。而且,研究显示,促血管生成的TEM位于肿瘤内的血管周围或无血管区[52]。肿瘤不同区域TAM的这种异质性可能归因于肿瘤内不同的微环境条件,肿瘤内可观察到不同的氧梯度,肿瘤中心区存在更多低氧区域。研究表明,低氧通过诱导不同的趋化因子/受体,如CXCR4/ CXCL12或CXCL8/CXCR8,引导TAM运动到特定位置;此外,低氧可通过转录因子HIF-1α诱导巨噬细胞极化成促肿瘤的M2表型。
鉴于以上所述,进一步表征肿瘤中多样TAM亚型的存在、它们在所处部位执行的特定功能以及调节它们聚集到这些部位的机制,是十分必要的。TAM异质性的形成还可能因为在肿瘤发展的各阶段TAM可在不同表型间相互转换所致。已有证据表明,肿瘤初期阶段的促炎性表型巨噬细胞可在肿瘤后期转变成促肿瘤或免疫抑制表型巨噬细胞,即巨噬细胞表现出瞬时可塑性。正如一项实验研究所显示,小鼠肝癌组织中TAM在肿瘤进程中可从MHCII高表达表型转变成MHCII低表达表型[53]。
5 肿瘤相关巨噬细胞是极具前景的癌症治疗靶点
鉴于在癌症进程中发挥着各种重要作用,TAM已成为潜在的肿瘤治疗靶点[54]。TAM用作抗肿瘤靶点的开发包括多个方面,如TAM的清除、阻断TAM募集至肿瘤、重新调节TAM功能使其发挥有效的抗肿瘤活性以及抑制其对癌症相关炎症的贡献。这些靶点开发策略的有效性已在一些临床前研究中被证实。其中,CSF1及其受体CSF1R已成为影响TAM数量和功能的主要研究对象[55],而IL-34作为新发现的CSF1R的配体,涉及化疗后TAM的招募及人单核细胞的M2型极化,表明它可能参与肿瘤的演进。抗CSF1R抗体与CSF1R激酶抑制剂已被开发并正在进行早期临床评价[56],这些药物的临床研究结果对TAM的研究具有十分重要的意义,但仍需谨慎评估小分子抑制剂对其他激酶产生脱靶效应的可能性[57]。
研究表明,使用脂质体-氯磷酸清除TAM的策略,可抑制各种小鼠模型中肿瘤(如畸胎癌、横纹肌肉瘤、肺癌和黑色素瘤)的生长;而且,巨噬细胞的清除可以改善对小鼠乳腺癌、人头颈部癌和宫颈癌模型的治疗效果。然而,该策略的主要缺点是不能特异性清除TAM而不影响其他组织巨噬细胞。
CCL2大多由各种实体肿瘤分泌。最近的研究表明,使用CCL2抗体或基因敲除方式阻断炎性单核细胞和TAM的招募,能够抑制小鼠乳腺癌的肺转移;抑制NF-κB,重塑TAM的抗肿瘤表型,可抑制卵巢癌和化学诱导的纤维肉瘤模型中肿瘤的生长[58]。此外,研究发现,在乳腺癌模型中,炎性试剂如CpG连同抗IL-10受体,可诱导TAM从M2表型转换成M1表型以及树突状细胞(DC细胞)的激活,导致肿瘤抑制[59];在胰腺癌小鼠模型和人类患者中,应用CD40激动性抗体治疗,可增强TAM细胞毒活性,并改善患者对化疗的敏感性[60]。新近的研究还表明,适应性免疫细胞不存在的情况下,自然杀伤细胞(NK细胞)源性的IFN-γ可驱动TAM到M1状态,使其成为肿瘤免疫的效应器;CD40激动剂可以驱动Rag-/-γc-/-小鼠TAM的M1型极化和肿瘤免疫的恢复[60]。
IL-12是与M1型巨噬细胞相关的关键细胞因子,具有触发NK细胞的活化、CD4+Th1细胞的产生和细胞毒性CD8+T细胞应答等抗肿瘤活性。在Lewis肺癌模型中,IL-12的治疗可使不同组织和原发肿瘤中的TAM从肿瘤支持表型变成促炎与促免疫表型,有助于抗肿瘤反应的提高和肿瘤缩小。而TAM释放的IL-15被认为是IL-12介导抗肿瘤效应的关键因子[61]。而且,最近有研究指出,宿主产生的富含组氨酸的糖蛋白可促使TAM从M2表型转换到M1表型,从而促进抗肿瘤免疫应答、血管正常化和化疗敏感性,并能抑制肿瘤生长和转移。此外,TAM表达的PD-L1/B7-H1已被证明是解除肝癌T细胞抗肿瘤反应的关键机制,且这一通路在其他人类癌症中的类似作用推动了针对这一通路的单克隆抗体的临床开发[62]。
因为TAM可以通过Fc受体被激活,从而促进肿瘤的生长,应用治疗性抗体可能具有脱靶效应。研究发现,HER2单克隆抗体可在小鼠乳腺癌中诱导骨髓细胞介导的细胞毒性,而联合应用CD20和CD47抗体,可以提高CD20抗体对非霍奇金淋巴瘤的治疗效果,这一协同作用可能是通过激活了Fc受体依赖的吞噬作用而发挥作用[63-64]。
此外,TAM聚集到肿瘤的能力也可被用于传递细胞毒性药物,以杀死肿瘤[65]。在移植和自发性肿瘤模型中,通过转基因方法表达IFN-α的TEM被证明能有效诱导抗肿瘤和抗血管生成作用。同样,人巨噬细胞能特异性传递溶瘤病毒到肿瘤低氧区域,从而抑制人前列腺癌移植瘤化疗后再生长[66]。
上述研究结果表明,靶向TAM疗法是癌症治疗的潜在策略。然而,正确治疗策略的确定将取决于想要靶向的特异性肿瘤类型和发展阶段中TAM的作用以及合适治疗药物的应用。对不同癌症之间以及小鼠和人类之间TAM作用的差异或相似之处的深入研究,对于靶向TAM疗法进一步应用于临床至关重要。
最近,针对在欧洲获准用于肉瘤和卵巢癌临床使用的海洋来源化疗药物的作用方式的一项研究表明,靶向巨噬细胞疗法的确可以产生临床疗效。出乎意料的是,研究发现,在4种小鼠肿瘤模型中,曲贝替定对单核细胞和巨噬细胞具有选择性毒性,而对中性粒细胞和淋巴细胞无影响。而有趣的是,体外抵抗曲贝替定细胞毒性作用的小鼠和人肿瘤细胞系却仍保留着对曲贝替定抗肿瘤作用的敏感性,该效应与巨噬细胞的损耗相关,并且可通过注入巨噬细胞逆转。曲贝替定对巨噬细胞的作用机制尚未完全确定,但似乎涉及死亡受体Fas家族成员TRAIL受体的激活。临床研究显示,经曲贝替定治疗的肉瘤患者表现为血液中单核细胞和TAM的减少[67]。因此,这项研究可能提供了首个临床概念验证,即靶向TAM疗法有利于人类癌症的治疗(见图2)。
6 结语和展望
自从20世纪70年代明确了TAM是真正的宿主细胞而不是肿瘤细胞以来,有关肿瘤中TAM的作用和重要性的研究已取得长足进展。至今的研究表明,TAM可以对肿瘤生长产生双重影响,这取决于TAM所处肿瘤部位和发展阶段以及适当和有效的T细胞应答的发生与起源的组织。此外,巨噬细胞作为癌症相关炎症的一个关键组成部分,是目前描述癌症基本特征的一部分。然而,TAM与肿瘤间尚有诸多关键问题有待澄清:1)随着单核吞噬细胞谱系研究取得新进展,肿瘤(尤其人类癌症)中巨噬细胞的来源和维持水平(招募与增殖)的机制需要重新考察、研究与认识;2)不同组织所产生的肿瘤和同一肿瘤中TAM的多样性,提出了潜在的分子机制问题;3)多样化的作用途径,包括抗体和IL-4/IL-13的作用,可以推动巨噬细胞发挥M2样促瘤作用,但巨噬细胞真的能代表癌症促进炎症的最终共同通路吗?肿瘤内部或之间TAM的多样性如何促进不同癌症的发生发展?4)尽管普遍认为TAM与肿瘤预后不良相关,但也有例外,如结直肠癌,目前还不清楚这种差异是否反映了内在的组织特性、宿主适应性免疫应答或不同治疗方案的调节和影响;5)尽管早已知道高水平TAM与许多人类肿瘤的预后不良相关,但并未将TAM的评估作为一个确定的、广泛使用的标准用于病理分级,尚需一系列针对人类癌症中大而明确定义的TAM群体的研究来解决这个关键问题。
我们可以合理推测,详细分析TAM的功能多样性,对于定制针对人类癌症的抗巨噬细胞或巨噬细胞激活策略至关重要。鉴于最新研究表明靶向作用于TAM是一个批准用于肉瘤和卵巢癌治疗的抗癌药物发挥抗肿瘤活性的一个重要组成部分,而且通过对TAM在这些肿瘤中的作用的剖析,激励了人们对以TAM为靶标的诊断和治疗策略的开发。
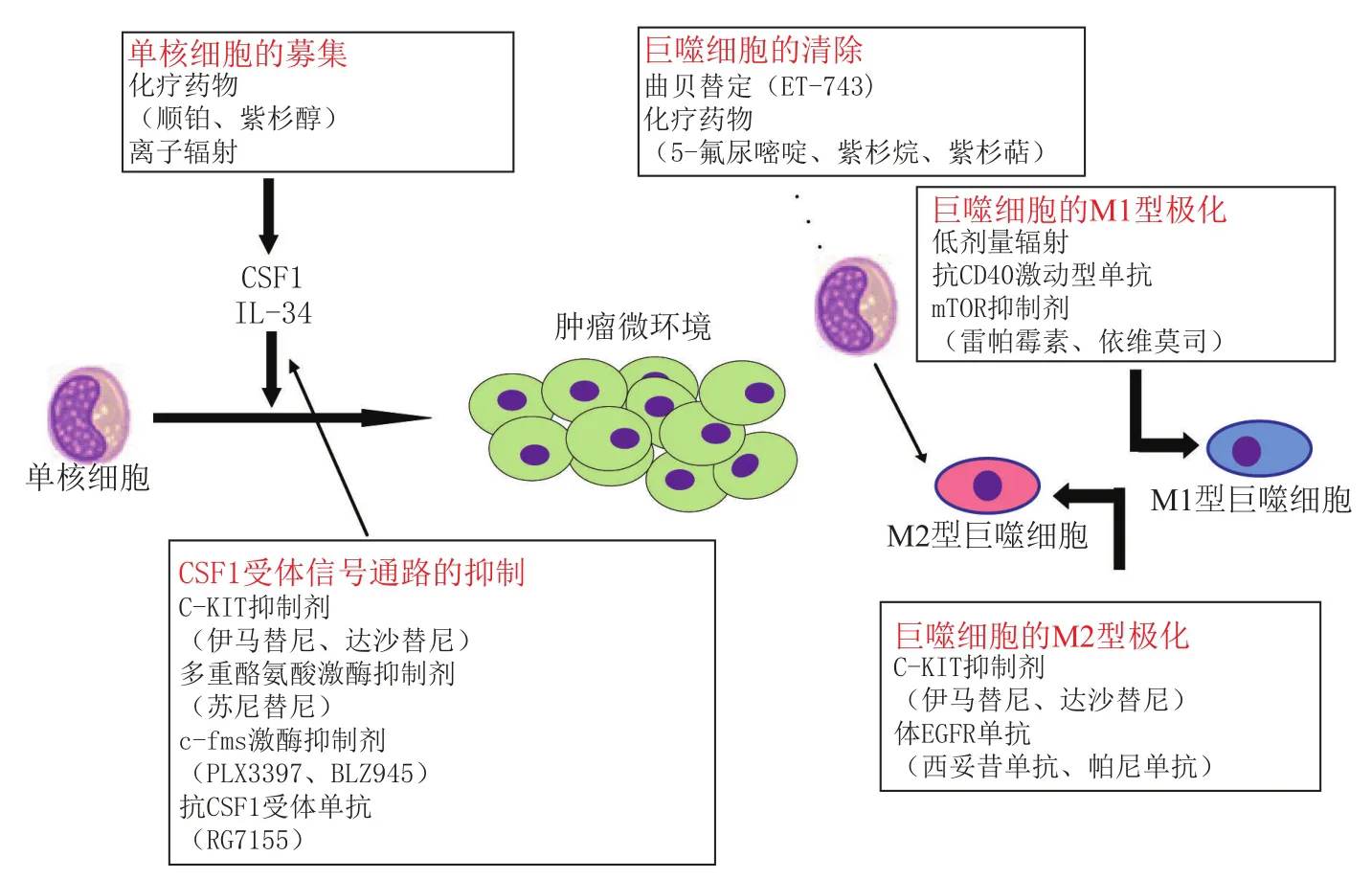
图2 各种抗肿瘤疗法对TAM的作用Figure 2 Effects of various anti-tumor therapies on TAMs
[1]Ribatti D, Moschetta M, Vacca A.Macrophages in multiple myeloma[J]. Immunol Lett ,2014, 161(2): 241-244.
[2]Raisch J, Rolhion N, Dubois A, et al.Intracellular colon cancerassociated Escherichia coli promote protumoral activities of human macrophages by inducing sustained COX-2 expression[J]. Lab Invest ,2015, 95(3): 296-307.
[3]Lanciotti M, Masieri L, Raspollini M R, et al. The role of M1 and M2 macrophages in prostate cancer in relation to extracapsular tumor extension and biochemical recurrence after radical prostatectomy[J]. BioMed Res Int , 2014, 2014: 486798.
[4]Rothwell P M, Wilson M, Price J F, et al. Effect of daily aspirin on risk of cancer metastasis: a study of incident cancers during randomised controlled trials[J]. Lancet , 2012, 379(9826): 1591-1601.
[5]Rothwell P M, Price J F, Fowkes F G, et al.Short-term effects of daily aspirin on cancer incidence, mortality, and non-vascular death: analysis of the time course of risks and benefits in 51 randomised controlled trials[J]. Lancet , 2012, 379(9826): 1602-1612.
[6]Zhang Q W, Liu L, Gong C Y, et al.Prognostic significance of tumorassociated macrophages in solid tumor: a meta-analysis of the literature[J]. PLoS One , 2012, 7(12): e50946.
[7]Bashir S, Sharma Y, Elahi A, et al. Macrophage polarization: the link between inflammation and related diseases[J]. Inflamm Res,2015,doi:10.1007/s 00011-015-0847-1.
[8]Alfano M, Graziano F, Genovese L, et al. Macrophage polarization at the crossroad between HIV-1 infection and cancer development[J]. Arterioscler,Thromb Vasc Biol, 2013, 33(6): 1145-1152.
[9]Almendros I, Gileles-Hillel A, Khalyfa A, et al. Adipose tissue macrophage polarization by intermittent hypoxia in a mouse model ofOSA: effect of tumor microenvironment[J]. Cancer Lett, 2015, 361(2): 233-239.
[10]Hume D A.The many alternative faces of macrophage activation[J]. Front Immunol, 2015, 6: 370.
[11]Muraille E, Leo O, Moser M.TH1/TH2 paradigm extended: macrophage polarization as an unappreciated pathogen-driven escape mechanism?[J]. Front Immunol, 2014, 5: 603.
[12]Sica A, Mantovani A: Macrophage plasticity and polarization: in vivo veritas[J]. J Clin Invest, 2012, 122(3): 787-795.
[13]Kumar A, Kant S, Singh S M. Antitumor and chemosensitizing action of dichloroacetate implicates modulation of tumor microenvironment: a role of reorganized glucose metabolism, cell survival regulation and macrophage differentiation[J]. Toxicol Appl Pharmacol,2013, 273(1): 196-208.
[14]Chauhan V P, Stylianopoulos T, Martin J D, et al. Normalization of tumour blood vessels improves the delivery of nanomedicines in a sizedependent manner[J]. Nat Nanotechnol, 2012, 7(6): 383-388.
[15]Lee M M, Chui R K, Tam I Y, et al.CCR1-mediated STAT3 tyrosine phosphorylation and CXCL8 expression in THP-1 macrophage-like cells involve pertussis toxin-insensitive Galpha(14/16) signaling and IL-6 release[J]. J Immunol, 2012, 189(11): 5266-5276.
[16]Zhao J, Chen L, Shu B, et al. Granulocyte/macrophage colonystimulating factor influences angiogenesis by regulating the coordinated expression of VEGF and the Ang/Tie system[J]. PLoS One, 2014, 9(3): e92691.
[17]Lu P, Li L, Liu G, et al. Critical role of TNF-alpha-induced macrophage VEGF and iNOS production in the experimental corneal neovascularization[J]. Invest Ophthalmol Vis Sci, 2012, 53(7): 3516-3526.
[18]Liao C C, Ho M Y, Liang S M, et al. Recombinant protein rVP1 upregulates BECN1-independent autophagy, MAPK1/3 phosphorylation and MMP9 activity via WIPI1/WIPI2 to promote macrophage migration[J]. Autophagy, 2013, 9(1): 5-19.
[19]Laoui D, Van Overmeire E, De Baetselier P, et al. Functional relationship between tumor-associated macrophages and macrophage colony-stimulating factor as contributors to cancer progression[J]. Front Immunol, 2014, 5: 489.
[20]Qian B Z, Pollard J W.Macrophage diversity enhances tumor progression and metastasis[J].Cell, 2010, 141(1): 39-51.
[21]Yang P, Li Q J, Feng Y,et al. TGF-beta-miR-34a-CCL22 signalinginduced Treg cell recruitment promotes venous metastases of HBV-positive hepatocellular carcinoma[J]. Cancer Cell, 2012, 22(3):291-303.
[22]Herold M, Posevitz V, Chudyka D, et al. B7-H1 selectively controls TH17 differentiation and central nervous system autoimmunity via a novel non-PD-1-mediated pathway[J].J Immunol, 2015, 195(8): 3584-3595.
[23]Biswas S K, Mantovani A.Orchestration of metabolism by macrophages[J]. Cell Metab, 2012, 15(4): 432-437.
[24]Bosca L, Gonzalez-Ramos S, Prieto P, et al. Metabolic signatures linked to macrophage polarization: from glucose metabolism to oxidative phosphorylation[J]. Biochem Soc Trans, 2015, 43(4):740-744.
[25]Mu L, Wang J, Chen Y,et al. Hypoxia-inducible factor-1alpha and semaphorin4D genes involved with tumor-associated macrophage-induced metastatic behavior and clinical significance in colon cancer[J]. Chin Med J : Eng Ed, 2014, 127(20): 3568-3575.
[26]Zhang X, Meng A, Wang H, et al. High serum macrophage inflammatory protein-3alpha is associated with the early recurrence or metastasis of non-small cell lung cancer following primary pulmonary resection[J]. Oncol Lett, 2014, 8(2): 948-952.
[27]DeNardo D G, Brennan D J, Rexhepaj E, et al. Leukocyte complexity predicts breast cancer survival and functionally regulates response to chemotherapy[J]. Cancer Discov,2011, 1(1): 54-67.
[28]Nakasone E S, Askautrud H A, Kees T, et al. Imaging tumor-stroma interactions during chemotherapy reveals contributions of the microenvironment to resistance[J]. Cancer Cell, 2012, 21(4): 488-503.
[29]Mitchem J B, Brennan D J, Knolhoff B L, et al. Targeting tumorinfiltrating macrophages decreases tumor-initiating cells, relieves immunosuppression, and improves chemotherapeutic responses[J]. Cancer Res,2013, 73(3): 1128-1141.
[30]Shree T, Olson O C, Elie B T, et al. Macrophages and cathepsin proteases blunt chemotherapeutic response in breast cancer[J]. Genes Dev, 2011, 25(23): 2465-2479.
[31]Richardson P J. CXCR4 and Glioblastoma[J]. Anti-cancer Agents Med Chem, 2015, 16(1): 59-74.
[32]Mantovani A.MSCs, macrophages, and cancer: a dangerous ménage-àtrois[J]. Cell Stem Cell , 2012, 11(6):730-732.
[33]Ren G, Zhao X, Wang Y, et al. CCR2-dependent recruitment of macrophages by tumor-educated mesenchymal stromal cells promotes tumor development and is mimicked by TNFalpha[J]. Cell Stem Cell,2012, 11(6): 812-824.
[34]Lu W, Tang Y, Zhang Z, et al.Inhibiting the mobilization of Ly6C(high)monocytes after acute myocardial infarction enhances the efficiency of mesenchymal stromal cell transplantation and curbs myocardial remodeling[J]. Am J Transl Res, 2015, 7(3): 587-597.
[35]Guo W.Concise review: breast cancer stem cells: regulatory networks,stem cell niches, and disease relevance[J]. Stem Cells Translational Med,2014, 3(8): 942-948.
[36]Jinushi M, Chiba S, Yoshiyama H, et al. Tumor-associated macrophages regulate tumorigenicity and anticancer drug responses of cancer stem/ initiating cells[J]. Proc Natl Acad Sci USA, 2011, 108(30): 12425-12430.
[37]Modiano J F, Lindborg B A, McElmurry R T, et al.Mesenchymal stromal cells inhibit murine syngeneic anti-tumor immune responses by attenuating inflammation and reorganizing the tumor microenvironment[J]. Cancer Immunol Immunother, 2015, 64(11): 1449-1460.
[38]Sharma N, Nanta R, Sharma J, et al. PI3K/AKT/mTOR and sonic hedgehog pathways cooperate together to inhibit human pancreatic cancer stem cell characteristics and tumor growth[J]. Oncotarget, 2015,6(31): 32039-32060.
[39]Busuttil R A, George J, Tothill R W,et al.A signature predicting poor prognosis in gastric and ovarian cancer represents a coordinated macrophage and stromal response[J]. Clin Cancer Res,2014, 20(10): 2761-2772.
[40]Deng X, Zhang P, Liang T, et al.Ovarian cancer stem cells induce the M2 polarization of macrophages through the PPARgamma and NF-kappaB pathways[J]. Int J Mol Med, 2015, 36(2): 449-454.
[41]Zhou J, Ding T, Pan W, et al.Increased intratumoral regulatory T cells are related to intratumoral macrophages and poor prognosis in hepatocellular carcinoma patients[J]. Int J Cancer, 2009, 125(7): 1640-1648.
[42]Qian B Z, Li J, Zhang H, et al. CCL2 recruits inflammatory monocytes to facilitate breast-tumour metastasis[J]. Nature, 2011, 475(7355): 222-225.
[43]Lin X, Chen L, Yao Y, et al. CCL18-mediated down-regulation of miR98 and miR27b promotes breast cancer metastasis[J]. Oncotarget, 2015, 6(24): 20485-20499.
[44]Nonomura N, Takayama H, Nakayama M, et al. Infiltration of tumourassociated macrophages in prostate biopsy specimens is predictive of disease progression after hormonal therapy for prostate cancer[J]. BJU Int,2011, 107(12): 1918-1922.
[45]Lee G T, Kwon S J, Lee J H, et al.Macrophages induce neuroendocrine differentiation of prostate cancer cells via BMP6-IL6 Loop[J]. Prostate,2011, 71(14): 1525-1537.
[46]Eruslanov E, Stoffs T, Kim W J, et al.Expansion of CCR8+inflammatory myeloid cells in cancer patients with urothelial and renal carcinomas[J]. Clin Cancer Res, 2013, 19(7): 1670-1680.
[47]Ong S M, Tan Y C, Beretta O, Jet al. Macrophages in human colorectal cancer are pro-inflammatory and prime T cells towards an anti-tumour type-1 inflammatory response[J]. Eur J Immunol, 2012, 42(1): 89-100.
[48]Torroella-Kouri M, Silvera R, Rodriguez D, et al.Identification of a subpopulation of macrophages in mammary tumor-bearing mice that are neither M1 nor M2 and are less differentiated[J]. Cancer Res, 2009,69(11): 4800-4809.
[49]Movahedi K, Laoui D, Gysemans C, et al.Different tumor microenvironments contain functionally distinct subsets of macrophages derived from Ly6C(high) monocytes[J]. Cancer Res, 2010, 70(14): 5728-5739.
[50]Nakanjako D, Ssewanyana I, Mayanja-Kizza H, et al.High T-cell immune activation and immune exhaustion among individuals withsuboptimal CD4 recovery after 4 years of antiretroviral therapy in an African cohort[J]. BMC Infect Dis, 2011, 11: 43.
[51]Medrek C, Ponten F, Jirstrom K, et al.The presence of tumor associated macrophages in tumor stroma as a prognostic marker for breast cancer patients[J]. BMC Cancer, 2012, 12: 306.
[52]Mazzieri R, Pucci F, Moi D, et al.Targeting the ANG2/TIE2 axis inhibits tumor growth and metastasis by impairing angiogenesis and disabling rebounds of proangiogenic myeloid cells[J]. Cancer Cell, 2011, 19(4): 512-526.
[53]Wang B, Li Q, Qin L, et al. Transition of tumor-associated macrophages from MHC class II(hi) to MHC class II(low) mediates tumor progression in mice[J]. BMC Immunol, 2011, 12: 43.
[54]Ben-Nun Y, Merquiol E, Brandis A, et al.Photodynamic quenched cathepsin activity based probes for cancer detection and macrophage targeted therapy[J]. Theranostics, 2015, 5(8): 847-862.
[55]Escamilla J, Schokrpur S, Liu C, et al.CSF1 receptor targeting in prostate cancer reverses macrophage-mediated resistance to androgen blockade therapy[J]. Cancer Res, 2015, 75(6):950-962.
[56]Hamilton J A, Achuthan A.Colony stimulating factors and myeloid cell biology in health and disease[J]. Trends Immunol, 2013, 34(2): 81-89.
[57]Korbelik M, Hamblin M R.The impact of macrophage-cancer cell interaction on the efficacy of photodynamic therapy[J]. Photochem Photobiol Sci, 2015, 14(8): 1403-1409.
[58]Thompson W L, Van Eldik L J. Inflammatory cytokines stimulate the chemokines CCL2/MCP-1 and CCL7/MCP-3 through NFkB and MAPK dependent pathways in rat astrocytes [corrected] [J]. Brain Res, 2009,1287: 47-57.
[59]Guiducci C, Vicari A P, Sangaletti S, et al.Redirecting in vivo elicited tumor infiltrating macrophages and dendritic cells towards tumor rejection[J]. Cancer Res, 2005, 65(8): 3437-3446.
[60]Beatty G L, Chiorean E G, Fishman M P, et al.CD40 agonists alter tumor stroma and show efficacy against pancreatic carcinoma in mice and humans[J]. Science, 2011, 331(6024): 1612-1616.
[61]Tefferi A, Vaidya R, Caramazza D, et al.Circulating interleukin (IL)-8,IL-2R, IL-12, and IL-15 levels are independently prognostic in primary myelofibrosis: a comprehensive cytokine profiling study[J]. J Clin Oncol, 2011, 29(10): 1356-1363.
[62]Topalian S L, Drake C G, Pardoll D M.Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity[J]. Curr Opin Immunol, 2012, 24(2): 207-212.
[63]Chao M P, Alizadeh A A, et al.Anti-CD47 antibody synergizes with rituximab to promote phagocytosis and eradicate non-Hodgkin lymphoma[J]. Cell, 2010, 142(5): 699-713.
[64]Bodogai M, Lee-Chang C, Wejksza K, et al.Anti-CD20 antibody promotes cancer escape via enrichment of tumor-evoked regulatory B cells expressing low levels of CD20 and CD137L[J]. Cancer Res, 2013,73(7): 2127-2138.
[65]Peng Y, Yao W, Wang B, et al.Mannosylated chitosan Nanoparticles Based Macrophage-Targeting Gene Delivery System Enhanced Cellular Uptake and Improved Transfection Efficiency[J]. J Nanosci Nanotechnol, 2015, 15(4): 2619-2627.
[66]Garcia S, Krausz S, Ambarus C A, et al. Tie2 signaling cooperates with TNF to promote the pro-inflammatory activation of human macrophages independently of macrophage functional phenotype[J]. PLoS One, 2014,9(1): e82088.
[67]Germano G, Frapolli R, Belgiovine C, et al. Role of macrophage targeting in the antitumor activity of trabectedin[J]. Cancer Cell, 2013,23(2): 249-262.

[本期栏目主编介绍] 杨波 :女,1998年毕业于中国科学院上海药物研究所,获博士学位。现任浙江大学药学院院长,浙江大学求是特聘教授,国家重大科技专项(重大新药创制药效学平台)首席专家,中国抗癌协会抗癌药物专业委员会常委,CFDA药品评审中心新药评审专家,《药学进展》编委。多年来致力于抗肿瘤小分子化合物对肿瘤缺氧微环境关键蛋白的翻译后修饰调控研究,并进一步探索抗肿瘤新靶点,研发新型小分子候选药物。主持国家自然科学基金、国家重大新药创制专项、国家国际科技合作专项、教育部协同创新中心药效平台等国家级科研项目10项,在Cancer Research、Autophagy、Clinical Cancer Research等国际知名刊物发表SCI论文150余篇,获授权发明专利19项。获教育部科技进步二等奖和浙江省科技进步二等奖等奖项。
Tumor-associated Macrophages: Critical Role in Tumor Progression and a Potential Antitumor Target
DONG Rong, YUAN Meng, YING Meidan, CAO Ji, YANG Bo
(Zhejiang Province Key Laboratory of Anti-Cancer Drug Research, Institute of Pharmacology and Toxicology, School of Pharmaceutical Sciences, Zhejiang University, Hangzhou 310058,China )
Inflammation is recognized as one of the ten main characteristics of tumors. Tumor associated macrophages (TAMs) are a large component of the tumor microenvironment, which affect tumor growth, angiogenesis, immune suppression, metastasis and chemoresistance. It has been recently suggested that TAMs also affect the clinical efficacy of antitumor therapy. In view of the fact that TAMs play an important role in tumor progression, TAMs as a potential antitumor target have received much attention. Based on the latest researches, the main functions, effects and characteristics of TAMs and their potential as a novel antitumor target were reviewed.
tumor-associated macrophage; tumor progression; imflammtion; cytokine; macrophage polarization; antitumor target
R966; R962
A
1001-5094(2015)10-0723-11
接受日期:2015-09-17
项目资助:国家自然科学基金(No.81473226)
*通讯作者:杨波,教授,博士生导师;
研究方向:肿瘤药理学;
Tel:0571-88208400; E-mail:yang924@zju.edu.cn

