姜黄素对apoE-/-小鼠抗氧化能力和血脂水平的影响
欧海龙 张庆海
(贵阳医学院基础医学院,贵州 贵阳 550025)
姜黄素是姜黄科植物的地下根部所含的一种色素,属于脂溶性多酚类化合物。姜黄素可抑制炎症反应、抗氧化和清除自由基等多种生物活性,除了具有药用价值外,还被用于制备调味品、食品添加剂等。体内脂质代谢紊乱,使过多的脂质沉积在血管内壁,并在各种炎症反应的作用下,形成动脉粥样硬化。ApoE基因敲除的纯合小鼠(apoE-/-)可正常存活和繁殖,当给予适当的高脂饮食时,可导致各种高脂蛋白血症,常用于动脉粥样硬化相关的病理和药理研究[1-4]。本研究以我们前期成功建立的动脉粥样硬化apoE-/-模型小鼠为实验动物[5],给予不同剂量的姜黄素处理,检测小鼠体内血清、肝脏的超氧化物歧化酶(SOD)的活性和丙二醛(MDA)的含量,以及各种血脂蛋白水平变化,分析姜黄素在动脉粥样硬化小鼠体内的抗氧化反应和血脂质代谢的影响。
1 资料与方法
1.1 试剂和仪器 小鼠基础饲料由贵阳医学院动物中心提供;尹红、苏木素购自北京赛弛生物公司;油红O 购自北京鼎国生物公司;低密度脂蛋白胆固醇(LDL-C)检测试剂盒购自南京建成生物公司;其余试剂均为国产分析纯。
1.2 试验动物 C57BL/6 纯系背景的载脂蛋白E基因敲除小鼠(apoE-/-)购自南京大学模式动物研究所,引种协议(2012)470 号。动物饲养环境条件为室温20~25 ℃,相对湿度40%~70%。对6 周龄左右的apoE-/-雄性小鼠进行高脂肪饲料喂养(21.5%脂肪和0.15%胆固醇),喂食8周后每天分别用低、中、高剂量(50、100、200mg/kg 体质量)的姜黄素对体质量为25~30g的小鼠进行灌胃,每组8只小鼠被分别连续处理4、8和12周。实验结束后,解剖并抽取静脉血和肝脏用于下一步实验。
1.3 体内抗氧化酶活性测定 取肝脏组织加入10倍体积的生理盐水,在冰浴中制成组织匀浆,以5 000rpm/min离心10 min,取上清液进行相关指标的测定,其中通过羟胺法测定SOD 活性、硫代巴比安酸(TBA)比色法测定MDA 的含量、钼酸铵法测CAT 活性,具体方法参考南京建成生物公司提供的操作说明。
1.4 血脂水平的检测方法 血清总胆固醇(TC)、甘油三脂(TG)水平的测定分别采用胆固醇氧化酶法(COD-PAP)及磷酸甘油氧化酶法(GPO-PAP),最后通过分光光度计在500nm 测得吸收值。LDLC测定所用试剂和方法均按照南京建成试剂盒说明书进行操作。
1.5 统计学处理 采用SPSS 11.5 统计软件,试验结果用(±s)表示,各组均数间差异用t检验。
2 结果
2.1 姜黄素对小鼠血清和肝脏SOD、CAT 活力以及MDA 含量的影响 apoE-/-小鼠经高脂饮食诱导8周后,每天用不同剂量(50、100、200mg/kg 体质量)姜黄素进行灌胃处理,8周后分别检测血清和肝脏的与氧化应激能力相关的酶如SOD 和CAT的活性以及脂质氧化的终产物CAT 的含量。结果发现经不同浓度的姜黄素处理后血清中SOD 水平与空白对照组比较上升较为明显,低剂量组就可表现出显著差异(P<0.05)。CAT 和MDA 在中剂量组和高剂量组的变化水平均有显著(P<0.05),其中高剂量组比原来提高了37%。而肝脏中SOD 在中、高剂量组中,与对照组比较上升较为显著,CAT和MDA 只在中剂量和高剂量处理后,才表现出显著差异(P<0.05)。见表1。
表1 姜黄素对apoE-/-小鼠血清及肝脏中各抗氧化指标的影响(±s,n=8)
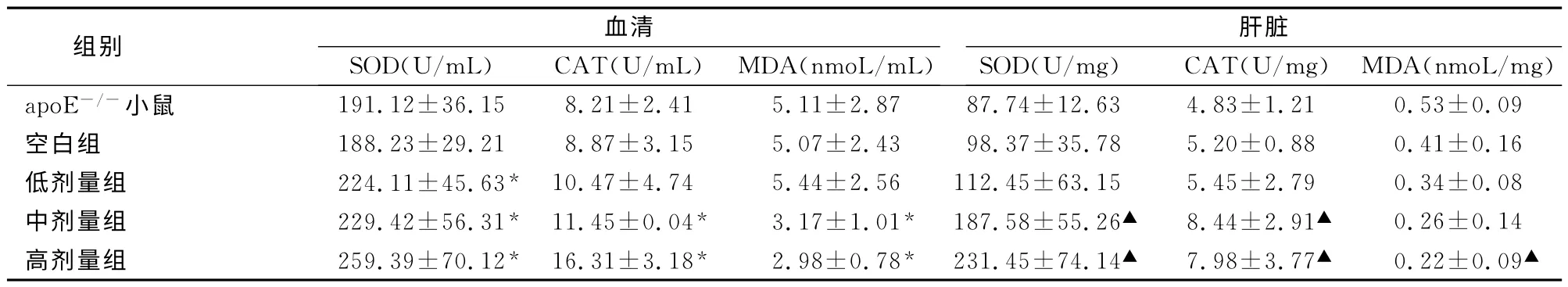
表1 姜黄素对apoE-/-小鼠血清及肝脏中各抗氧化指标的影响(±s,n=8)
注:与空白组比较,*P<0.05;与空白组比较,▲P<0.05。
2.2 不同时期姜黄素处理后血脂水平 apoE-/-小鼠在高脂饲料饮食诱导4、8和12周后,取静脉血并分别进行TC、TG 和LDL-C水平检测,分析经不同时期姜黄素后血脂代谢情况。结果显示总体上经姜黄素处理后,各血脂水平均呈下降趋势,而且表现出剂量依赖性。在处理时间上,连续灌胃4 周和8周后的结果相差较大,而8 周和12 周的区别并不大。在各种血脂中,TC 水平下降较为明显,在中剂量组(8周、12 周)均可达到显著水平(P<0.05)。而TG 以及LDL-C水平,尽管也随着剂量的加大也逐渐降低,但只有在高剂量时(8周、12周)才都具有显著水平(P<0.05)。见表2。
表2 姜黄素的不同时期处理对apoE-/-小鼠血清总胆固醇、LDL-C及甘油三酯水平的影响(±s,n=8)(mmol/L)
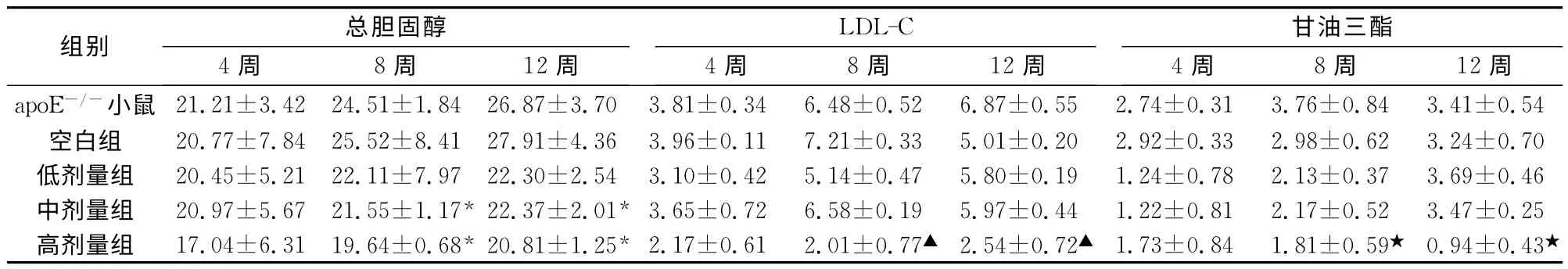
表2 姜黄素的不同时期处理对apoE-/-小鼠血清总胆固醇、LDL-C及甘油三酯水平的影响(±s,n=8)(mmol/L)
注:与空白组比较,*P<0.05;与空白组比较,▲P<0.05;与空白组比较,★P<0.05。
3 讨论
自由基是机体氧化反应过程中产生的一类强氧化性化合物。不断积累的自由基诱发体内细胞的氧化损伤、损害机体组织,诱发各种慢性疾病如动脉粥样硬化。生物体内的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等各种抗氧化酶,均可清除自由基、减少体内过氧化脂质、丙二醛(MDA)等的生成,其活性的高低常被用于衡量机体的氧化程度[6-8]。
血清中TG、TC和LDL-C的水平过高,容易沉积在血管壁上,逐渐发展为斑块,是动脉粥样硬化的重要危险因素之一。在本研究中发现,经姜黄素处理后TG、TC、LDL-C水平均可不同程度地下降,说明姜黄素具有降低血脂,抗动脉粥样硬化的功能。
之前的药理学研究发现,姜黄素对其他一些疾病如糖尿病、帕金森病和肿瘤等的发生与发展有抑制作用[9-13]。邹伟等[10]将姜黄素和肿瘤坏死因子相关凋亡诱导配体联合使用,发现可以明显增强前列腺癌细胞抑制效果和诱导凋亡作用。Marquardt等[11]证明姜黄素可以通过下调NF-kB 信号活性,抑制肿瘤干细胞的增值并限制其“干性”。郑昌健等[12]认为姜黄素能减轻2型糖尿病大鼠神经病理性疼痛,而且这可能与JNK/MCP-1信号通路有关。李晓波等[13]则利用姜黄素对6-羟基多巴胺诱导的帕金森病模型小鼠进行处理,发现其具有神经保护作用。
本研究通过对姜黄素在动脉粥样硬化模型小鼠中作用的探讨,确定姜黄素具有抗氧化应激、降低脂质水平,改善血脂代谢功能。研究结果提示姜黄素在动脉粥样硬化的防治上具有一定的功能。这对于我们开发、利用姜黄素资源具有重要的指导意义。另外,本文结果可以推断姜黄素可能通过降低体内脂质的氧化程度、从而调节脂质代谢平衡和缓解动脉粥样硬化的作用,但是这些因素之间的具体关系以及姜黄素体内作用过程中的具体分子机制还需要进一步的探索。同时,姜黄素作为一种常用的食品添加剂,其用于人体的最合适剂量以及是否具有潜在的毒性,还需要进一步了解。
[1]徐芳,刘颖,王蔚琛,等.载脂蛋白E基因敲除小鼠动脉粥样硬化早期血管外膜成纤维细胞表型转化为肌成纤维细胞[J].中国动脉 硬 化杂志,2013,21(12):1064-1068.
[2]田晋帆,葛长江,吕树铮,等.基质交感分子1在载脂蛋白E基因敲除小鼠动脉粥样硬化斑块形成中的作用[J].中华老年心脑血管病杂志,2015,17(2):183-187.
[3]Kyaw T,Winship A,Tay C,et al.Cytotoxic and proinflammatory CD8+T lymphocytes promote development of vulnerable atherosclerotic plaques in apoEdeficient mice[J].Circulation,2013,127(9):1028-1039.
[4]Grandoch M,Feldmann K,Gthert JR,et al.Deficiency in LymphotoxinβReceptor Protects From Atherosclerosis in apoE-Deficient Mice[J].Circ Res,2015,116(8):57-68.
[5]欧海龙,张礼林,何晓兰,等.ApoE-/-小鼠动脉粥样硬化模型的建立[J].生命科学研究,2015,19(2):141-144.
[6]张泽生,胡莎,邵婵,等.根皮苷对由高脂导致果蝇氧化损伤的保护作用[J].食品科技,2012,37(4):195-198.
[7]Albuali WH.Evaluation of oxidant-antioxidant status in overweight and morbidly obese Saudi children[J].World J Clin Pediatr,2014,3(1):6-13.
[8]Wang C,Wheeler CT,Alberico T,et al.The effect of resveratrol on lifespan depends on both gender and dietary nutrient composition in Drosophila melanogaster[J].Age,2013,35(1):69-81.
[9]程钥,陈淑娴,张雪,等.姜黄素对2型糖尿病肾病大鼠肾脏的保护作用[J].陕西中医,2015,36(1):115-117.
[10]邹伟,江波涛,孔东波,等.姜黄素联合肿瘤坏死因子相关凋亡诱导配体对前列腺癌细胞的抑制作用[J].2015,23(4):454-456.
[11]Marquardt JU,Gomez-Quiroz L,Arreguin Camacho LO,et al.Curcumin effectively inhibits oncogenic NFkB signaling and restrains stemness features in liver cancer[J].J Hepatol,2015,Epub ahead of print.
[12]郑昌健,胡涵,曹红,等.JNK/MCP-1信号通路在姜黄素抗糖尿病神经病理性疼痛中的作用[J].中国病理生理杂志,2014,30(11):1941-1945.
[13]李晓波,徐芳.姜黄素对6-羟基多巴胺诱导的帕金森病模型的神经保护作用及机制研究[J].中南药学,2015,13(1):34-37.

