β3-肾上腺素能受体对心室重塑大鼠钙调磷酸神经酶信号通路的调节及益气温阳活血方的干预作用
杨冬花 顾广富 罗建华
(1.贵州省人民医院干医科,贵州 贵阳 550002;2.贵阳中医学院2011级研究生,贵州 贵阳 550002)
研究[1]发现,β3-肾上腺素能受体(β3-AR)对心肌细胞Ca2+的调控可能是其在衰竭心脏发挥作用的重要机制,钙调磷酸神经酶(CaN)作为细胞内Ca2+敏感的信号物质,在心室重塑的发展中起重要作用[2]。前期工作发现益气温阳活血方通过影响心力衰竭大鼠血浆尾加压素Ⅱ、内皮素-1和肾上腺髓质素水平,防止心室重塑,改善心脏功能[3],但是否通过β3-AR 调节CaN 信号通路抑制心室重塑,目前尚不清楚。本研究通过观察β3-AR 对心室重塑大鼠CaN 信号通路的调节及益气温阳活血方的干预研究,为进一步临床运用提供理论依据。现报告如下。
1 资料与方法
1.1 材料(1)实验动物:健康Wistar雄性大鼠40只,清洁级,鼠龄5~6个月,体质量(250±10)g,由贵阳医学院实验动物学部提供,合格证号:SYSK(黔)2002-0001。(2)益气温阳活血方主要成分:人参、黄芪、丹参、益母草各30g,白术、茯苓各15g,桂枝9g等11味中药。药材予贵州省人民医院中药房一次性选购,煎药滤渣取汁在水浴中浓缩至每毫升煎液含生药4g,保存备用。
1.2 试剂 ISO(Sigma公司),卡维地洛(齐鲁制药有限公司,批号:H20000100),Trizol(Invitroge公司),引物由上海生物工程公司合成,大鼠抗人β3-AR 抗体(Abcam 公司),兔抗人CaN 抗体及兔 抗 人NFAT3抗体(Santa Crus公司),NFAT3核蛋白提取 试剂盒(EPIGENTEK组公组司),NFAT3组核组蛋组白组活性检测试剂盒(Active Motif公司),ECL 显影试剂盒(Santa Cruz公司)。
1.3 方法(1)心力衰竭的模型制备[4]:采用异丙肾上腺素腹腔注射[3mg/(kg·d)]诱导慢性心力衰竭模型。(2)动物分组及治疗:选用Wistar雄性大鼠,随机分为正常组、模型组、中药组(益气温阳活血方治疗组)、西药组(卡维地洛治疗组),每组10只,实验开始中药组和西药组分别予益气温阳活血方(8mL/kg)和卡维地洛[50mg/(kg·8mL)蒸馏水]灌胃治疗,每日2次。正常组及对照组以蒸馏水等量灌胃,共8周。试验结束后麻醉测量心脏结构和功能,抽取血浆,然后处死动物,留取心脏组织,置于-70 ℃低温冰箱中冷冻保存,以检测其他指标。(3)心脏结构及功能测定:对各组大鼠实验结束后以Agilent SONOS 5500超声仪对大鼠行超声心动图检查。分别测量左室舒张末期内径(LVDd)、左室收缩末期内经(LVDs)、左室后壁厚度(LVPW)、室间隔厚度(IVS),推算射血分数(EF%值)。EF%=(LVDd-LVDs)/左室舒张末内径×100%。(4)心肌组织β3-AR、CaN及NFAT3mRNA 的表达:β3-AR(444bp)上游5′-AGTGGG ACTCCTCGTAATG-3′,下 游5′-CGCTTAGCTACGACGAAC-3′。CaN(339 bp):上 游5′CTTTCAACCAC CTCTTCGG 3′,下游5′GCTCCATCAGCTTCA CTACCTGTCC 3′;NFAT3组引组物(382组bp):sense:5′CTACAGCAGCGTCCAGAGC 3′,antisense:5′TAGCCAACAACACCCCCACTCCCAC 3′。GAPDH(187 bp):上 游5′-GACAACGGCTCCGGCATGTG-3′,下游5′-TGAGGATGCCTCTCTTGC-3′。按Trizol试剂说明书提取左室心肌组织总RNA,参照第一链cDNA 合成试剂盒说明书进行逆转录反应,然后进行PCR反应。取PCR产物5μL进行琼脂糖凝胶电泳、照相,利用UVP凝胶扫描仪测定条带的吸光度(A)值,以目的基因与GAPDH 条带的吸光度(A)值的比值代表其表达的相对量。(5)心肌组织β3-AR、CaN及NFAT3蛋白质的表达:提取左心室组织蛋白质,制备聚丙烯酰胺凝胶、蛋白电泳、转膜。一抗浓度均为1∶1 000,二抗浓度为1∶2 000,化学发光试剂法曝光、显影和定影,凝胶成像分析系统进行密度扫描并分析。(6)NFAT3核蛋白活性检测 无菌条件下取左心室肌组织,碾磨匀浆以备提取核蛋白,核蛋白提取实验步骤及核因子活性实验步骤按试剂盒说明书进行。
1.4 统计学处理 采用SPSS 11.0统计软件,计量资料以(±s)表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组心脏结构及功能的测定 与正常组比较,模型组大鼠心脏IVS 及LVPW 厚度均增厚,差异有统计学意义(P<0.05);而EF%值与正常组比较,模型组大鼠则明显降低(P<0.05)。中药组、西药组大鼠IVS、LVPW 及EF%值与正常组比较,差异均无统计学意义(P>0.05)。见表1。
表1 各组心脏结构及功能的检测(±s)
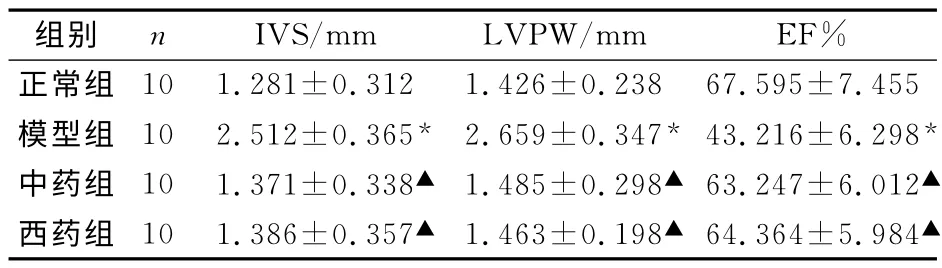
表1 各组心脏结构及功能的检测(±s)
注:与正常组比较,*P<0.05;与模型组比较,▲P<0.05。
2.2 各组心肌组织β3-AR、CaN 及NFAT3mRNA的表达水平检测 模型组大鼠心肌组织β3-AR、CaN 及NFAT3mRNA 的表达水平与正常组、中药组、西药组比较均明显升高,差异有统计学意义(均P<0.05)。中药组、西药组心肌组织β3-AR、CaN及NFAT3mRNA 的表达水平与正常组比较,差异无统计学意义(P>0.05)。见表2。
表2 各组心肌组织β3-AR、CaN 及NFAT3mRNA 的表达水平(±s)

表2 各组心肌组织β3-AR、CaN 及NFAT3mRNA 的表达水平(±s)
注:与正常组比较,*P<0.05;与模型组比较,▲P<0.05。
2.3 各组心肌组织β3-AR、CaN 和NFAT3蛋白质的表达水平及NFAT3 核蛋白活性检测 模型组大鼠心肌组织β3-AR、CaN 和NFAT3蛋白质的表达水平及NFAT3 核蛋白活性与正常组、中药组、西药组比较均明显升高,差异有统计学意义(P<0.05)。中药组、西药组心肌组织β3-AR、CaN、NFAT3蛋白质的表达水平及NFAT3 核蛋白活性与正常组比较,差异无统计学意义(P>0.05)。见表3。
表3 各组心肌组织β3-AR、CaN、NFAT3蛋白质的表达水平及NFAT3 核蛋白活性(±s)

表3 各组心肌组织β3-AR、CaN、NFAT3蛋白质的表达水平及NFAT3 核蛋白活性(±s)
注:与正常组比较,*P<0.05;与模型组比较,▲P<0.05。
3 讨论
β3-AR 是继β1-AR、β2-AR 后发现的又一β肾上腺素受体,在心力衰竭时随儿茶酚胺浓度升高、去甲肾上腺素的释放,β3-AR 被激活,β3-AR 持续增多将引起放大效应,产生持续的负性肌力作用,导致进一步心室重构,恶化心功能[5]。
Ca2+是心肌细胞最重要的第二信使,当心肌细胞受到机械牵张、负荷增加或神经体液因素的刺激时,胞内Ca2+浓度出现反应性增加,进而通过调节下游因子诱导心室重塑的发生发展[6]。β3-AR 对心肌细胞Ca2+的调控可能是其在心室重构中发挥作用的重要机制。
CaN 受Ca2+信号调控而发挥多种生物功能,而CaN 自身不但是多条信号传导通路的中心环节,而且还可通过去磷酸化作用使Ca2+信号和其他调节机制偶联起来,进而对其他信号通路进行调节,是细胞在信号调控与信号传递中的效应酶和调节酶[7]。NFAT3核蛋白活性依赖于胞浆中钙离子转运至细胞核内的流量,胞浆内钙离子的增加激活钙调蛋白,进而激活钙调神经磷酸酶,使胞质中的NFAT3去磷酸化进入细胞核,NFAT3核蛋白活性增加,调节下游心肌肥大相关基因,如肿瘤坏死因子α、内皮素-1、血管紧张素Ⅱ等的表达促进心室重塑[8]。
本研究结果显示,以异丙肾上腺素造模后,模型大鼠出现LVPW 及脑明显增厚,而EF%值下降。上述慢性心衰大鼠的相关数据与人的慢性心力衰竭心室重塑出现心肌收缩力下降、心室肥厚的相似,提示造模成功。而且模型大鼠在出现LVPW 及IVS明显增厚、EF%值下降的同时,伴随β3-AR、CaN、NFAT3mRNA 和蛋白质的表达水平以及NFAT3核蛋白活性明显升高。我们推测,心力衰竭时交感-肾上腺髓质系统激活,β3-AR 持续兴奋,导致心肌细胞[Ca2+]i增加,而心肌细胞[Ca2+]i增加,激活CaN 使NFAT3去磷酸化并进入胞核,NFAT3核蛋白活性增加,活化下游多种心肌肥厚的相关基因。提示β3-AR 可通过调控CaN-NFAT3信号转导通路参与调节慢性心力衰竭心室重塑的病理生理过程。
卡维地洛是一种具有多种附加作用的第三代β受体阻滞药,是非选择性地阻滞β受体及选择性地阻滞α1受体,大规模临床实验证实可抑制慢性心力衰竭心室重塑。本研究结果显示,益气温阳活血方与卡维地洛一样,可以抑制β3-AR、CaN、NFAT3 mRNA 和蛋白质的表达水平以及NFAT3 核蛋白活性,改善心力衰竭大鼠心脏功能,提高EF%值逆转IVS及LVPW 厚度,防止心室重塑。故初步推论心力衰竭时,益气温阳活血方通过抑制心脏的局部RAAS 系统,阻断心力衰竭时过分激活的β3-AR,从而抑制CaN 信号通路逆转心室重塑,具体作用机制有待于进一步研究证实。
[1]邓义军,伍卫,方昶,等.β3-肾上腺素能受体对心力衰竭大鼠心室肌细胞内静息Ca2+浓度的调控及其转导途径[J].南方医科大学学报,2009,29(8):1635-1640.
[2]王术芳,王晓丽.钙调神经磷酸酶与心肌肥厚的研究现状[J].中国老年学杂志,2013,33(5):1235-1237.
[3]杨冬花,付蓉,罗建华,等.心力衰竭大鼠不同时期尾加压素Ⅱ、内皮素-1和肾上腺髓质素水平变化及益气温阳活血方对其影响的研究[J].贵州医药,2012,36(1):4-7.
[4]刘艳丽,刘奔,屈扬扬,等.氧化应激和钙/钙调蛋白依赖性蛋白激酶Ⅱ参与β肾上腺素受体持久激动引起的大鼠心肌肥厚[J].生理学报,2013,65(1):1-7.
[5]安慧玲,杨君,陈枚洁,等.β3 肾上腺素能受体应用的研究进展[J].医学综述,2013,19(19):3470-3474.
[6]Lompre AM,Hajjar RJ,Harding SE,et al.Ca2+cycling and new therapeutic approaches for heart failure[J].Circulation,2010,121(6):822-830.
[7]Ding W,Dong M,Deng J,et al.Polydatin attenuates cardiac hypertrophy through modulation of cardiac Ca2+handling and calcineurin-NFAT signaling pathway[J].Am J Physiol Heart Circ Physiol,2014,307(5):H792-802.
[8]Lunde IG,Kvaly H,Austb B,et al.Angiotensin II and norepinephrine activate specific calcineurin-dependent NFAT transcription factor isoforms in cardiomyocytes[J].J Appl Physiol,2011,111(5):1278-1289.

