舒尼替尼治疗肾转移癌疗效的影响因素分析
李 昊 姚启盛 陈从波 杨 勇 龚小新 黄 力
肾癌为泌尿系统常见恶性肿瘤之一,在成人肾脏恶性肿瘤中的发生率可达80% ~90%,在全球范围内每年患者数量以2%~3%的速度增长,且存在着地区差异性[1]。目前我国的肾癌发病率呈逐年上升趋势,对于转移性肾细胞癌,手术治疗预后较差,放化疗效果不理想[2]。近年来随着小分子靶向药物的研究问世,为转移性肾癌患者提供了1种新的药物治疗途径,其中以舒尼替尼类为代表的药物疗效能够使患者中位总生存时间(overall survival,OS)达到 2 年以上[3-4]。本次研究针对舒尼替尼个体化用药方案治疗转移性肾细胞癌的疗效和安全性进行回顾性分析,报告如下。
1 资料与方法
1.1 一般资料
选取2008年9月-2013年4月来我院诊治的转移性肾细胞癌的患者54例,其中男性35例,女性19例。患者年龄为23~69岁,平均(43.12±10.43)岁。本次研究中确诊病例通过手术或肾穿刺活检证实,分别为44例和10例,所有患者远处转移的诊断分别在初诊(29例)和根治性肾切除术后(25例),转移发生在术后3~118个月,平均(53.63±14.31)个月。转移性肾细胞癌主要为肾透明细胞癌(36例)和乳头状肾细胞癌(18例)。除5例患者接受过白细胞介素-2(IL-2)或 α-干扰素(INF-α)治疗外,其余患者未经治疗,所有患者均知情同意接受舒尼替尼治疗。随访时间为6~67个月,平均(32.43±10.83)个月,给予舒尼替尼治疗周期为12~29个周期,平均(18.54±4.45)个周期,两组的详细资料见表1。
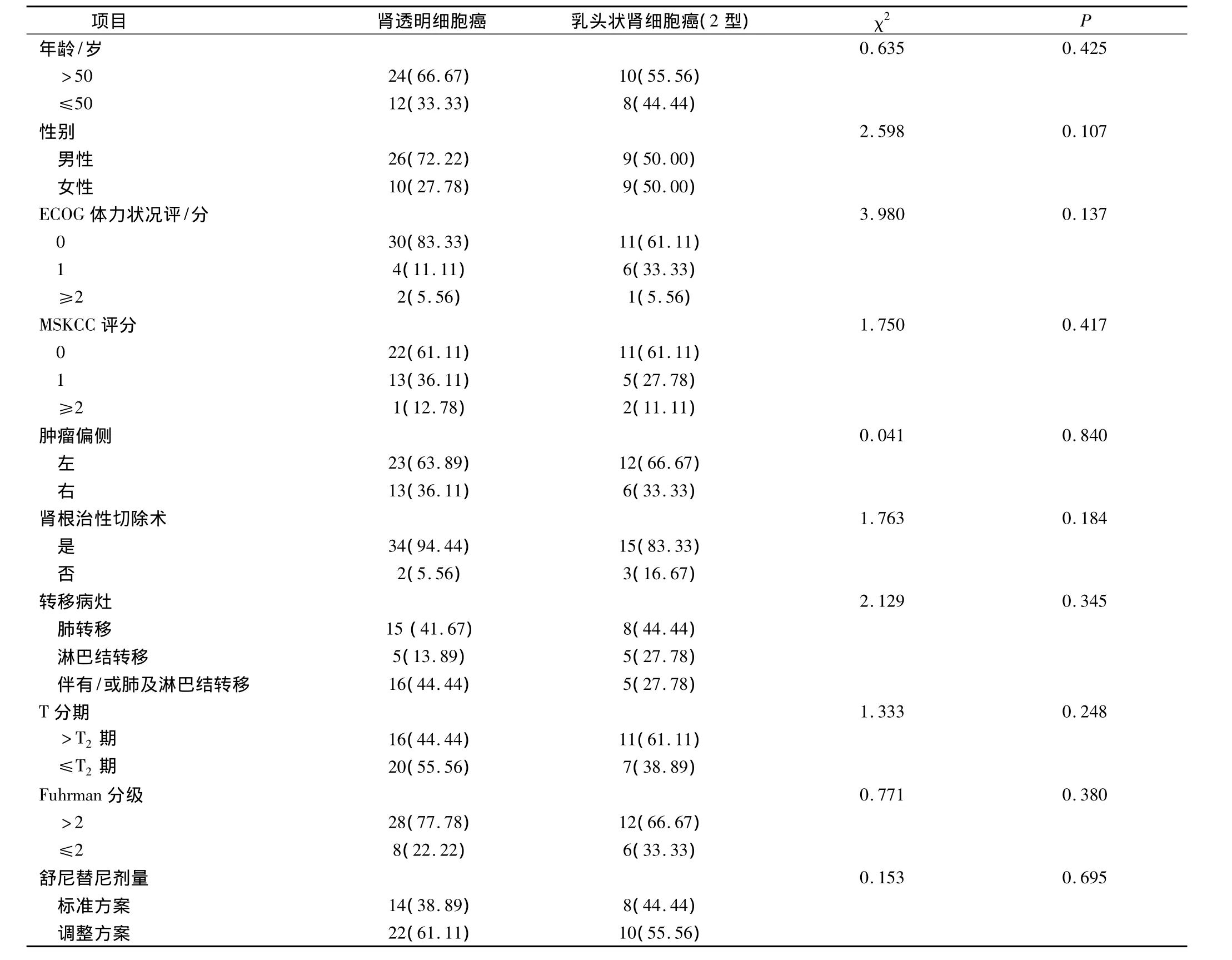
表1 舒尼替尼治疗转移性细胞癌患者的一般临床资料(例,%)
1.2 方法
主要针对患者的身体状况进行不同剂量的舒尼替尼给药,主要有两种方案。标准方案:给予患者舒尼替尼50 mg/d,连续服用4周后停药2周,观察患者的身体状况及药物不良反应,若不能耐受则需调整剂量,使用调整方案。调整方案给予患者舒尼替尼37.5 mg/d,服用4周后停药2周或连续服用。除此两种给药剂量外,具体剂量调整根据实际患者个人体质状况制定个体化治疗方案。出现严重不良反应或病情恶化时须停止用药,改用其他治疗方案。本次研究中入组患者均告知详情并签署知情同意书。
1.3 观察指标及评估方法
1.3.1 评估方法 本次研究中采用CT或MRI等影像学检查方法对可测量转移性病灶进行疗效评价;采用全身骨扫描联合CT对转移至骨的病灶范围、严重程度进行评估。治疗期间每隔3周复查一次,包括一般生命体征、血尿常规、心电图及甲状腺功能检查等,转移性病灶的药物疗效评价每6~8周行CT或MRI复查一次。
1.3.2 评估标准 采用实体瘤的治疗效果评价标准(response evaluation criteria in solid tumors,RECIST)对治疗疗效进行评估[5]:所有目标病灶消失为完全缓解(complete remission,CR);基线病灶长径总和缩小≥30%为部分缓解(partial remission,PR);基线病灶长径总和有缩小但未达PR或有增加但未达PD为疾病稳定(stable disease,SD);基线病灶长径总和增加≥20%或出现新病灶为疾病进展(progression disease,PD)。肿瘤客观缓解率(objective remission rate,ORR)=CR+PR,疾病控制率(DCR)=PR+CR+SD。目标病灶的缩小比例的计算方法:缩小比例=(基线最大径-复诊最大径)/基线最大径×100%,观察指标包括无进展生存期(progression-free-survival,PFS)和 OS,根据化疗药物毒副反应评判标准(NCI-CTC-3.0版)对药物不良反应进行评价。
1.4 统计学处理
数据应用 SPSS 16.0软件进行分析,计数资料行卡方检验,计量资料用s表示,组间比较行t检验,单因素分析使用Kaplan—Meier法,多因素分析使用COX回归模型,P<0.05,差异具有显著统计学意义。
2 结果
2.1 治疗疗效评价
治疗过程中,大部分患者的病情得到缓解或稳定,其转移瘤的最大径缩小程度为-24% ~100%,平均为27.45%;转移性透明细胞癌最大径缩小范围为-23%~100%,平均30.32%;转移性乳头状肾细胞癌最大径缩小范围为-27% ~100%,平均23.65%。治疗的RECIST疗效评估结果见表2。

表2 舒尼替尼治疗疗效评估结果(例,%)
2.2 总体生存状况分析
截至2014年5月,在对接受舒尼替尼治疗的所有患者的复查随访中,病情进展的患者 48例,占88.89%;死亡 25 例,占 46.30%(25/54)。患者 1 年生存率为 90.74%(49/54),2年生存率为 75.93%(41/54)。总生存期为6~67个月,平均(40.12±5.67)个月,患者无进展生存期为13~24个月,平均(16.34 ±1.76)个月。
2.3 转移性肾细胞癌生存危险因素分析
单因素分析结果显示,在肾细胞癌转移至肺或淋巴结的33例患者中,中位PFS为19个月,中位OS为49个月;而在有肺或淋巴结外转移的21例患者中,中位PFS、OS分别为9个月、26个月,两者差异均有统计学意义(P<0.01);另外,单一器官转移的患者接受舒尼替尼治疗后2年生存率为65%,而多器官转移的患者2年生存率明显下降仅18%,两组患者在PFS、OS的比较上,单一器官转移生存时间约为多器官转移患者两倍,差异均具有统计学意义(P<0.01);而转移性肾透明细胞癌中位PFS、OS分别为16个月、37个月,高于转移性肾乳头细胞癌的15、36个月,差异无统计学意义(P=0.145、0.241),结果见表 3。
2.4 舒尼替尼治疗的多因素分析
多因素分析统计显示,影响转移性肾细胞癌的疗效的独立因素为肿瘤转移部位,转移至肺或淋巴结的患者的生存状况较好(RR=0.087,P=0.0076),结果见表4。
2.5 舒尼替尼治疗转移性肾细胞癌的不良反应
药物治疗过程中,发生不良反应的患者有53例,占98.15%,其中发生率前三位的分别是高血压、手足综合征、白细胞减少,其次包括口腔黏膜炎症、血小板减少、甲状腺功能低下也较为常见,但三级及以上的不良反应较少。根据患者的不同病况,部分采取剂量调整方案,但仍有34例患者在接受治疗中出现过一次3级及以上的不良反应,对患者采取减药或停药处理,标准剂量组和调整剂量组减停药发生率分别为63.64%(14/22)、34.37%(11/32),差异具有统计学意义(χ2=4.490,P=0.034),见表5。
表3 舒尼替尼治疗转移性肾癌的Kaplan—Meier单因素生存分析(s)
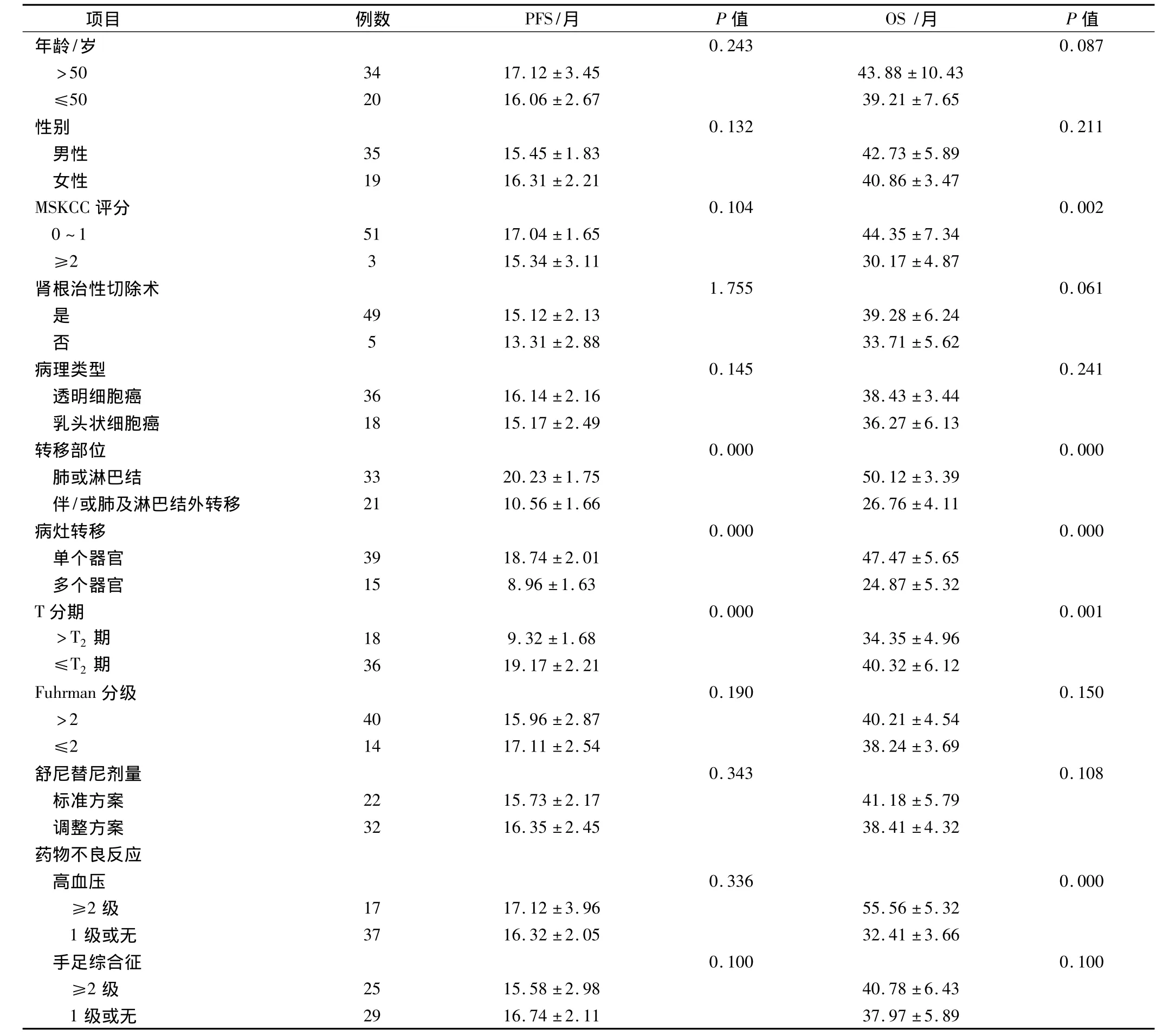
表3 舒尼替尼治疗转移性肾癌的Kaplan—Meier单因素生存分析(s)
项目 例数 PFS/月 P值 OS/月 P值0.243 0.087>50 34 17.12 ±3.45 43.88 ±10.43≤50 20 16.06 ±2.67 39.21 ±7.65性别 0.132 0.211男性 35 15.45 ±1.83 42.73 ±5.89女性 19 16.31 ±2.21 40.86 ±3.47 MSKCC 评分 0.104 0.002 0 ~1 51 17.04 ±1.65 44.35 ±7.34≥2 3 15.34 ±3.11 30.17 ±4.87肾根治性切除术 1.755 0.061是49 15.12 ±2.13 39.28 ±6.24否5 13.31 ±2.88 33.71 ±5.62病理类型 0.145 0.241透明细胞癌 36 16.14 ±2.16 38.43 ±3.44乳头状细胞癌 18 15.17 ±2.49 36.27 ±6.13转移部位 0.000 0.000肺或淋巴结 33 20.23 ±1.75 50.12 ±3.39伴/或肺及淋巴结外转移 21 10.56 ±1.66 26.76 ±4.11病灶转移 0.000 0.000单个器官 39 18.74 ±2.01 47.47 ±5.65多个器官 15 8.96 ±1.63 24.87 ±5.32 T 分期 0.000 0.001>T2 期 18 9.32 ±1.68 34.35 ±4.96≤T2 期 36 19.17 ±2.21 40.32 ±6.12 Fuhrman 分级 0.190 0.150>2 40 15.96 ±2.87 40.21 ±4.54≤2 14 17.11 ±2.54 38.24 ±3.69舒尼替尼剂量 0.343 0.108标准方案 22 15.73 ±2.17 41.18 ±5.79调整方案 32 16.35 ±2.45 38.41 ±4.32药物不良反应高血压0.336 0.000≥2 级 17 17.12 ±3.96 55.56 ±5.32 1 级或无 37 16.32 ±2.05 32.41 ±3.66手足综合征 0.100 0.100≥2 级 25 15.58 ±2.98 40.78 ±6.43 1级或无年龄/岁29 16.74 ±2.11 37.97 ±5.89

表4 舒尼替尼治疗肾转移性细胞癌患者的COX多因素生存分析

表5 肾转移细胞癌患者采用舒尼替尼治疗的不良反应(例,%)
3 讨论
舒尼替尼是1种酪氨酸酶受体抑制剂,可以特异性识别多种生长因子受体,包括血管内皮生长因子受体、干细胞因子受体、集落刺激因子受体等,竞争性抑制配体与受体的结合和信号的转导,从而能抑制肿瘤新生血管的形成,抑制肿瘤的生长[6]。
通过大量的临床试验显示,舒尼替尼治疗转移性肾细胞癌的Ⅲ期治疗有效率达46%,患者的中位PFS、OS 分别达12.0 个月、24.0 个月[3-4]。同时,相关临床研究发现,舒尼替尼在亚洲人群中的疗效要不同程度的优于欧美人群[7-9]。而针对中国人群的晚期肾转移癌Ⅳ期临床研究中,舒尼替尼仍有较好的疗效,疾病控制率在76%左右[10]。本次研究中,肾转移性细胞癌患者的治疗疗效取得令人满意的结果,54例患者接受舒尼替尼治疗后的中位OS可达37.0个月,再次提示舒尼替尼对亚洲人群的疗效优于欧美人群。分析其原因可能存在以下几点:①亚洲人体质本身对舒尼替尼类药物的吸收利用度较高;②本次试验的患者多数身体状况良好,超过90%(51/54)的患者MSKCC评分≤1级;③本次研究中为患者提供的较完善的医疗服务和个体化用药方案。
转移性肾透明细胞癌和肾乳头状细胞癌是肾脏肿瘤中常见的类型,其中肾乳头状细胞癌分为1型、2型,而2型肾乳头状细胞癌的恶性度较高,预后较差。与肾透明细胞癌相比,晚期肾乳头细胞癌的中位OS仅为 5.5个月,且 5年生存率明显较低(60%、35%)[11]。目前的临床研究证实,舒尼替尼对于肾透明细胞癌的疗效明显,可以有效地改善患者的生存状况,安全性高,但缺乏足够的数据支持舒尼替尼应用于转移性肾非透明细胞癌的治疗。在一项扩大化的全球性临床试验中,转移性非透明细胞癌的患者共计588例,其中舒尼替尼治疗转移性肾乳头状细胞癌后的中位 PFS 为 7.8 个月[12]。洪雅萍,姚旭东等[13]通过对139例转移性肾乳头状细胞癌患者进行研究显示,生存分析的中位PFS也达到8.0个月。本次研究中纳入了18例2型乳头状肾细胞癌,生存分析显示中位PFS、OS分别达11.0 个月、32.0 个月,从而为舒尼替尼应用于转移性非透明细胞肾癌的可能性提供依据。
近年来,相继有报道证实血管生成相关分子在乳头状肾细胞癌患者中处于较高水平[14-16]。而酪氨酸酶受体在血管生成过程中起到重要的信号转到作用,舒尼替尼的酪氨酸酶受体抑制作用为治疗乳头状肾细胞癌提供了科学依据。本次研究中针对不同患者的身体状况,有32例患者接受调整方案,但治疗期间出现3级及以上不良反应的发生率仍达到62.96%(34/54)。且本组患者的高血压、手足综合征、白细胞减少等不良反应发生率略高于舒尼替尼Ⅲ期临床试验的结果,而相关国内外研究发现,以上不良反应的发生于舒尼替尼疗效存在相关性[17]。因而需要通过个体化的药物剂量调整来平衡舒尼替尼疗效和不良反应之间的关系。本次试验使用的调整方案包括37.5 mg/d连续服用、服用4周后停药2周,与标准方案(50 mg/d服用4周,停药2周)相比疗效相当甚至更好,提示舒尼替尼的药物调整方案能够同时保证有效性和安全性,可以部分解释调整剂量与标准剂量的使用在生存分析时差异较小的原因。
综上所述,舒尼替尼类小分子靶向药物的应用使转移性肾细胞癌的临床疗效取得显著进步,本次研究回顾性生存分析显示,舒尼替尼对转移性肾透明细胞癌和乳头状肾细胞癌均有良好疗效,而调整剂量的舒尼替尼个体化治疗能够兼顾总体有效性和用药安全性。另外本次研究再次为舒尼替尼治疗转移性非透明细胞癌提供支持,扩大了舒尼替尼治疗转移性肾细胞癌的适应范围,但仍需更多临床试验探索出适合中国肾癌人群的预防及治疗方案。
[1]Bray F,Jemal A,Grey N,et al.Global cancer transitions according to the human development Index(2008-2030):a population-based study〔J〕.Lancet Oncol,2012,13(8):790-801.
[2]王清海,李亚健,樊 华,等.不同年龄段肾细胞癌患者临床病理特点分析〔J〕.基础医学与临床,2013,33(6):740-743.
[3]Molina AM,Jia X,Feldman DR,et al.Long-term response to sunitinib therapy for metastatic renal cell carcinoma〔J〕.Clin Genitourin Cancer,2013,11(3):297-302.
[4]施国海,叶定伟,姚旭东,等.舒尼替尼治疗转移性肾癌的近期疗效及耐受性〔J〕.中华泌尿外科杂志,2011,32(6):423-426.
[5]杜 晨,赵 珈,李长福,等.肾脏小肿瘤临床与病理资料的分析〔J〕.实用肿瘤学杂志,2014,28(2):114-117.
[6]Zhang CJ,Zhao PJ,Li XS,et al.Evaluation of efficacy and safety of sunitinib regimen in 22 patients with metastatic renal cell carcinoma:at least 12-month follow-up〔J〕.Chin Med J(Engl),2013,126(15):2826-2829.
[7]Atkinson BJ,Kalra S,Wang X,et al.Clinical outcomes for patients with metastatic renal cell carcinoma treated with alternative sunitinib schedules〔J〕.J Urol,2014,191(3):611-618.
[8]Motzer RJ,Escudier B,Bukowski R,et al.Prognostic factors for survival in 1059 patients treated with sunitinib for metastatic renal cell carcinoma〔J〕.Br J Cancer,2013,108(12):2470-2477.
[9]施国海,叶定伟,姚旭东,等.舒尼替尼治疗转移性肾癌的近期疗效及耐受性〔J〕.中华泌尿外科杂志,2011,32(6):423-426.
[10]叶定伟,施国海.中国应用舒尼替尼治疗晚期肾癌的Ⅳ期临床结果〔J〕.中华泌尿外科杂志,2012,33(4):245-246.
[11]Shinohara N,Nonomura K,Abe T,et al.A new prognostic classification for overall survival in Asian patients with previously untreated metastatic renal cell carcinoma〔J〕.Cancer Sci,2012,103(9):1695-1700.
[12]Yildiz I,Ekenel M,Akman T,et al.Sunitinib for patients with metastatic non-clear cell renal cell carcinoma:a Multicenter Retrospective Turkish Oncology Group trial〔J〕.Anticancer Res,2014,34(8):4329-4334.
[13]洪雅萍,姚旭东,朱 耀,等.舒尼替尼治疗晚期肾细胞癌患者的毒副反应对预后的影响〔J〕.中华医学杂志,2013,93(36):2880-2883
[14]Park K,Lee JL,Ahn JH,et al.Efficacy and safety of everolimus in korean patients with metastatic renal cell carcinoma following treatment failure with a vascular endothelial growth factor receptor-tyrosine kinase inhibito〔J〕.Cancer Res Treat,2014,46(4):339-47.
[15]Minardi D,Lucarini G,Santoni M,et al.VEGF expression and response to sunitinib in patients with metastatic clear cell renal cell carcinoma〔J〕.Anticancer Res,2013,33(11):5017-5022.
[16]任选义,魏金星,李华强,等.转录因子Spl和血管内皮生长因子在进展期肾癌中的表达及临床意义〔J〕.中华实验外科杂志,2012,29(3):498-499.
[17]蔡 林,张崔建,李学松,等.舒尼替尼治疗转移性肾细胞癌的疗效和不良反应及其相关性分析〔J〕.中华泌尿外科杂志,2014,35(6):425-428.

