肿瘤标志物对肺癌患者的诊断及预后预测的价值研究
张 雁 王志群
本文选择我院收治的160例肺癌患者,探讨肿瘤标志物在肺癌患者诊断、预后预测中的临床价值,为临床研究提供参考依据。
1 材料与方法
1.1 临床资料
选择2010年3月-2014年3月期间来我院治疗的不同临床分期的160例肺癌患者,患者均经临床病理确诊为肺癌患者。其中男性105例,女性55例,年龄23~75岁,平均年龄(45.50 ±5.50)岁。肺鳞癌组53例,肺腺癌组55例,SCLC组52患者。临床Ⅰ~Ⅱ期组26例,Ⅲ期组66例,Ⅳ期组68例。同期选择160例健康志愿者组成健康对照组。
1.2 标本采集
检测肿瘤标志物时,所有患者与健康志愿者均空腹采集静脉血3~4 ml,在2 000 r/min离心5 min,分离血清备用。
1.3 检测方法[1]
应用蛋白芯片技术检测血清肿瘤标志物浓度。仪器为上海数康生物科技有限公司生产的HD-2001A型生物芯片检测仪,试剂是湖州数康生物科技有限公司生产的C-12A肿瘤诊断用蛋白芯片试剂盒。
1.4 判定标准
肿瘤标志物检测指标数值>临界值时,即为阳性,否则为阴性。正常参考值由数康生物科技有限公司蛋白芯片试剂盒提供。
1.5 统计学处理
数据处理软件包为SPSS 16.0,计量的比较采用t值检验,计数的比较采用χ2检验,P<0.05表示有显著性差异。
2 结果
2.1 肺癌患者组和健康对照组血清肿瘤标志物浓度比较
通过检测,肺癌患者血清的 CEA、NSE、CA125、CYFAR21-1、CA153等肿瘤标志物的浓度均明显高于健康对照组人群,与对照组比较均具有显著性差异(P<0.05),见表1。
表1 肺癌患者组和健康对照组血清肿瘤标志物浓度的比较(s)

表1 肺癌患者组和健康对照组血清肿瘤标志物浓度的比较(s)
肿瘤标志物 肺癌(160例)健康对照组(160例)χ2P 16.50 ±12.50 3.51 ±1.50 5.353 <0.05 NSE(ng/mL)24.50 ±13.50 8.50 ±2.50 4.290 <0.05 CA125(KU/L)82.50 ±24.50 25.50 ±8.50 4.943 <0.05 CYFAR21-1(ng/mL)15.50 ±20.50 2.50 ±1.10 5.230 <0.05 CA153(KU/L)CEA(ng/mL)45.50 ±25.50 7.50 ±2.50 4.959 <0.05
2.2 不同病理类型的肺癌患者血清肿瘤标志物阳性率的比较
CEA、NSE、CA125、CYFAR21-1、CA153 等肿瘤标志物在肺鳞癌组、肺腺癌组与SCLC组的阳性率均高于健康对照组(P<0.05);CEA、CA153以及CA125在肺腺癌组的阳性率显著高于肺鳞癌组和SCLC组(P<0.05);NSE和CYFAR21-1在SCLC组的阳性率显著高于肺鳞癌组、肺腺癌组(P<0.05),见表2。
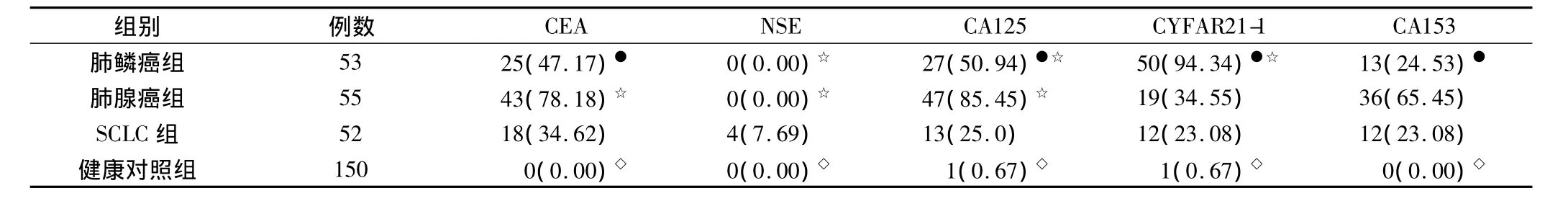
表2 不同病理类型的肺癌患者血清肿瘤标志物阳性率的比较(例,%)
2.3 不同分期肺癌肿瘤标志物阳性率的比较
CEA、NSE、CA125、CYFAR21-1、CA153 等肿瘤标志物Ⅰ~Ⅱ期组、Ⅲ期组与Ⅳ期组其阳性率显著高于健康对照组;CA125与CYFAR21-1在Ⅲ期组与Ⅳ期组其阳性率显著高于Ⅰ~Ⅱ期组(P<0.05),见表3。

表3 不同分期肺癌肿瘤标志物阳性率的比较(例,%)
2.4 肺癌患者3年随访结果
本组随访3年发现,肿瘤标志物阳性组患者110例,死亡88例,比例80.0%,血清肿瘤标志物2项以上阳性组患者45例,死亡43例,比例95.6%。50例肿瘤标志物阴性组患者死亡15例,比例30.0%,显著低于肿瘤标志物阳性患者和血清肿瘤标志物2项以上阳性组患者的比例(P<0.05),见表4。
表4 肺癌患者3年随访结果(s)
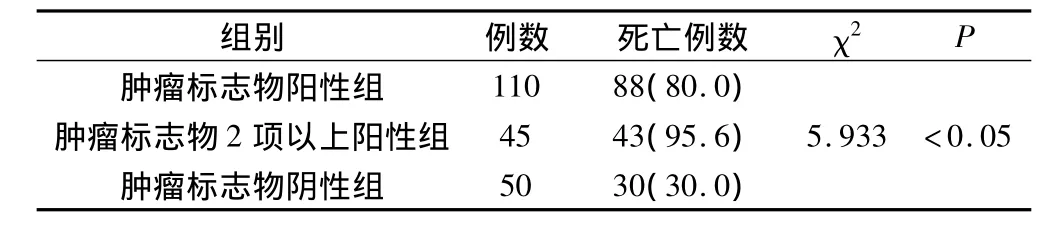
表4 肺癌患者3年随访结果(s)
组别 例数 死亡例数 χ2P肿瘤标志物阳性组 110 88(80.0)肿瘤标志物2项以上阳性组 45 43(95.6)5.933 <0.05肿瘤标志物阴性组 50 30(30.0)
3 讨论
肺癌是最常见的恶性肿瘤之一,是1种严重威胁人民健康和生命的疾病。其预后取决于早期发现、及早治疗,故肺癌的早期诊断尤为重要。根据不同的临床表现、对放化疗的敏感度,可将肺癌分为两大类:非小细胞肺癌困和小细胞肺癌[2]。前者又包括鳞癌、腺癌、未分化的大细胞癌等组织学类型,约占肺癌总数75%。有文献报道[3],提高肺癌患者生存率的主要手段是早期诊断、鉴别诊断、早期进行针对性强的有效治疗。血清肿瘤标志物的异常往往早于影像学的异常,并且与肿瘤的发生发展有一定的相关性。本文就选择160例肺癌患者,探讨肿瘤标志物在肺癌患者诊断、预后预测中的临床价值,为临床研究提供参考。
肿瘤标志物是指在肿瘤发生和增殖过程中,由肿瘤细胞所产生或分泌并释放到血液、细胞、体液中,反映肿瘤存在和生长的一类物质,主要包括CEA、NSE、CA125、CYFAR21-1、CA153 等5 大类物质[4]。本文研究结果说明肺癌患者的标志物的水平显著高于健康人群;不同病理类型的肺癌患者,肺癌标志物的阳性率存在差异性;不同临床分期的肺癌患者,肺癌标志物的阳性率存在差异性。这对肺癌的病理分型、临床分期具有一定的指导意义。CEA是存在于癌及胚胎组织中的1种高分子糖蛋白,国内外文献报道,在消化系统肿瘤及呼吸系统肿瘤中,它均可呈显著升高,对于肺癌患者,CEA已经作为1种常用的肿瘤标志物应用于临床。CA125是1种分子量为200~1 000 kD的糖蛋白,主要在癌变的卵巢上皮细胞膜上表达,国内文献报道[5]显示肺癌患者的CA125的水平显著高于健康人群。NSE属于烯醇化酶的异构体,有文献报道[6],肺癌组织中NSE的含量往往是正常肺组织的3-35倍,这与本文研究一致。CYFRA21-1即细胞角蛋白19片段,是上皮细胞中间丝蛋白家族,主要存在于肺癌及食管癌的上皮起源的肿瘤细胞的胞质中,有人研究称CYFRA21-1是非小细胞肺癌患者有价值的评价指标,在鳞癌中尤为明显,敏感度及特异度均高于腺癌及小细胞癌[7],这与本文的研究一致。本文研究还发现,随访3年160例患者,肿瘤标志物阳性组的患者死亡率显著高于阴性患者,2项以上肿瘤标志物阳性的患者死亡率更高,这说明肿瘤标志物对肿瘤的预后预测具有一定的指导意义。
综上所述,肿瘤标志物的检测能够辅助诊断肺癌患者的病理类型、不同临床分期,同时对预后预测有一定的临床指导意义。
[1]杜淑英.血清5种肿瘤标志物联合检测在肺癌诊断中的价值〔J〕.北方药学,2014,9(1):85-86.
[2]邱海山,潘俊辉.血清 CEA、SCC、cYFRA21-1、ProGRP 检测在肺癌诊断中的应用研究〔J〕.白求恩医学杂志,2014,12(4):390-391.
[3]王 欢,吴 捷,王 建,等.肿瘤标志物联合检测在肺癌诊断中的意义〔J〕.中国医药指南,2013,14(3):606-607.
[4]熊 杰,白生华,徐万清,等.血清肿瘤标志物联合检测对肺癌的诊断价值〔J〕.现代肿瘤医学,2012,12(3):536-538.
[5]王昌生.肿瘤标志物在肺癌诊断中的联合应用〔J〕.河北医学,2012,12(4):499-501.
[6]孙立慧.肺癌血清肿瘤标志物的研究〔J〕.黑龙江医学,2012,12(5):352-355.
[7]游 媛,陈 岚,肖 鄂.多种血清肿瘤标志物在肺癌诊断中的应用价值研究〔J〕.吉林医学,2012,25(1):5390-5392.

