缺氧对肝癌上皮细胞E-Cadherin、间质细胞Vimentin表达的影响
曹文玺 金慧涵 季 沅
江苏省无锡市第二人民医院肝胆外科,江苏无锡214002
缺氧对肝癌上皮细胞E-Cadherin、间质细胞Vimentin表达的影响
曹文玺 金慧涵 季 沅
江苏省无锡市第二人民医院肝胆外科,江苏无锡214002
目的探讨缺氧对肝癌上皮细胞E-Cadherin、间质细胞Vimentin表达的影响。方法选取人肝癌细胞系:HepG2(低度侵袭力)、SMMC7721(高度侵袭力),分别置于缺氧条件组与常氧条件组,37℃恒温箱内培养72 h后备用。比较肝癌细胞形态学及上皮细胞E-Cadherin、间质细胞Vimentin的Western blot检测结果。结果倒置显微镜下观察,缺氧后的细胞由原来的紧密排列状态转变为较松散的纺锤体样改变,细胞松散。Western blot检测显示,缺氧条件下,上皮细胞标志蛋白E-Cadherin表达值较正常(常氧条件)明显下降(P<0.01),间质细胞标志蛋白Vimentin表达值明显升高(P<0.01)。常氧条件下,肝癌细胞表现为上皮多角形且排列较为致密。缺氧条件下,肝癌细胞之间以松散类圆或纺锤体样连接为主。结论缺氧将导致肝癌细胞形态变化,促使上皮表型蛋白E-Cadherin表达量下降,间质表型蛋白Vimentin表达量升高,诱发肝癌细胞发生上皮-间质转化。
缺氧;肝癌;上皮细胞E-Cadherin;间质细胞Vimentin
原发性肝癌(肝癌)的发生、发展极其复杂,作为一种多因素、多基因、多步骤疾病,受到多种细胞分子干预。以往的研究已经证实,上皮-间质转化(EMT)是肿瘤病灶发生、浸润、转移与复发的重要机制,参与EMT的各种细胞因子均在肿瘤发生、浸润、转移与复发过程中发挥重要作用[1]。其中波形蛋白(Vimentin)作为中间丝蛋白质家族最主要的成员之一,在正常间质细胞中有一定的表达,具有维持细胞结构完整性的功能。近年国外学者提出Vimentin是一种极为重要的EMT因子,其可作为间质组织增生与分化的标志物而广受重视[2]。E-Cadherin则作为钙离子依赖性细胞间黏附分子,在肿瘤的转移与复发中起重要作用,以往的研究已经证实其在消化道、泌尿道、口腔组织等恶性肿瘤患者中的表达水平显著降低[3]。
在实体肿瘤患者中,缺氧将导致肿瘤组织的微环境发生改变,肿瘤细胞处于乏氧状态,从而导致肿瘤周围正常细胞死亡,加速肿瘤组织的浸润与转移。本研究通过探讨缺氧引起肝癌上皮细胞E-Cadherin、间质细胞Vimentin表达变化,以期为肝癌的治疗提供新思路。
1 材料与方法
1.1 细胞培养及模型建立
选取人肝癌细胞系:HepG2(低度侵袭力)、SMMC7721(高度侵袭力)。均置于含10%小牛血清与1‰双抗的1640培养基内,在37℃,95%氮气与5% CO2混合气培养箱内进行培养。将细胞均匀铺满培养瓶基地后进行传代处理。弃上清后经清洗、胰酶处理后加入培养液,离心5 min后,再次弃上清,行重悬与分装,间隔3 d更换培养液。所选取之两种人肝癌细胞系培养至对数生长期,在胰酶处理后接种在6孔板上,加入去血清1640培养基,后静置于细胞缺氧培养罐内,缺氧条件组置于氮气浓度为95%,CO2浓度为5%,37℃恒温箱内培养72 h后备用。常氧条件组置于常氧条件下,37℃恒温箱内培养72 h后备用。
1.2 肝癌细胞形态学观察及上皮细胞E-Cadherin、间质细胞Vimentin的W estern blot检测方法
将肝癌细胞HepG2、SMMC-7721分别通过倒置显微镜对其细胞形态进行观察。Western blot检测则将肝癌细胞HepG2、SMMC-7721分别置于常氧与缺氧条件下培养72 h,通过清洗、离心、弃上清,之后加入细胞裂解液,静置半小时,于4℃条件下12 000 r/min,离心15 min,取上清液置于-80℃冰箱内备用。其中所用兔抗人E-Cadherin多克隆抗体及鼠抗人Vimentin单克隆抗体均以1∶100稀释,并将其与PDVF膜充分融合,4℃培育12 h,之后将其与羊抗兔/羊抗鼠二抗进行1∶4000稀释,再次与PDVF膜充分融合,室温条件下孵育60 min,加入发光剂,至暗室曝光,并与βactin内参蛋白进行对比。
1.3 统计学处理
应用SPSS 13.0软件统计分许数据,计量资料以均数±标准差(±s)表示,两组间均数的比较采用t检验,组间率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同条件下肝癌细胞HepG2、SMMC-7721中E-Cadherin及Vimentin W estern blot结果的比较
肿瘤细胞在缺氧条件下,肝癌细胞两种细胞的上皮表型蛋白E-Cadherin其表达量显著降低,而间质表型蛋白Vimentin的表达量显著升高。在肝癌细胞HepG2中,常氧条件下,E-Cadherin蛋白的表达水平为0.488±0.021,缺氧条件下,E-Cadherin蛋白的表达水平为0.279±0.030,常氧条件下E-Cadherin蛋白的表达水显著高于缺氧条件下(P=0.00029);常氧条件下,Vimentin蛋白的表达水平为0.292±0.036,缺氧条件下,Vimentin蛋白的表达水平为0.566±0.040,常氧条件下Vimentin蛋白的表达水显著低于缺氧条件下(P=0.00046)。在肝癌细胞SMMC-7721中,常氧条件下E-Cadherin蛋白的表达水显著高于缺氧条件下(P=0.00016),常氧条件下Vimentin蛋白的表达水显著低于缺氧条件下(P=0.00003)(表1、图1、图2)。
表1 不同条件下肝癌细胞HepG2、SMMC-7721中E-Cadherin及Vimentin Western blot结果的比较(pg/m l,±s)

表1 不同条件下肝癌细胞HepG2、SMMC-7721中E-Cadherin及Vimentin Western blot结果的比较(pg/m l,±s)
?
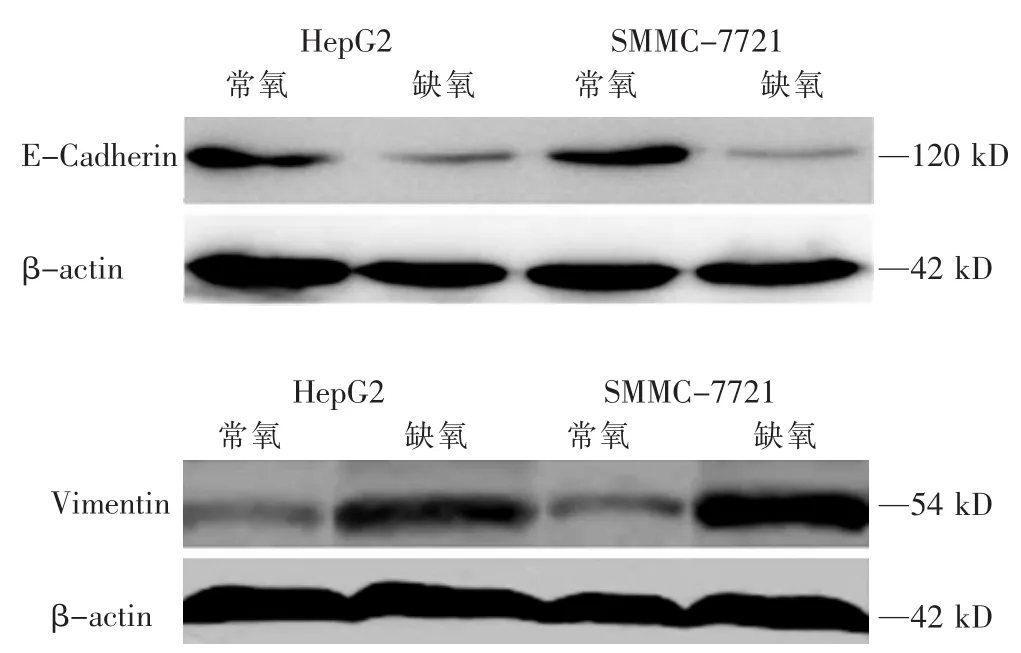
图1 Western blot检测肝癌细胞缺氧与否E-Cadherin、Vimentin蛋白含量变化

图2 缺氧与否两种肝癌细胞E-Cadherin、Vim entin蛋白表达变化A:HepG2;B:SMMC-7721;**P<0.01
2.2 缺氧与否两种肝癌细胞形态学变化
将HepG2、SMMC-7721两种肝癌细胞分别置于常氧与缺氧环境持续培养72 h,通过倒置显微镜观察发现,常氧条件下,肝癌细胞表现为上皮多角形且排列较为致密。缺氧条件下,肝癌细胞之间以松散类圆或纺锤体样连接为主,且胞体相对狭长,细胞较为分散(图3~图6)。
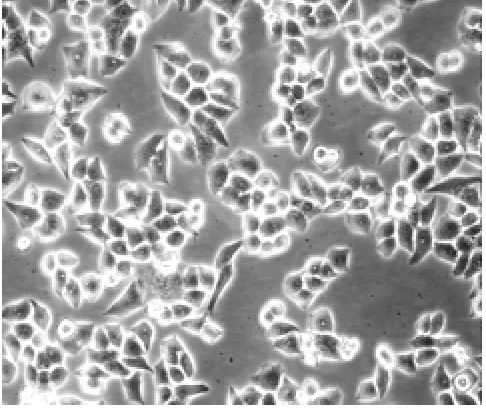
图3 常氧条件下HepG2细胞形态(×400)

图4 缺氧条件下HepG2细胞形态(×400)

图5 常氧条件下SMMC-7721细胞形态(×400)
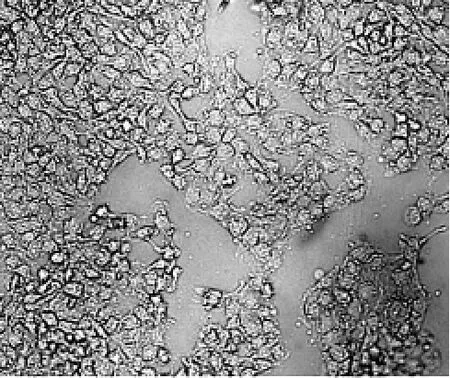
图6 缺氧条件下SMMC-7721细胞形态(×400)
3 讨论
以往的研究已经证实,EMT是恶性肿瘤浸润与转移的最重要因素[4]。在恶性肿瘤发生EMT过程中,出现许多EMT相关蛋白的变化,其中上皮表型蛋白E-Cadherin的下调及间质表型蛋白Vimentin的上调被认为是目前最为明显的标志性蛋白[5-6]。同时肿瘤组织的微环境改变对肿瘤上皮-间质转化的发生、发展亦具有重大影响。缺氧环境对肿瘤组织的微环境造成一定影响,导致其细胞的迁移,进而其侵袭性增强,容易出现肿瘤的远处转移。同时长期的缺氧环境还会引起正常组织和细胞死亡,进而导致肿瘤细胞所占比例增高,出现肿瘤组织体积增大。
E-Cadherin是上皮细胞中最为重要的一种黏附分子,在维持上皮细胞形态与结构中起关键性作用,其大量表达与抑制肿瘤的转移相关[7-8]。研究称在ECadherin蛋白表达降低甚至缺失时,细胞间黏附水平降低,在肿瘤组织中易出现向外界的浸润生长及远处转移[9]。Vimentin蛋白作为细胞骨架最为重要的支撑蛋白,主要参与细胞的生长与分化,并在细胞游走和迁移过程中发挥重要作用。大量研究证实[10-15],上皮性肿瘤患者中Vimentin蛋白的表达显著增加。本组针对E-Cadherin、Vimentin蛋白于缺氧和常氧条件下对比发现,结果显示,缺氧后HepG2和SMMC-7721两种肝癌细胞的上皮表型蛋白E-Cadherin表达量明显下降,间质表型蛋白Vimentin表达量明显升高。同时SMMC-7721的EMT标志蛋白表达量变化较HepG2细胞更明显,提示缺氧能显著诱导肝癌细胞出现EMT[16],且侵袭性越高其EMT变化越显著[17]。本研究选取低度侵袭性肝癌HepG2细胞株与高度侵袭性SMMC-7721肝癌细胞株,分别置于N2浓度为95%与CO2浓度为5%的缺氧培养罐条件下进行缺氧性培养72 h,同时选择另一组于常氧条件下培养72 h,观察其形态学变化发现,常氧条件下,肝癌细胞表现为上皮多角形且排列较为致密。缺氧条件下,肝癌细胞之间以松散类圆或纺锤体样连接为主[18],且胞体相对狭长,细胞较为分散[19],提示缺氧培养72 h,低度侵袭性肝癌HepG2细胞株与高度侵袭性SMMC-7721肝癌细胞株细胞形态均有一定的改变,且高度侵袭性SMMC-7721肝癌细胞株形态改变更最具EMT特征[20]。
综上所述,缺氧将导致肝癌细胞形态变化,促使上皮表型蛋白E-Cadherin表达量下降,间质表型蛋白Vimentin表达量升高,诱发肝癌细胞发生EMT。
[1]曾思恩,肖胜军,张小玲,等.肝细胞肝癌中转录辅抑制因子CtBP1与其靶基因E-cadherin的表达[J].临床与实验病理学杂志,2010,26(6):655-657.
[2]石磊,邵渊,王作仁,等.肝癌中ADAM10、EGFR和E-cadherin的表达分析及其与临床病理关系的研究[J].昆明医学院学报,2011,32(8):23-29.
[3]Thiery JP,Sleeman JP.Complex networks orchestrate epithelial-mesenchymal transitions[J].Nat Rev Mol Cell Biol,2006,7(2):131-142.
[4]黄文庆,杨文理,柴新娟,等.肝癌患者E-cadherin基因启动子区CpG岛甲基化状态的研究[J].中国普外基础与临床杂志,2011,18(5):514-519.
[5]Kotoh M.Epithelial-mesenchymal transition in gastric cancer[J].Int J Oncol,2005,27(6):1677-1683.
[6]Halbleib JM,Nelson WJ.Cadherins in development:cell adhesion,sorting,and tissue morphogenesis[J].Genes Dev,2006,20(23):3199-3214.
[7]黄建强,常瑞明,温立强,等.E-cadherin在肝癌组织中的表达及其对肝癌患者预后的影响[J].第三军医大学学报,2014,36(22):2301-2304.
[8]Grunert S,Jechlinger M,Beug H.Diverse cellular and molecular mechanisms contribute to epithelial plasticity and metastasis[J].Nat Rev Mol Cell Biol,2003,4(8):657-665.
[9]隋承光,孟凡东,付立业.MicroRNA-100调节mTOR表达对肝癌细胞侵袭转移及上皮间质转化的影响及机制研究[J].现代肿瘤医学,2015,23(1):15-19.[10]曹文玺.缺氧诱导的上皮-间质转化与肝癌细胞侵袭力的关系研究[D].苏州:苏州大学,2011.
[11]文文.低氧诱导因子-1负调控Cyclin D1的分子机制及其在肿瘤化疗抵抗中的作用研究[D].上海:第二军医大学,2009.
[12]许秋然,郑鑫,昝献峰,等.胶质瘤相关癌基因1在肝细胞癌中的表达及其与Shh、Vimentin、E-cadherin蛋白的相关性研究[J].细胞与分子免疫学杂志,2012,28(5):536-543.
[13]Kwon S,Choi KC,Kim YE,et al.Monoclonal antibody targeting of the cell surface molecule TM4SF5 inhibits the growth ofhepatocellular carcinoma[J].Cancer Res,2014,74(14):3844-3856.
[14]Yamada S,Okumura N,Wei L,et al.Epithelial to mesenchymal transition is associated with shorter disease-free survival inhepatocellular carcinoma[J].Ann Surg Oncol,2014,21(12):3882-3890.
[15]李四光,刘凯歌,常远鸿.肝星状细胞经趋化因子SDF-1/CXCR4轴途径促进肝癌细胞侵袭的作用及其机制[J].吉林大学学报(医学版),2013,39(4):730-736.
[16]黄小琼,王伟,孙达权,等.肝星形细胞分泌的趋化因子CXCL1在肝癌转归中的作用[J].中国细胞生物学学报,2015,37(6):801-808.
[17]Hayashi Y,Osanai M,Lee GH.NOTCH2 signaling confers immature morphology and aggressiveness in human hepatocellular carcinoma cells[J].Oncol Rep,2015,34(4):1650-1658.
[18]杨颖,马颖,毛睿,等.高尔基体蛋白73和上皮-间质转化相关分子在肝细胞肝癌组织中的表达及其与预后的关系[J].新疆医科大学学报,2015,38(2):174-177.
[19]Nagahara T,Shiraha H,Sawahara H,et al.Hepatic stellate cells promote upregulation of epithelial cell adhesion molecule and epithelial-mesenchymal transition in hepatic cancer cells[J].Oncol Rep,2015,34(3):1169-1177.
[20]吴畅,刘玉武,何琼琼,等.肝细胞肝癌中uPA及vimentin蛋白的表达及意义[J].中国普通外科杂志,2013,22(4):469-473.
Influence of hypoxia on expressions of E-Cadherin of epithelial cell and Vimentin of interstitial cell from liver cancer
CAO Wen-xi JIN Hui-han JI Yuan
Department of Hepatobiliary Surgery,the Second People′s Hospital of Wuxi City in Jiangsu Province,Wuxi 214002,China
Objective To explore the influence of hypoxia on expressions of E-Cadherin of epithelial cell and Vimentin of interstitial cell from liver cancer.Methods The cell line of human liver cancer including HepG2(low invasiveness)and SMMC7721(strong invasiveness)was selected.They were placed in hypoxia and normoxia conditions respectively. They were prepared for usage after 72-hour cultivation in incubator of 37℃.The morphology of hepatoma carcinoma cell,and Western blot detection outcome of E-Cadherin of epithelial cell and Vimentin of interstitial cell was compared respectively.Results Under inverted microscope,the cells in hypoxia condition changed from original closely aligned to loose spindle like change and cell was loose.Western blot detection indicated that in hypoxia condition,expression value of marked protein E-Cadherin of epithelial cell was greatly decreased compared with normal condition(normal oxygen)(P<0.01).The expression value of marked protein Vimentin of interstitial cell was remarkably increased(P<0.01).Under normoxia condition,hepatoma carcinoma cell displayed in epithelial polygon and compact arrangement.In hypoxia condition,it was connected in loose quasi-circle or spindle-like between hepatoma carcinoma cells.Conclusion Hypoxia will lead to morphological change,enhance the decrease of epithelial phenotype protein E-Cadherin expression and increase of interstitial protein Vimentin,and induce the transformation from epithelial type to interstitial one in hepatoma carcinoma cell.
Hypoxia;Liver cancer;E-Cadherin of epithelial cell;Vimentin of interstitial cell
R735.7
A
1674-4721(2015)12(b)-0004-04
2015-07-03 本文编辑:许俊琴)
南京医科大学科技发展基金面上项目(2011NJ MU114)

