原发性肺隐球酵母菌病36例临床特点分析
曾能永徐云欢孔晋亮
1.广西壮族自治区钦州市第二人民医院呼吸内科,广西钦州535000;2.广西医科大学第一附属医院呼吸内科,南宁530021
原发性肺隐球酵母菌病36例临床特点分析
曾能永1徐云欢1孔晋亮2▲
1.广西壮族自治区钦州市第二人民医院呼吸内科,广西钦州535000;2.广西医科大学第一附属医院呼吸内科,南宁530021
目的探讨原发性肺隐球酵母菌病的临床特点,为临床诊断原发性肺隐球酵母菌病提供依据,减少误诊漏诊。方法回顾性分析2003年10月~2013年11月10年期间我院病理确诊的36例原发性肺隐球酵母菌病患者的临床资料特点,包括患者人口学特征、临床症状、影像学资料、治疗方法和随诊结果。结果36例原发性肺隐球酵母菌病患者中,免疫功能正常者34例,2例有免疫功能异常;约50%患者有明确禽类排泄物接触史,无任何特殊接触史者占47.22%;临床症状以咳嗽、咳痰、胸痛和发热多见,发生率分别为69.44%、44.44%、36.11%和33.33%;影像学检查主要表现在下肺外带,以实变影及结节型居多,分别为58.33%、30.56%;获取病理方式以经皮穿刺肺活检应用最多(41.67%)。经手术治疗或抗真菌治疗后,随访5~131个月,均无死亡、全身播散或局部复发。结论原发性肺隐球酵母菌病在无禽类排泄物等特殊接触史的人群中亦有较高的发病率,大多数无基础疾病,临床症状以咳嗽、咳痰、胸痛、发热为主,影像学主要表现为近胸膜下的实变影及单结节影,经皮穿刺肺活检术是确诊的有效途径。病变局限者可行手术治疗,氟康唑为原发性肺隐球酵母菌病的有效治疗药物。
原发性肺隐球酵母菌病;临床特点;诊断
原发性肺隐球酵母菌病是一种亚急性或慢性肺部真菌病,主要由新型隐球菌感染所致,该病确诊时病变局限在肺部,尚无肺外脏器受累的表现。在免疫功能正常人群,其发病率有逐年增高趋势。原发性肺隐球酵母菌病临床症状及影像学表现较肺曲霉病缺乏特异性[1],容易误诊或延迟诊断。为更好地掌握此疾病特征,本研究回顾性分析我院10年间经病理确诊的36例原发性肺隐球酵母菌病患者的临床资料特点。
1 资料与方法
1.1 一般资料
收集2003年10月~2013年11月我院经组织病理确诊为原发性肺隐球酵母菌病的36例患者资料,其中男23例,女13例,年龄为16~77岁,平均年龄46岁。
1.2 诊断标准
参考美国感染病学会(Infectious Diseases Society of America,IDSA)2010年更新的隐球菌病管理指南[2]及隐球菌感染诊治专家共识[3]。本研究所有病例均经病理活检确诊为原发性肺隐球酵母菌病,病变肺组织标本均经组织化学染色或细胞化学染色方法检出隐球菌。
1.3 方法
回顾性分析36例原发性肺隐球酵母菌病患者的临床资料特点,包括患者人口学特征、临床症状、影像学资料、治疗方法和随诊结果。
2 结果
2.1 原发性肺隐球酵母菌病患者不同接触史发生率的统计
36例患者中有18例有明确禽类排泄物接触史,其中13例接触家禽排泄物,5例接触鸽子排泄物,占所有患者的50.00%,明显高于长期接触空调环境者(2.78%),但仍有较大部分患者(47.22%)无明显特殊接触史,值得临床医师警惕(表1)。

表1 36例患者不同接触史发生率的统计(n=36)
2.2 原发性肺隐球酵母菌病患者基础疾病的统计
36例患者中有2例因有系统性红斑狼疮基础病而长期使用糖皮质激素和细胞毒等药物,所有患者均无广谱抗生素长期应用史。有13例患者有其他基础疾病或并存病,其中高血压病4例(11.11%),乙肝病毒携带4例(11.11%),系统性红斑狼疮2例(5.56%),原发性血小板减少症1例(2.78%),肾结石2例(5.56%);其余的23例(63.89%)患者无任何基础疾病或者并存病。
2.3 原发性肺隐球酵母菌病患者临床症状发生率的统计
36例患者中有6例(16.67%)无任何症状,因其他疾病诊疗过程中或常规体检行胸片检查时发现肺部异常影像;其余的30例患者有临床症状,临床症状中以咳嗽最多,发生率为69.44%,明显高于其他症状;其次是咳痰和胸痛,发生率分别为44.44%、36.11%;发热发生率为33.33%,上述症状明显高于气促、咯血、盗汗、消瘦、头痛、呕吐等症状(表2)。

表2 36例患者临床症状发生率发生率的统计(n=36)
2.4 原发性肺隐球酵母菌病患者的影像学表现
36例患者中21例(58.33%)表现为肺部实变影,为最多见的影像学表现类型。其次为结节型(30.56%),其中又以单发结节型最多(25.00%);合并支气管充气征也较多见(25.00%),大多数分布于下肺野外带(19例,52.78%)(表3)。
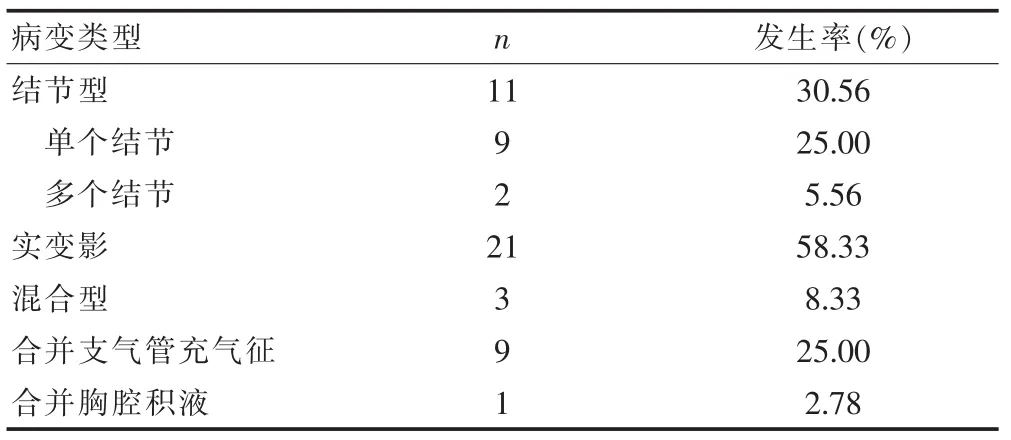
表3 36例患者影像学的表现(n=36)
2.5 获取原发性肺隐球酵母菌病患者病理的方法
经皮穿刺肺活检15例(41.67%),开胸肺活检12例,内科胸腔镜下肺活检6例,纤维支气管镜下行经支气管透壁肺活检术(TBLB)3例。
2.6 原发性肺隐球酵母菌病患者的治疗及转归
36例患者中17例行肺部病灶手术切除治疗,其中11例术后使用氟康唑(400 mg/d)治疗,疗程1~2个月。单纯应用氟康唑(400 mg/d)治疗者16例,疗程3~7个月。单纯应用二性霉素B治疗2例。先抗真菌药物后因病灶消除不明显行手术治疗1例。随访时间为5~131个月,均达临床治愈,均无死亡、全身播散或局部复发病例。
3 讨论
隐球酵母菌中新生隐球菌和格特隐球菌为人类主要致病菌。其中新生隐球酵母菌广泛分布于全球各地,在鸽子等鸟禽类粪便污染的土壤和某些树种的树皮和心材里密度较高,这可能是新生隐球酵母菌的主要生存环境[4]。格特隐球菌分布有地域性,主要分布在热带和亚热带地区[5],但近二十多年来加拿大温哥华岛和美国西北部太平洋沿岸等温带地区也出现了格特隐球菌感染的暴发[6-7],其相关原因可能与气候的变暖和暴露于格特隐球菌定植环境的易感人群增多有关[8-10]。隐球酵母菌在日常生活环境中亦广泛存在,与人们生活密切相关的空调器管道里也普遍检测到肺隐球酵母菌。当人群密切接触鸽子/家禽的粪便、长期呆在空调房间内[11],原发性肺隐球酵母菌病的发病率会大大增加。本组资料显示,约50.00%患者有禽类排泄物密切接触史。但值得警惕的是此类特殊接触史不是患病的必要条件,仍有较大部分患者(47.22%)无明显的特殊接触史,在临床上对于此特点应予以充分注意。
原发性肺隐球酵母菌病是一种侵袭性真菌感染和重要的机会感染,隐球酵母菌被人体吸入后通过芽生孢子到达肺泡,并在肺泡里繁殖和侵入组织而致病。既往大多数报道的原发性肺隐球酵母菌病主要发生在合并AIDS、自身免疫性疾病、长期使用肾上腺皮质激素、器官移植、恶性肿瘤、糖尿病、慢性阻塞性肺疾病(COPD)等基础疾病和长期应用细胞毒药物、免疫抑制剂或广谱抗生素等免疫功能低下患者。但近年相关研究显示,原发性肺隐球酵母菌病在免疫功能正常及无上述高危因素的人群中的发病率逐年增加[12]。在本组资料中,36例肺隐球酵母菌病患者中仅有2例为免疫功能异常患者(系统性红斑狼疮),占5.56%,剩余的34例患者免疫功能均正常,其中大部分原发性肺隐球酵母菌病患者(23例,63.89%),其无任何基础疾病或者并存病,提示在免疫功能正常人群中原发性肺隐球酵母菌病的发病率较高,和国内外相关研究结果相似[12-17]。
许多肺部隐球酵母菌感染患者症状轻微,常表现为咳嗽、咳痰、咯血、胸痛等呼吸道症状。本研究显示临床症状中以咳嗽居多,发生率为69.44%,其次较多见的是咳痰、胸痛和发热,而气促、咯血、盗汗、消瘦、头痛、呕吐等症状均较少见。但以上症状亦可见于肺部其他疾病,显示原发性肺隐球酵母菌病症状缺乏明显的特异性。此外,有约16.67%的患者可无任何临床症状,因其他疾病诊疗过程中或常规体检行胸片检查时发现肺部异常影像,值得引起临床注意。
原发性肺隐球酵母菌病胸部影像学表现多样且缺乏特异性,可以为单发肺结节、多发肺结节、实变影等多种表现,可合并有支气管充气征、空洞等,其中以肺实变影最常见,其次为单结节影,同时合并有支气管充气征者也较多见,与李瑞慧等[18]报道相似,常常导致临床医师误诊为肺炎、肺结核、肺部肿瘤等疾病。此外本组资料显示大多数患者的病灶位于下肺野外带胸膜下,这与徐礼裕等[19]报道类似。本组资料的患者均经有创检查后得以确诊,可能由于人们对健康重视程度的提高,更多人愿意接受有创检查明确诊断。其中经皮肺穿刺活检应用最多,这与影像学表现特点有关,提示经皮肺穿刺活检方法适用于原发性肺隐球酵母菌病的诊断。
原发性肺隐球酵母菌病治疗的目标是彻底清除隐球酵母菌的肺部病灶,同时要防止隐球酵母菌播散至中枢神经系统。对于轻度到中度的原发性肺隐球酵母菌病患者,建议予氟康唑(400 mg/d)治疗6~12个月。对于重度原发性肺隐球酵母菌病患者可用二性霉素B联合氟胞嘧啶诱导治疗,随后应用氟康唑序贯治疗[2]。对于药物控制不佳或肺部肿块影局限的可考虑手术切除[7]。本组36例患者中有16例单纯应用氟康唑治疗,17例病变局限者有11例术后应用氟康唑治疗,经长期随访均无死亡、复发或扩散,提示氟康唑应用于原发性肺隐球酵母菌病的单纯药物治疗或者术后延续治疗效果确切,值得临床推荐应用。
[1]张钦哲,孔晋亮,巫艳彬,等.肺曲霉菌病患者不同类型临床分析[J].中华医院感染学杂志,2013,23(24):5991-5993.
[2]Perfect JR,Dismukes WE,Dromer F,et al.Clinical practice guidelines for the management of cryptococcal disease:2010 update by the Infectious Diseases Society of America[J].Clin Infect Dis,2010,50(3):291-322.
[3]温海.隐球菌感染诊治专家共识[J].中国真菌学杂志,2010,5(2):65-68.
[4]Lazera MS,Cavalcanti MA,Londero AT,et al.Possible primary ecological niche of Cryptococcus neoformans[J].Med Mycol,2000,38(5):379-383.
[5]Warnock DW.Trends in the epidemiology of invasive fungal infections[J].JPN J Med Mycol,2007,48(1):1-12.
[6]Chambers C,MacDougall L,Li M,et al.Tourism and specific risk areas for Cryptococcus gattii,Vancouver Island,Canada[J].Emerg Infect Dis,2008,14(11):1781.
[7]Smith RM,Mba-Jonas A,Tourdjman M,et al.Treatment and outcomes patients with Cryptococcus gattii infections in the United States Pacific Northwest[J].PLoS One,2014,9(2):e88875.
[8]Billmyre RB,Croll D,Li W,et al.Highly recombinant VG Ⅱ Cryptococcus gattii population develops clonal outbreak clusters through both sexual macroevolution and asexual microevolution[J].AMBIO,2014,5(4):e01494.
[9]Engelthaler DM,Hicks ND,Gillece JD,et al.Cryptococcus gattii in North American Pacific Northwest:whole-population genome analysis provides insights into species evolution and dispersal[J].AMBIO,2014,5(4):e01464.[10]Hagen F,Ceresini PC,Polacheck I,et al.Ancient dispersal of the human fungal pathogen Cryptococcus gattii from the Amazon Rainforest[J].PLoS One,2013,8(8):e71148.
[11]Wilson SC,Palmatier RN,Andriychuk LA,et al.Mold contamination and air handling units[J].J Occup Environ Hyg,2007,4(7):483-491.
[12]Fang W,Fa ZZ,Liao WQ.Epidemiology of Cryptococcus and Cryptococcosis in China[J].Fungal Genet Biol,2015,78(15):7-15.
[13]Vilchez RA,Irish W,Lacomis J,et al.The clinical epidemiology of pulmonary cryptococcosis in non-AIDS patients at a tertiary care medical center[J].Medicine(Baltimore),2001,80(5):308-312.
[14]Nadrous HF,Antonios VS,Terrell CL,et al.Pulmonary cryptococcosis in non-immunocompromized patients[J].Chest,2003,124(6):2143-2147.
[15]YangCJ,Hwang JJ,WangTH.Clinicaland radiographic presentations of pulmonary cryptococcosis in immunocompetent patients[J].Scand J Infect Dis,2006,38(9):788-793.
[16]Zhang Y,Li N,Zhang YX,et al.Clinical analysis of 76 patients pathologically diagnosed with pulmonary cryptococcosis[J].Eur Respir J,2012,40(5):1191-1200.
[17]YeF,Xie JX,ZengQS.Retrospectiveanalysisof76 immunocompetent patients with primary pulmonary cryptococcosis[J].Lung,2012,190(3):339-346.
[18]李瑞慧,许能銮,谢宝松,等.原发性肺隐球酵母菌病临床分析[J].中华医院感染学杂志,2009,19(6):695-696.
[19]徐礼裕,柳德灵,余英豪,等.病理确诊的肺隐球菌病38例临床分析[J].中华结核和呼吸杂志,2011,34(9):653-656.
Clinical feature analysis of 36 primary lung hidden ball yeast disease
ZENG Neng-yong1XU Yun-huan1KONG Jin-liang2▲
1.Department of Respiratory Medicine,the Second People′s Hospital of Qinzhou in Guangxi,Guangxi Zhuang Autonomous Region,Qinzhou 535000,China;2.Department of Respiratory Medicine,the First Hospital Affiliated to Guangxi Medical University,Guangxi Zhuang Autonomous Region,Nanning 530021,China
Objective To explore the clinical feature of primary lung hidden ball yeast disease and provide basis for clinical diagnosis of primary lung hidden ball yeast disease to reduce misdiagnosis and missed diagnosis.Methods Clinical data feature of pathologically confirmed 36 primary lung hidden ball yeast disease patients from October 2003 to November 2013 of our hospital were retrospectively analyzed.The clinical data feature contained demographic characteristic,clinical symptoms,imaging data,therapy method and follow-up results of patients were analyzed.Results A-mong 36 primary lung hidden ball yeast disease patients,34 cases were normal immune function,only 2 cases had abnormal immune functions;about 50%patients with a clear contact history with poultry waste,without any special contact accounted for 47.22%;clinical symptoms were mainly of cough,expectoration,chest pain and fever,and the incidence rate were respectively 69.44%,44.44%,36.11%and 33.33%,obvious higher than other symptoms.Imaging examination mainly showed in low lung periphery,and were in the majority of consolidation shadows(58.33%)and nodular type(30.56%). Pathological obtained way was mostly application with percutaneous puncture lung biopsy(41.67%).After treated with operation or antifungal and followed-up for 5 to 131 months,no death,general body scattering or local recurrence occurred.Conclusion Primary lung hidden ball yeast disease also have a higher morbidity in people without any poultry waste special contact history,most without basic diseases,clinical symptoms were mainly of cough,expectoration,chest pain and fever,imaging mainly shows consolidation shadows and nodular type that close to the subpleural and percutaneous puncture lung biopsy is an effective way for diagnosis.Operation therapy is feasibility for pathological changes limited patients.Fluconazole is an effective drug of primary lung hidden ball yeast disease.
Primary lung hidden ball yeast disease;Clinical feature;Diagnosis
R519
A
1674-4721(2015)12(b)-0016-04
2015-09-12 本文编辑:卫轲)
国家自然科学基金资助项目(81260663);广西壮族自治区自然科学基金项目(2013GXNSFAA019166)
▲通讯作者

