单纯糖耐量受损者与空腹血糖受损并糖耐量受损者内皮功能及代谢异常的比较
吕以培 黄文萍 张素华 车红英 杨丕坚 黄中莹 黄 虹 卢伟波 李舒敏 罗文意
广西壮族自治区钦州市第二人民医院内分泌科,广西钦州535000
单纯糖耐量受损者与空腹血糖受损并糖耐量受损者内皮功能及代谢异常的比较
吕以培 黄文萍 张素华 车红英 杨丕坚 黄中莹 黄 虹 卢伟波 李舒敏 罗文意
广西壮族自治区钦州市第二人民医院内分泌科,广西钦州535000
目的比较单纯糖耐量受损者(I-IGT)和空腹血糖受损并糖耐量受损者(IFG+IGT)的内皮功能及代谢异常。方法根据2005年国际糖尿病联盟标准男性腰围≥90 cm、女性腰围≥80 cm为肥胖,分肥胖组与非肥胖组,选择2008年1月~2012年3月钦州市第二人民医院体检人员,包括I-IGT(D组)83例(非肥胖即D1组41例,肥胖即D2组42例)和IFG+IGT(E组)72例(非肥胖即E1组30例,肥胖即E2组42例),以正常糖耐量者(N组)142例(非肥胖即N1组75例,肥胖即N2组67例)作对照,采用口服葡萄糖耐量试验及胰岛素释放试验检测血糖、免疫活性胰岛素,同时检测空腹血脂、游离脂肪酸(FFA)、脂联素(APN)、超敏C反应蛋白(hs-CRP)、内皮素(SET),留取晨尿测定内皮素(UET)、尿微量白蛋白(MUA)。测量腰围、血压、身高和体质量。计算平均动脉压(MAP)、血糖曲线下面积(gluAUC)、10~30 min胰岛素净增值与血糖净增值的比值(ΔI/ΔG)、β细胞功能指数(HOMA-β)和胰岛素抵抗指数(HOMA-IR)等。结果校正性别、年龄后,E组与D组、E2组与D2组的hs-CRP、MUA、SET、UET比较,差异有统计学意义(P<0.05或P<0.01);E1组与D1组的UET比较,差异有统计学意义(P<0.05);E组与D组的三酰甘油(TG)、高密度脂蛋白胆固醇(HDL)、FFA、APN、空腹血糖(FPG)、糖耐量2 h血糖(2 hPG)、gluAUC、ΔI30/ΔG30、ΔI20/ΔG20、ΔI10/ΔG10、HOMA-β和HOMA-IR比较,差异有统计学意义(P<0.05或P<0.01);E1组与D1组的TG、HDL、FFA、APN、FPG、gluAUC、HOMA-IR、HOMA-β、ΔI30/ΔG30、ΔI20/ΔG20、ΔI10/ΔG10比较,差异有统计学意义(P<0.05或P<0.01);E2组与D2组的MAP、TG、HDL、FFA、APN、HOMA-IR、HOMA-β、FPG、2 hPG、gluAUC、ΔI20/ΔG20和ΔI10/ΔG10比较,差异有统计学意义(P<0.05)。结论与I-IGT比较,IFG+IGT内皮损害更严重,肥胖者大血管和微血管均加重,非肥胖者微血管加重明显;IFG+IGT肥胖者血压增高更明显,TG和FFA增高,HDL和APN降低;无论肥胖与否,血糖紊乱更重且胰岛功能下降,特别是早期相的下降及胰岛素抵抗更明显。
空腹血糖受损;糖耐量受损;内皮功能;代谢;肥胖
1997年WHO提出了空腹血糖受损和糖耐量受损的定义和诊断标准,1999年Weyer为探讨空腹血糖(FPG)和糖耐量2 h血糖(2 hPG)临床意义的异同,将糖调节受损分为3个亚类:①单纯空腹血糖受损(I-IFG,6.1 mmol/L≤FPG<7.0 mmol/L和2 hPG<7.8 mmol/L);②单纯糖耐量受损(I-IGT,FPG<6.1mmol/L和7.8mmol/L≤2 hPG<11.1 mmol/L);③FPG和2 hPG均受损(IFG+ IGT,6.1 mmol/L≤FPG<7.0 mmol/L和7.8 mmol/L≤2 hPG<11.0 mmol/L)。此类方法被广泛采用,对临床和研究工作起重要的指导作用。2006年WHO提出中间高血糖概念,即包括以上3个亚类,且诊断标准是相同的。对于IGT而言,一般泛指I-IGT和IFG+IGT,IGT的发病机制与心血管疾病和内皮功能的损害以及向糖尿病转化的情况已有较多的研究,但对I-IGT和IFG+ IGT两者肥胖和非肥胖的内皮功能改变及代谢状态改变异同的探讨还少见相关报道,现将本研究的观察情况报告如下。
1 资料与方法
1.1 一般资料
选择I-IGT 83例与IFG+IGT 72例作比较,按肥胖程度(根据国际糖尿病联盟标准,男性腰围≥90 cm、女性腰围≥80 cm为肥胖)分肥胖组与非肥胖组。I-IGT(D组)男35例,女48例,年龄31~60岁,平均(51.04± 8.62)岁,其中肥胖组(D2组)42例,男18例,女24例,平均(52.36±8.98)岁,非肥胖组(D1组)41例,男17例,女24例,平均(49.71±8.35)岁;IFG+IGT(E组)患者72例,男31例,女41例,年龄34~59岁,平均(51.00± 6.41)岁。其中肥胖组(E2组)42例,男17例,女25例,年龄(51.61±7.25)岁,非肥胖组(E1组)30例,男14例,女16例,年龄(50.15±5.21)岁,以正常糖耐量者(NGT, N组)共142例作对照,其中男66例,女76例,年龄22~60岁,平均(46.38±8.67)岁,分为肥胖组(N2组)67例,男31例,女36例,平均(46.25±10.03)岁,非肥胖组(N1组)75例,男35例,女40例,平均(46.49± 7.34)岁。排除标准:血液系统疾病、肝病或肝功能异常、周围血管疾病、全身或尿路感染、脑卒中、冠心病、血尿、其他原因引起的肾病与肾炎及肾功能不全、充血性心衰、发热、妊娠和吸烟者,近2周未用内皮保护剂、血管紧张素转换酶抑制剂、调脂药和胰岛素增敏剂,肥胖者排除继发性肥胖。受试前向所有受试者说明目的、过程、不良反应等,以自愿参加为原则。实验前3 d进食碳水化合物≥200 g/d,保证空腹时间>10 h,所有受试者为2008年1月~2012年3月在本院体检部体检人员,部分为2型糖尿病患者一级亲属。
1.2 研究方法
1.2.1 体检测量身高、体质量、腰围(肋弓下缘与髂前上嵴之间的中点)以及3 d早晨血压取平均数,计算体质量指数(BMI)、腰围指数(WI)和平均动脉压(MAP)。
1.2.2 血尿标本采集空腹查总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)、游离脂肪酸(FFA)、脂联素(APN)、内皮素(SET)和超敏C反应蛋白(hs-CRP);做口服葡萄糖(75 g)耐量试验及胰岛素释放试验,检测0、10、20、30、60、120 min血糖和免疫活性胰岛素;留取晨尿测定尿内皮素(UET)与微量白蛋白(MUA)。计算稳态模型胰岛素抵抗指数(HOMA-IR)、β细胞功能指数(HOMA-β)和胰岛素敏感指数(ISI)。HOMA-IR=空腹胰岛素(FINS)×FPG/22.5,HOMA-β=FINS×20/(FPG-3.5),HOMA-IR和HOMA-β取自然对数,ISI=1/(FINS×FPG)。用梯形面积公式计算葡萄糖曲线下面积(gluAUC)、胰岛素曲线下面积(INSAUC)以及胰岛素分泌早期相(0~30 min)曲线下面积(INSAUCone)与第二相(30~120min)胰岛素曲线下面积(INSAUCtwo),计算早期胰岛素分泌指标糖负荷后10、20、30 min胰岛素净增值与血糖净增值的比值ΔI10/ΔG10、ΔI20/ΔG20和ΔI30/ΔG30。
1.2.3 测定方法采用RIA法(天津协和医药科技有限公司试剂盒)测定INS;RIA法(北京科美生物技术有限公司试剂)测定ET;未抽提直接法测定UET;散射比浊法(西门子医学诊断产品有限公司试剂盒)测定MUA;免疫比浊法(北京利德曼生化股份有限公司试剂)测定hs-CRP;比色法(英国RANDOX laboratories Ltd.试剂)测定FFA;酶联免疫法(上海圆创生物科技有限公司)测定APN。血、尿标本留取后即放-20℃冰箱内保存,统一测定。
1.2.4 彩超检查彩超测定肱动脉休息时内径(Db)、加压时内径(Dh)及服用硝酸甘油后内径(Dn)变化,计算内皮依赖性血管舒张功能(EDD)ΔD%=(Dh-Db)/ Db×100%,内皮非依赖性血管舒张功能(EID)ΔD1%=(Dn-Db)/Db×100%。
1.3 统计学方法
采用SPSS 17.0统计软件对数据进行分析,计量资料以平均数±标准差(±s)表示,采用协方差分析(校正性别和年龄),以P<0.05为差异有统计学意义。
2 结果
2.1 各组BM I、W I、MAP及各项血管内皮功能指标的比较
D组与N组、E组与N组、E2组与E1组、D1组与N1组、E1组与N1组、N2组与N1组、E2组与D2组的MAP比较差异有统计学意义(P<0.05或P<0.01);D2组与D1组、E2组与E1组,N2组与N1组的BMI、WI比较,差异有统计学意义(P<0.01);D组与N组、E组与N组、D1组与N1组、E1与N1组、E2组与N2组、D2组与N2组的hs-CRP、MUA、SET、UET、EDD、EID比较,差异有统计学意义(P<0.05或P<0.01);E2组与E1组、E组与D组、E2组与D2组的hs-CRP、MUA、SET、UET比较,差异有统计学意义(P<0.05或P<0.01);N2组与N1组的hs-CRP、SET、UET比较,差异有统计学意义(P<0.05或P<0.01);D2组与D1组的hs-CRP比较,差异有统计学意义(P<0.01);E1组与D1组的UET比较,差异有统计学意义(P<0.05)(表1)。
表1 各组BMI、W I、MAP及各项血管内皮功能指标的比较(±s)
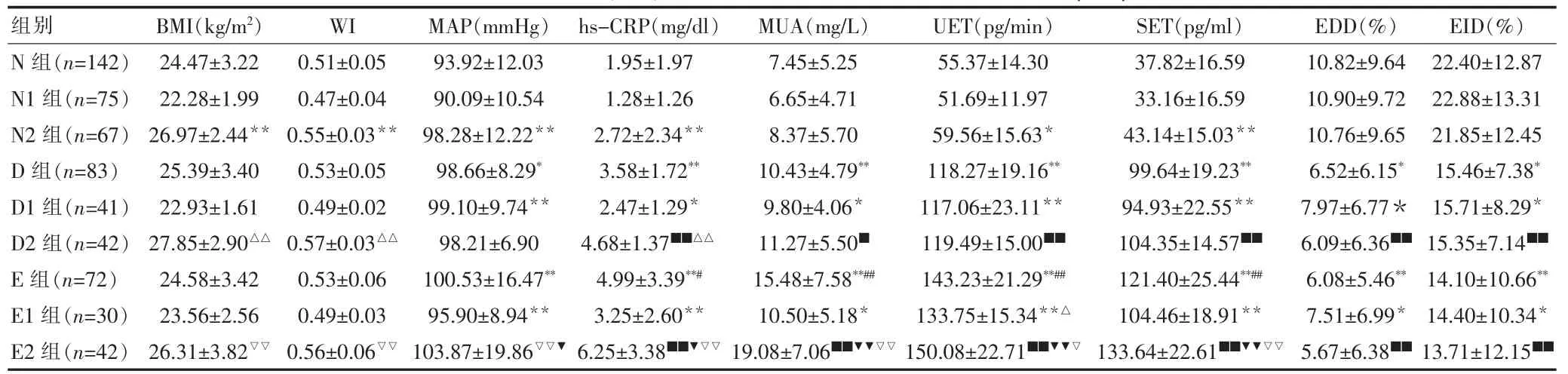
表1 各组BMI、W I、MAP及各项血管内皮功能指标的比较(±s)
与N组比较,*P<0.05,**P<0.01;与D组比较,#P<0.05,##P<0.01;与N1组比较,*P<0.05,**P<0.01;与N2组比较,■P<0.05,■■P<0.01;与D1组比较,△P<0.05,△△P<0.01;与D2组比较,▼P<0.05,▼▼P<0.01;与E1组比较,▽P<0.05,▽▽P<0.01
?
2.2 各组血脂指标、FFA、APN的比较
E组与D组、E组与N组、E2组与N2组、E1组与N1组、E1组与D1组、E2组与D2组、N2组与N1组的TG、HDL、FFA和APN比较,差异有统计学意义(P<0.05或P<0.01);D组与N组、D1组与N1组的FFA、APN比较,差异有统计学意义(P<0.05);D2组与D1组的TC、TG比较,差异有统计学意义(P<0.05);D2组与N2组的APN比较,差异有统计学意义(P<0.01)(表2)。
表2 各组血脂指标、FFA、APN的比较(mmol/L,±s)

表2 各组血脂指标、FFA、APN的比较(mmol/L,±s)
与N组比较,*P<0.05,**P<0.01;与D组比较,#P<0.05,##P<0.01;与N1组比较,*P<0.05,**P<0.01;与N2组比较,■P<0.05,■■P<0.01;与D1组比较,△P<0.05,△△P<0.01;与D2组比较,▼P<0.05,▼▼P<0.01
?
2.3 各组血糖、胰岛素水平及相关指标的比较
血糖:E组与N组、D组与N组、E1组与N1组、E2组与N2组、E2组与D2组、E组与D组的FPG、2 hPG、gluAUC比较,差异有统计学意义(P<0.05或P<0.01);D2组与N2组、D1组与N1组、N2组与N1组的2 hPG、gluAUC比较,差异有统计学意义(P<0.01);E1组与D1组的FPG、gluAUC比较,差异有统计学意义(P<0.01);D2组与D1组的FPG比较,差异有统计学意义(P<0.05)(表3)。
胰岛素水平:D组与N组、E1组与N1组的INS120、HOMA-β、INSAUCtwo比较,差异有统计学意义(P<0.05或P<0.01);E组与N组的FINS、INS120、HOMA-β、INSAUCone比较,差异有统计学意义(P<0.05或P<0.01);N2组与N1组的FINS、INS120、HOMA-β、INSAUC、INSAUCone和INSAUCtwo比较,差异有统计学意义(P<0.05或P<0.01);D1组与N1组的INS120、HOMA-β、INSAUC、INSAUCtwo比较,差异有统计学意义(P<0.01);D2组与N2组、E2组与N2组的INS120、HOMA-β、 INSAUCone比较,差异有统计学意义(P<0.05或P<0.01);E组与D组、E1组与D1组、E2组与D2组的HOMA-β比较,差异有统计学意义(P<0.01);E2组与E1组的FINS比较,差异有统计学意义(P<0.05)(表3)。
胰岛素分泌快速相:D与N组的ΔI30/ΔG30比较差异有统计学意义(P<0.05);D2组与N2组、N2组与N1组的ΔI20/ΔG20比较,差异有统计学意义(P<0.05);E组与N组、E组与D组、E1组与N1组、E1组与D1组、E2组与N2组的ΔI30/ΔG30、ΔI20/ΔG20、ΔI10/ΔG10比较,差异有统计学意义(P<0.05或P<0.01);E2组与D2组的ΔI20/ΔG20、ΔI10/ΔG10比较,差异有统计学意义(P<0.05)(表3)。
胰岛素抵抗:E组与N组、D组与N组、N2组与N1组、D1组与N1组、E1与N1组、E2组与N2组的HOMA-IR、ISI比较,差异有统计学意义(P<0.05或P<0.01);D2组与D1组、D2组与N2组、E组与D组、E1组与D1组、E2组与D2组的HOMA-IR比较,差异有统计学意义(P<0.05或P<0.01)(表3)。
表3 各组血糖、胰岛素水平及相关指标的比较(±s)

表3 各组血糖、胰岛素水平及相关指标的比较(±s)
与N组比较,*P<0.05,**P<0.01;与D组比较,#P<0.05,##P<0.01;与N1组比较,*P<0.05,**P<0.01;与N2组比较,■P<0.05,■■P<0.01;与D1组比较,△P<0.05,△△P<0.01;与D2组比较,▼P<0.05,▼▼P<0.01;与E1组比较,▽P<0.05
?
3 讨论
评价肥胖的指标有BMI、腰围、腰臀比及WI,本研究引入BMI、腰围及WI多角度评判肥胖以便于更客观地评判肥胖。本研究结果显示,WI和BMI有较高的一致性,WI是对腰围的修正,腰围和BMI区别:①多数代谢综合征诊断标准包含腰围;②腰围对于含脂比例较高的个体、脂肪分布异常较敏感,BMI对于含脂比例较低、非中心型肥胖较为敏感。对于非肥胖人群,WI在进展为糖尿病和血管性疾病的预警作用与BMI、腰臀比、腰围比较最优越。评价内皮功能的指标:EDD为肱动脉内皮细胞在压力作用下释放一氧化氮引起血管舒张,为大血管内皮功能改变的早期、敏感指标;EID为硝酸甘油激活鸟苷酸环化酶的提供一氧化氮使血管舒张,为大血管内皮改变较晚的指标;hs-CRP反映血管壁炎症,是大血管病变指标;内皮细胞功能改变同时其分泌SET改变,是内皮功能改变早期敏感指标,无大血管与微血管的特异性;MUA和大血管病变关系密切,在非糖尿病的人群中主要提示大血管病变;肾源性ET为UET的主要来源,UET能准确敏感反映肾小球血管内皮细胞功能改变,是微血管病变指标。
本研究结果显示,与非肥胖者比较,NGT肥胖者hs-CRP、SET及UET出现了明显改变,说明NGT肥胖者已经发生了大血管和微血管内皮功能的异常[1];与NGT比较,I-IGT各项内皮指标均有改变,说明IIGT有大血管和微血管病变[2-3],IFG+IGT的hs-CRP、MUA、SET、UET与I-IGT比较有明显差异,说明无论是大血管还是微血管内皮功能损害IFG+IGT更严重,与相关报道相一致[4-5];IFG+IGT非肥胖者各项内皮指标均有改变,与I-IGT非肥胖者比较,UET有明显差异,说明IFG+IGT非肥胖者大血管和微血管内皮功能均损害,但相对于I-IGT非肥胖者而言,微血管内皮功能损害更严重;IFG+IGT肥胖者hs-CRP、MUA、SET、UET与I-IGT肥胖者比较,有明显差异,说明IFG+IGT肥胖者大血管和微血管均较I-IGT肥胖者严重。总之,IFG+IGT内皮损害更严重,肥胖者大血管和微血管损害均加重,非肥胖者微血管损害加重为主。
NGT肥胖者与NGT非肥胖者的MAP比较,差异有统计学意义,说明肥胖影响血压[6-7];I-IGT和IFG+IGT与NGT非肥胖者相比血压有增高的趋势,而IFG+IGT差异更显著,说明血糖与血压关系密切[8],I-IGT和IFG+IGT的血压差异不大,但肥胖IFG+IGT较肥胖I-IGT更高,肥胖IFG+IGT与非肥胖IFG+IGT差别显著,说明在IFG+IGT阶段血糖因素及肥胖因素都影响血压[9];IFG+IGT、I-IGT与NGT比较,NGT→IIGT→IFG+IGT以其中FFA、TG逐步增高而APN、HDL逐步降低为规律表现,说明糖代谢紊乱加重与脂代谢紊乱有关;IFG+IGT、I-IGT与NGT比较,NGT→I-IGT→IFG+IGT呈FPG、2 hPG和gluAUC逐步增高,各组非肥胖和肥胖者之间差别不明显;I-IGT与IFG+IGT有INS120增高表现,I-IGT和IFG+IGT非肥胖者以INSAUCtwo增高,而肥胖者以INSAUCone降低为表现,IFG+IGT及其肥胖和非肥胖者各时段10~30 min的ΔI/ΔG均低,IFG+IGT非肥胖者ΔI10/ ΔG10、ΔI20/ΔG20、ΔI30/ΔG30均低于I-IGT非肥胖者,IFG+IGT肥胖者ΔI10/ΔG10、ΔI20/ΔG20低于IIGT肥胖者。无论肥胖与否,NGT→I-IGT→IFG+IGT呈HOMA-β逐步下降、HOMA-IR逐步增高,说明IIGT和IFG+IGT均出现了胰岛β细胞对糖反应能力下降,IFG+IGT胰岛功能下降特别是早期相的下降及胰岛素抵抗更明显[10-11],除肥胖者外非肥胖者也出现明显胰岛素抵抗,肥胖不是胰岛素抵抗的唯一因素[12-13]。I-IFG与肝脏胰岛素抵抗、葡萄糖输出抑制受损以及胰岛细胞功能不良有关,表现为胰岛素抵抗较重、早期胰岛素分泌尚正常及基础状态下胰岛素分泌下降;I-IGT与早期胰岛素分泌下降、外周组织对胰岛素的敏感度下降而对葡萄糖的处理能力减低有关,表现为胰岛素抵抗轻、基础状态下胰岛素分泌尚正常及早期胰岛素分泌下降,本组IFG+IGT表现和I-IGT特点相似为主,在程度上加重。
综上所述,与I-IGT比较,IFG+IGT内皮损害更严重,肥胖者大血管和微血管损害均加重,非肥胖者微血管损害加重明显;IFG+IGT肥胖者血压增高更明显;TG和FFA增高,HDL和APN降低;无论肥胖与否,血糖紊乱更重且胰岛功能下降,特别是早期相的下降及胰岛素抵抗更明显。
[1]Muris DM,Houben AJ,Schram MT,et al.Microvascular dysfunction:an emerging pathway in the pathogenesis of obesity-related insulin resistance[J].Rev Endocr Metab Disord,2013,14(1):29-38.
[2]Jessani SS,Lane DA,Shantsila E,et al.Impaired glucose tolerance and endothelial damage,as assessed by levels of von Willebrand factor and circulating endothelial cells,following acute myocardial infarction[J].Ann Med,2009,41(8):608-618.
[3]Singleton JR,Smith AG,Russell JW,et al.Microvascular complications of impaired glucose tolerance[J].Diabetes,2003,52(12):2867-2873.
[4]Lü Q,Tong N,Liu Y,et al.Community-based population data indicates the significant alterations of insulin resistance,chronic inflammation and urine ACR in IFG combined IGT group among prediabetic population[J].Diabetes Res Clin Pract,2009,84(3):319-324.
[5]Unwin N,Shaw J,Zimmet P,et al.Impaired glucose tolerance and impaired fasting glycaemia:the current status on definition and intervention[J].Diabet Med,2002,19(9):708-723.
[6]Li X,Xu J,Yao H,et al.Obesity and overweight prevalence and its association with undiagnosed hypertension in Shanghai population,China:a cross-sectional population-based survey[J].Front Med,2012,6(3):322-328.
[9]Lin S,Cheng TO,Liu X,et al.Impact of dysglycemia,body mass index,and waist-to-hip ratio on the prevalence of systemic hypertension in a lean Chinese population[J].Am J Cardiol,2006,97(6):839-842.
[10]Abdul-Ghani MA,Sabbah M,Kher J,et al.Different contributions of insulin resistance and beta-cell dysfunction in overweight Israeli Arabs with IFG and IGT[J].Diabetes Metab Res Rev,2006,22(2):126-130.
[11]Kanat M,Norton L,Winnier D,et al.Impaired early-but not late-phase insulin secretion in subjects with impaired fasting glucose[J].Acta Diabetol,2011,48(3):209-217.
[12]Chun YH,Han K,Park SH,et al.Insulin resistance is associated with intraocular pressure elevation in a non-obese Korean population[J].PLoS One,2015,10(1):e112929.
[13]Sun Y,Li W,Hou X,et al.Triglycerides and ratio of triglycerides to high-density lipoprotein cholesterol are better than liver enzymes to identify insulin resistance in urban middle-aged and older non-obese Chinese without diabetes[J].Chin Med J(Engl),2014,127(10):1858-1862.
Comparison the endothelial function and metabolic disorder between pure impaired glucose tolerance and impaired fasting glucose combined with impaired glucose tolerance
LV Yi-pei HUANG Wen-ping ZHANG Su-hua CHE Hong-ying YANG Pi-jian HUANG Zhong-ying HUANG Hong LU Wei-bo LI Shu-min LUO Wen-yi
Department of Endocrinology,the Second People′s Hospital of Qinzhou City in Guangxi Zhuang Autonomous Region,Qinzhou 535000,China
Objective To compare the difference of endothelial function and metabolic disorder between pure impaired glucose tolerance(I-IGT)and impaired fasting glucose combined with impaired glucose tolerance(IFG+IGT).Methods Patients were divided into obesity group and non-obesity group according to the 2005 international diabetes federation standard that male waist more than 90 cm or female waist more than 80 cm,and were regarded as obesity.Physical examination personnel from January 2008 to March 2012 of the Second People′s Hospital were selected and contained IIGT(group D,n=83,non-obesity was 41 cases as group D1 and obesity was 42 cases as group D2),compared with IFG+ IGT(group E,n=72,obesity was 42 cases as group E2 and non-obesity was 30 cases as group D1)and normal glucose tolerance(group N,n=142,non-obesity was 75 cases as group N1 and obesity was 67 cases as group N2)as control.Oral glucose tolerance test and insulin releasing test were conducted to detect blood glucose and immune reactive insulin.At the same time,fasting lipid,free fatty acid(FFA),adiponectin(APN),hypersensitive c-reactive protein(hs-CRP)and endothelin(SET)was tested respectively.Urine endothelin(UET)and urine microalbminurin were tested by returning the morning urine.Waistline,blood pressure,height and body mass was tested respectively.Mean arterial pressure(MAP),area under the curve of glucose(gluAUC),the ratio of insulin net added value and blood glucose net added value in 10 to 30 minutes(ΔI/ΔG),β-cell function index(HOMA-β)and insulin resistance index(HOMA-IR)were counted.Results After adjustment sex and age,the difference of hs-CRP,MUA,SET and UET was statistically significant when group E and group D compared with group E2 and group D2(P<0.05 or P<0.01).The difference of UET was statistically significant when group E1 compared with group D1(P<0.05).The difference of TG,HDL,FFA,APN,FPG,2 hPG,gluAUC,ΔI30/ΔG30,ΔI20/ΔG20,ΔI10/ΔG10,HOMA-β and HOMA-IR was statistically significant when group E compared with group D(P<0.05 or P<0.01).The difference of TG,HDL,FFA,APN,FPG,gluAUC,HOMA-IR,HOMA-β,ΔI30/ΔG30,ΔI20/ΔG20 and ΔI10/ΔG10 was statistically significant when group E1 compared with group D1(P<0.05 or P<0.01).The difference of MAP,TG,HDL,FFA,APN,HOMA-IR,HOMA-β,FPG,2 hPG,gluAUC,ΔI20/ΔG20 and ΔI10/ΔG10 was statistically significant when group E2 compared with group D2(P<0.05).Conclusion Comparing with I-IGT,the endothelial damage in IFG+IGT is more serious,both of large blood vessels and capillaries in obesities aggravates and the capillaries in non-obesity aggravates obvious;blood pressure increases in IFG+IGT obesities is more obvious;TG and FFA increases while HDL and APN decreases;dysglycemia is more serious,islet function declines especially in the early and insulin resistance is more obvious.
Impaired fasting glucose;Impaired glucose tolerance;Endothelial function;Metabolism;Obesity
R587.1
A
1674-4721(2015)12(b)-0011-06
2015-09-08 本文编辑:王红双)
广西壮族自治区科学研究与技术开发计划项目(桂科攻0816004-26)
吕以培(1969-),男,硕士,副主任医师,主要研究方向:糖尿病慢性并发症的发病机制及防治

