小麦淀粉废水发酵生产丁醇
潘贺鹏,罗 玮,顾秋亚,余晓斌
(江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122)
小麦淀粉废水发酵生产丁醇
潘贺鹏,罗 玮,顾秋亚,余晓斌
(江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122)
为降低丁醇发酵的生产成本,以工业废弃物小麦淀粉废水为辅料,在分析废水组成的基础之上补加适当营养成分发酵生产丁醇。选取对丁醇发酵影响最大的木薯浓度、N源种类、N源浓度、无机盐和原料处理方式等因素分别进行考察。结果表明:对于低浓度废水,添加70g/L木薯、2g/L酵母粉、1g/L K2HPO4,原料糊化水解,能够获得较好的摇瓶发酵效果,丁醇和总溶剂产量最高可分别达到14.72和22.65g/L。在7 L发酵罐水平上,丁醇和总溶剂产量也分别能达到13.51和23.13g/L。最终,利用生物柴油进行萃取发酵,其溶剂水平得到进一步提高,丁醇和总溶剂产量可分别达到15.13和29.38g/L。
小麦淀粉;废水;丁醇;萃取发酵
在小麦淀粉加工过程中会产生大量高浓度酸性有机废水,废水主要成分为溶解性的淀粉、戊聚糖、灰分和少量蛋白质。每年我国的小麦淀粉生产企业在生产过程中会排放大约2.4×107t淀粉废水,虽然淀粉废水一般没有毒性,但直接将废水排放到环境水体中,不仅会造成水资源的浪费,而且会对环境造成严重危害。废水的化学需氧量(COD)通常为1~30g/L,悬浮固体(SS)为1.5g/L[1],排放之前须经过厌氧或者好氧处理(如上流式厌氧污泥床反应器(UASB)),将废水中的COD降至0.15g/L以下才符合国家规定排放标准。目前,国内外对废水的综合利用主要体现在单细胞蛋白[2]、食用菌、微生物絮凝剂[3]和生物农药等工业产品上,而利用淀粉废水生产丁醇的研究报道并不多见。
随着经济的高速发展,人类对能源的需求日益增大。生物丁醇作为一种全新的绿色能源,具有生产条件温和、操作简单以及可以直接代替汽油使用等特点,这些优势使其逐渐成为人类的理想能源。但是,高成本是生物丁醇工业化的最大障碍,丁醇产量难以大幅度提高,造成了当前相关研究只能局限于实验室规模而难以投入生产[4]。若使用淀粉废水为原料,能一定程度降低生产成本,在优化后的废水培养基的基础上再用液液萃取的方法,进一步降低有机溶剂对菌体的毒性,提高其产量。笔者将对小麦淀粉废水生产丁醇进行研究,以期为此类废水的利用提供新的思路。
1 材料与方法
1.1 菌种
丙酮丁醇梭状芽胞杆菌(Clostridium acetobutylicum)NU22,保藏于工业生物技术教育部重点实验室。
1.2 培养基
TYA固体培养基(g/L):葡萄糖40、酵母粉2、牛肉膏2、胰蛋白胨6、CH3COONH43、K2HPO40.5、MgSO40.2、FeSO4·7H2O 0.01、琼脂20;pH自然,121℃灭菌30min。
种子培养基:质量分数5%玉米醪和玉米粉50g/L,100℃糊化30min;pH自然。
玉米发酵培养基:质量分数7%玉米醪和玉米粉70g/L,100℃糊化30min;pH自然。
木薯发酵培养基:木薯粉70g/L,100℃糊化30min;pH自然。
废水培养基:质量分数1%淀粉废水,5%~10%木薯粉,加入高温α-淀粉酶(酶用量为每克淀粉10 U)于沸水浴中液化30min,调节pH至7.0。
小麦淀粉废水取自江苏联海生物科技有限公司。
1.3 方法
1.3.1 厌氧培养方法
小瓶实验:将甘油管中保藏的种子置于100℃下水浴60 s,涂布在TYA固体平板上,平板放置在厌氧盒中,在侧边隔层放置厌氧袋,37℃厌氧培养24 h。待菌株生长至对数生长期,刮取较大的菌落接种到5%的种子培养基中,37℃培养24 h。将生长旺盛的种子按照8%的接种量接种到废水发酵培养基中或者7%的玉米发酵培养基中,三角瓶需塞上发酵栓,发酵小瓶在瓶口插上排气导管,出口水封,静置培养。
上罐实验:菌种活化和种子制备过程同上,将生长至对数期的液体种子按照10%的接种量接种到5 L发酵罐中,向罐内通入N2,在每次取样前后再次通入N2,隔绝空气静置培养。
1.3.2 小麦淀粉废水分析方法
水分含量测定用水分天平测定;淀粉含量测定参照文献[5];粗纤维含量测定和灰分含量测定参照文献[6];粗蛋白含量测定用定氮仪测定总含氮量,总含氮量×6.25折算为粗蛋白含量。
1.3.3 木薯预处理
将木薯去皮、粉碎、烘干,过40μm筛子,备用[7]。100℃糊化30min;90℃下液化水解20min,定容,pH调至6,121℃灭菌20min。
1.3.4 残糖测定
向1mL发酵液中加入10mL 2mol/L的盐酸,沸水浴40min,确保溶液中的大分子多糖全部转化为葡萄糖,然后蒸馏水定容至25mL,使用SBA-40E型生物传感仪(山东省科学院生物研究所)对发酵液中残余的葡萄糖进行定量测定。
1.3.5 溶剂分析方法
发酵液经5 000r/min离心10min后,取上清液3mL,0.45μm微滤膜过滤,滤液采用GC-2010型气相色谱仪(日本岛津公司)进行检测[8]。检测器为火焰离子化检测器(FID);色谱柱为PEG1701-30M(0.53 mm×1.0μm);进样温度为160℃;检测温度为250℃;柱温为40℃(保温3min)~180℃(保温5min),升温速率10℃/min;载气为N2,流速为1.5mL/min;H2的流速47mL/min。
1.3.6 生物柴油预处理方法
生物柴油中含有水溶性有毒物质,并且会降低萃取效率,因此在使用前需进行水洗处理。在500mL三角瓶中按1∶1的体积比加入生物柴油和蒸馏水,置于摇床中,以200r/min的转速振荡混合2 h以上,然后静置分层,利用分液漏斗进行两相分离,油相作为萃取剂备用[9]。
1.3.7 萃取发酵方法
将生物柴油按照一定比例加入到装有50mL发酵培养基的厌氧发酵小瓶中,待接过种之后,连接上输气管,末端置于水中液封。在37℃下培养至发酵终止,利用分液漏斗将油相和水相进行分离,分别测定两相中的有机溶剂浓度。
2 结果与讨论
2.1 淀粉废水分析结果
淀粉废水分析结果如表1所示。
由表1可知:淀粉废水中主要C源为淀粉和粗纤维,是可以被C.acetobutylicum NU22利用的C源,而蛋白质含量较低,可以一定程度地补充N源。此种废水的最大特点是pH较低,在此pH条件下微生物无法正常生长繁殖,需要将pH调节至中性左右。

表1 低浓度淀粉废水主要指标Table 1 Main ingredients of starch wastewater with low concentration
2.2 低浓度淀粉废水中补加木薯原料发酵
2.2.1 木薯预处理对发酵的影响
低浓度废水中淀粉的质量浓度在20g/L左右,C源严重不足,需要向其中补加C源,选用木薯进行试验。木薯经过粉碎、过筛、糊化之后可能仍需要进一步的处理,因而对木薯的水解处理方式也进行了考察,同时向淀粉废水中添加50g/L木薯以考察添加木薯对丁醇发酵的有效性,结果见表2。
由表2可以看出:木薯在经过糊化液化水解之后更容易被菌体利用,溶剂产量也进一步提高。这是由于该菌的淀粉酶活力有限,不足以将发酵液中的淀粉完全水解以满足菌体生长的需求。残糖量数据恰好可证实这一点,木薯经水解之后能够被菌体更为彻底地利用。向低浓度小麦淀粉废水中添加木薯,溶剂的产量也有很大幅度提升。这是由于废水中匮乏C源,N源亦不能满足需求,补加木薯在一定程度上缓解了这种需求。因此,确定了向废水中补加木薯水解液的有效性。4个组别间pH的差异主要是由于培养基中N源物质的匮乏,N源充足可顺利实现有机酸向溶剂的转型[10],若不足则残留有大量酸,发酵液pH就偏低。由此可知,需要向培养基中补加N源。
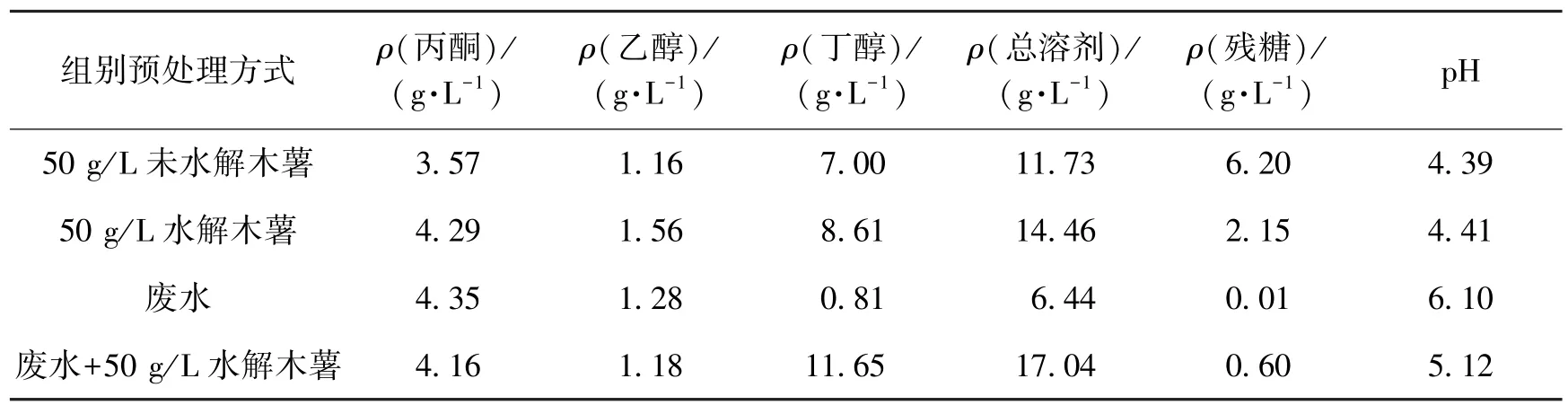
表2 木薯水解及添加水解物对溶剂产量的影响Table 2 Effects of hydrolysis and adding of cassava on solvent production
2.2.2 木薯质量浓度对发酵的影响
废水培养基中木薯的添加量直接影响溶剂的产量,添加量不足则难以满足菌体的生长需求,添加量过多则使残糖量增大,违背了废物利用的初衷。因此,笔者就废水木薯的最佳添加量进行了优化,同时附带考察菌体对糖的利用效率。分别以50、60、70、80、90和100g/L的纯木薯淀粉以及添加废水的上述组别进行丁醇发酵试验,考察菌株利用木薯粉的发酵产溶剂性能,结果如图1和图2所示。
由图1可以看出:在纯木薯发酵组中,随着木薯粉质量浓度的提高,丁醇的产量也同步提高,总溶剂也呈现同步变化,直至木薯质量浓度达到90g/L后开始出现下降趋势。说明此时发酵液中糖浓度过高,已经出现糖抑制现象。而对于废水木薯混合发酵组来说,在50g/L的木薯时,相对于纯木薯发酵,丁醇和总溶剂产量同比分别增加 37.74%和21.09%;随着木薯浓度的增加,溶剂产量也是稳步提升,直至高于80g/L时,二者产量才开始下降,丁醇及总溶剂最高产量分别达到13.06和19.94g/L。由上述结果可知,当木薯质量浓度低于80g/L时,废水对发酵的促进作用最为明显,在木薯质量浓度达到80g/L时,C源已经不是限制因素,而其他营养物质成为主要限制因素,比如可以适量补加N源以进一步优化培养。
由图2可知:在低于60g/L的木薯质量浓度下,残糖量较低,在70g/L之后,残糖量一直急剧增加,木薯质量浓度在达到80g/L以后,此时糖已经开始有大量剩余,残糖量达到了8.2g/L,虽然此时溶剂量最大,但残糖量较高背离了笔者研究废物利用的初衷。综合考虑产量和残糖量,对于淀粉废水中木薯添加量选择70g/L的木薯质量浓度作为最佳添加量。由图1可知,废水混合70g/L木薯用于发酵,相对于纯木薯发酵而言,丁醇和总溶剂产量分别提高了 17.36%和 13.28%,残糖量下降了30.77%,同时节约了工业用水。
2.2.3 无机盐对丁醇发酵的影响
淀粉废水中的各类无机盐离子含量并非菌株生长的最适浓度,根据周灿灿[11]研究,Mg2+、磷酸盐、Ca2+及Fe2+等无机盐离子对丙酮丁醇发酵(ABE发酵)都有较为显著的影响,故而对无机盐离子进行优化。分别对这几种无机盐选择0.5X、X和1.5Xg/L的质量浓度进行试验,X为每一种盐对应的标准浓度。FeSO4、K2HPO4、MgSO4和CaCO3对应的X值分别为0.15、1.00、0.15和0.10g/L,每种无机盐中的最高产量如表3所示。
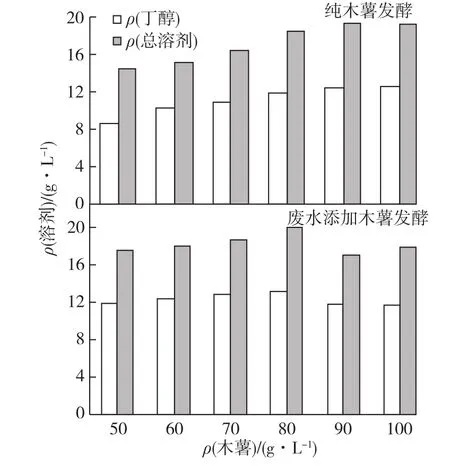
图1 木薯质量浓度对丁醇产量的影响Fig.1 Effects of cassava concentrations on butanol production

图2 发酵液中残糖量Fig.2 Amount of residual sugar in fermentation broth

表3 无机盐对溶剂产量的影响Table 3 Effects of inorganic salt on solvent production
从表3可以看出:只有K2HPO4对丁醇发酵有一定程度影响,其他种类的无机盐影响都不大。而通过试验可知,K2HPO4的添加量在1g/L左右时对丁醇发酵的正作用最佳。
2.2.4 N源对发酵的影响
木薯淀粉中的N元素含量较低,难以满足菌株的生长需求,需要向发酵液中补加N源[12-13]。现挑选微生物易利用的6种N源类物质作为考察,分别为酵母粉、胰蛋白胨、玉米浆、乙酸铵、(NH4)2SO4和尿素,按照碳氮比(碳氮物质的量之比)20∶1的比例补加N源类物质。以废水添加70g/L木薯水解液作为对照组,分别向其中补加不同种类的N源类物质,考察菌株对N源的需求情况,发酵结果见图3。

图3 N源对丁醇和总溶剂的影响Fig.3 Effects of nitrogen sources on butanol and total solvent yields
由图3可知:有机N源中酵母粉和玉米浆的效果最佳,丁醇和总溶剂产量均较高,分别达到了14.72、22.6g/L和13.06、20.15g/L,并且酵母粉组别残糖量剩余较少,而无机N源中只有乙酸铵有一定效果,并且无机N源组菌体生长明显弱于有机N源组。从溶剂产量和残糖量比较可知,酵母粉是废水培养基中的最佳N源,下面对其添加量进行优化。
2.2.5 酵母粉质量浓度对发酵的影响
酵母粉作为发酵的主要N源,其质量浓度对发酵效果有很大影响,向上述已改进的培养基中添加不同浓度酵母粉,考察酵母粉质量浓度对丁醇发酵的影响,结果见图4。

图4 酵母粉质量浓度对溶剂产量的影响Fig.4 Effects of yeast extract concentrations on solvent production
由图4可知:在培养基优化时,并不是营养越丰富,产量就越高。在N源过高时,营养物质反而会对产品的发酵产生抑制效应。在酵母粉质量浓度为2.0g/L的情况下,丁醇和总溶剂产量都能达到最佳,分别为14.72和22.65g/L,相对于70g/L纯木薯培养基,分别提高了35%和37%,且残糖量并不高,仅有3.24g/L,这就同时满足了降低残糖和促进溶剂合成的要求。
综上所述,选择向废水中添加70g/L木薯、1g/L K2HPO4和2g/L酵母粉,原料糊化水解,这样的培养基组成是该菌株最利于进行丁醇发酵的配方,此为废水优化培养基。
2.2.6 发酵罐中发酵性能
分别以70g/L的纯木薯、10g/L的小麦淀粉废水+70g/L的木薯粉和废水优化培养基作为发酵培养基,在7 L发酵罐上进行丁醇发酵实验,前期每隔12 h取一次样品,中后期每隔4 h取一次样品。发酵过程中各溶剂与残糖以及发酵液pH随时间变化关系曲线如图5所示。
由图5和实验可知:在发酵的第8小时,菌体开始大量产气,发酵罐的顶部出现明显的厚厚一层醪盖,发酵过程的第12小时开始,溶剂开始大量合成,产酸也最为旺盛。以纯木薯为培养基发酵,pH最先开始上升,将有机酸转化为溶剂,其他2组稍晚。第68小时开始,到达发酵后期,菌体生长减缓直至停止的时候,醪盖消失。到达发酵终点时,3组的丁醇和总溶剂产量分别达到11.09、12.71、13.50g/L和19.25、22.06、23.13g/L。相应地,发酵液残糖和总溶剂生产强度分别为 14.38、10.47、6.47g/L和0.21、0.30、0.32g/(L·h)。由此可知,添加淀粉废水后不仅能够提高溶剂产量,还能增加菌体对底物的利用效率。另外从发酵曲线上也能看出,优化后的培养基还能大大缩短发酵周期,以纯木薯为培养基发酵,由100 h左右到优化培养基发酵68 h左右,这对于缩短丁醇的生产周期和降低生产成本具有重要意义。
相对于小瓶发酵,上罐发酵的残糖量较大,同样的条件下也无法达到小瓶试验的溶剂产量水平。在罐上发酵时,对于本次厌氧发酵来说,由于采用静态发酵,会导致传质效果不佳;另外,在取样时较容易混入空气,轴封不严使O2混入等都有可能影响菌体生长,最终导致残糖量升高和溶剂量下降。为了提高菌体对底物的利用情况,可采用萃取发酵的方式,即可降低有机溶剂对菌体的毒害作用,又能提高对底物的利用率[14]。
谭秀花[7]以小麦淀粉废水添加质量分数为5%木薯进行丁醇发酵,经培养基优化后,丁醇与总溶剂最高产量分别可达到19.32和32.34g/L。Thang等[13]使用Clostridium saccharoperbutylacetonicum N1-4,以质量分数为7%木薯淀粉进行分批发酵试验,丁醇及总溶剂产量分别为16.2和20.5g/L,同样条件下Lépiz-Aguilar等[15]以C.beijerinckii BA101为出发菌株进行丁醇发酵,总溶剂及生产强度分别为27.28g/L和0.28g/(L·h)。本文实验结果与国外最高水平仍有一定差距。
2.2.7 萃取发酵结果
以生物柴油为萃取剂[16],采用废水优化培养基,按照油水体积比为3∶5进行萃取发酵,接种之后按照小瓶厌氧发酵模式进行。萃取发酵结果如表4所示。

图5 发酵过程曲线Fig.5 Curves of batch fermentation of C.acetobutylicum
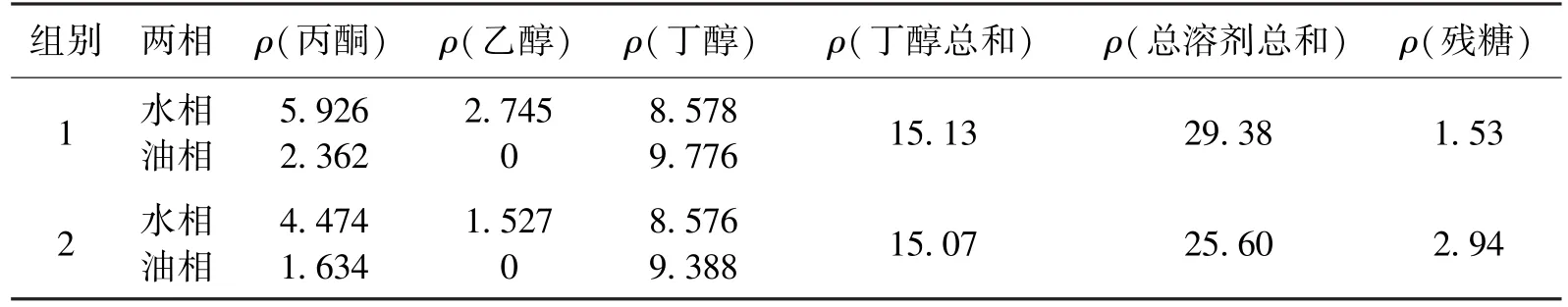
表4 废水培养基萃取发酵结果Table 4 Extractive fermentation results with waste water mediumg/L
由表4可知,萃取发酵对丁醇产量的提高并不明显,但是大大提高了丙酮的产量,而且残糖量进一步下降,这样就达到了既提高溶剂产量、又降低残糖量的目的。丁醇在水相和油相里面的浓度较为接近,这是萃取剂生物柴油的萃取特性所决定的。生物柴油对水溶液中丁醇的萃取率为0.6左右,对乙醇的萃取率为0,对丙酮的萃取率为0.3,由此可见该萃取剂对丁醇的萃取选择性还是较高的。
3 结论
对于低浓度废水,需要补加70g/L木薯、1g/L K2HPO4、2g/L酵母粉,原料糊化水解,这样的培养基组成最利于该菌株进行丁醇发酵。相对于纯木薯培养基,优化后的培养基发酵可使丁醇和总溶剂产量分别提高35%和37%。
上罐发酵的效果基本满足要求,丁醇、总溶剂产量及生产强度分别达到13.50、23.13g/L和0.32g/(L·h),溶剂产量略低于小瓶水平。此结果为淀粉废水投入丁醇的工业生产提供了重要参考,具有一定可行性。
利用废水培养基进行萃取发酵能够较好地解决残糖高的问题,最终丁醇和总溶剂产量分别可达到15.13和29.38g/L。考虑到C源消耗较为彻底,可继续提高废水培养基中的木薯浓度进行萃取发酵,以进一步提高溶剂的产量。
[1]伍婵翠,刘康怀.淀粉废水资源化利用的现状和前景[J].矿产与地质,2004,18(2):179-182.
[2]金惠平.利用淀粉废水生产活性蛋白饲料的研究[J].中国粮油学报,2010(4):85-88.
[3]Murakami M,Yokoyama S Y,Ogi T,et al.Direct liquefaction of activated sludge from aerobic treatment of effluents from the cornstarch industry[J].Biomass,1990,23(3):215-228.
[4]高凯,李云,杨秀山.影响丙酮丁醇发酵的主要因素及解决方案的研究进展[J].生物质化学工程,2011,45(2):45-50.
[5]环境保护部,国家质量监督检验检疫总局.GB/T 25461—2010 淀粉工业水污染物排放标准[S].北京:中国环境科学出版社出版,2008.
[6]中华人民共和国卫生部.GB/T 5009.10—2003 植物类食品中粗纤维的测定[S].北京:中国标准出版社,2003.
[7]谭秀花.丁醇高产菌的选育及小麦淀粉废水与木薯发酵生产丁醇的研究[D].无锡:江南大学,2011.
[8]El-Hadi D,Zheng Z M,Dong C Q.Aerobic production of butanol with Bacillus amyloliquefaciens NELB-12[J].Appl Mech Mat,2014,473:105-110.
[9]胡翠英,堵益平,杨影,等.生物柴油耦联丙酮丁醇发酵的初步研究[J].生物加工过程,2007,5(1):27-32.
[10]郑钧屏,李志刚,李鑫,等.酵母浸粉刺激以木薯为原料的丁醇生产的发酵相转型[J].中国生物工程杂志,2011,31(12):72-78.
[11]周灿灿.丙酮丁醇梭菌的选育及高强度丁醇发酵的研究[D].无锡:江南大学,2012.
[12]宋钢,郑璞,倪晔,等.木薯发酵产丁醇的研究[J].生物加工过程,2012,10(2):6-10.
[13]Thang V H,Kanda K,Kobayashi G.Production of acetonebutanol-ethanol(ABE) in direct fermentation of cassava by Clostridium saccharoperbutylacetonicum N1-4[J].Appl Biochem Biotechnol,2010,161:157-170.
[14]Grady M C,Hallam J W,Jahic M,et al.Method for producing butanol using extractive fermentation:US,12758870[P].2010-04-13.
[15]Lépiz-Aguilar L,Rodríguez-Rodríguez C E,Arias M L,et al. Butanol production by Clostridium beijerinckii BA101 using cassava flour as fermentation substrate:enzymatic versus chemical pretreatments[J].World J Microbiol Biotechnol,2011,27(8):1933-1939.
[16]Roffler S R,Blanch H W,Wilke C R.In-situ-recovery of butanol during fermentation[J].Bioproc Eng,1987(2):1-12.
(责任编辑 管 珺)
Butanol fermentation with wheat starch wastewater
PAN Hepeng,LUO Wei,GU Qiuya,YU Xiaobin
(Key Laboratory of Industrial Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
In order to reduce the production cost of butanol fermentation,low concentration of wheat starch wastewater was used to produce butanol,acetone and ethanol with Clostridium acetobutylicum.Medium was optimized according to the composition of starch wastewater.Effects of cassava concentration、nitrogen source and concentration,inorganic salt and the method of raw material pretreatment were investigated. Addition of 70g/L cassava,2g/L yeast extract powder and 1g/L K2HPO4to low concentration wastewater gave better performance,the yields of butanol and total solvent in flask were able to arrive at 14.72 and 22.65g/L,respectively.Meanwhile,the yields of butanol and total solvent in a 7-L fermentor could achieved 13.51 and 23.13g/L.Through extractive fermentation,the yields of butanol and total solvent reached 15.13 and 29.38g/L,respectively.
wheat starch;wastewater;butanol;extractive fermentation
Q939.97
A
1672-3678(2015)03-0007-07
10.3969/j.issn.1672-3678.2015.03.002
2014-02-21
国家自然科学基金(21176105)
潘贺鹏(1988—),男,河南驻马店人,硕士研究生,研究方向:发酵工学;余晓斌(联系人),教授,E-mail:xbyu@jiangnan.edu.cn

