光滑球拟酵母线粒体抵御乙偶姻胁迫的生理机制解析
李树波,刘立明,2,陈 坚,2
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
光滑球拟酵母线粒体抵御乙偶姻胁迫的生理机制解析
李树波1,刘立明1,2,陈 坚1,2
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
以光滑球拟酵母为出发菌株,利用生化和分子生物学实验研究微生物抵御有机溶剂胁迫的生理机制。首先,添加柠檬酸盐考察能量供给对细胞抵御乙偶姻胁迫的影响。与对照条件(0mmol/L柠檬酸盐)相比,50mmol/L柠檬酸盐可使细胞生物量在不同乙偶姻质量浓度(6、10、12和15g/L)胁迫下分别提高了13.2%、14.2%、17.8%和25.2%。同时,通过表达线粒体融合分裂调控基因fzo1和dnm1,以细胞活力、胞内活性氧(ROS)和三磷酸腺苷(ATP)为研究指标考察调控线粒体融合分裂对乙偶姻胁迫的影响。结果表明:与对照菌株相比,在不同乙偶姻质量浓度胁迫下(12和18g/L),增强线粒体融合可抑制胞内ROS的产生,使其水平分别降低了9.3%和16.2%;却使胞内ATP水平分别提高了9.7%和36.1%,从而延缓乙偶姻胁迫对细胞活力的影响,使细胞生物量相应地提高了9.1%和29.7%。因此,通过添加柠檬酸或改善线粒体生理功能以提高胞内能量供给,可有效提高微生物细胞抵御乙偶姻等环境胁迫的能力。
乙偶姻;活性氧;光滑球拟酵母;能力代谢;线粒体融合分裂
乙偶姻是一种羟基酮型有机溶剂,高浓度乙偶姻通过影响微生物细胞结构来改变细胞生理功能和代谢能力[1]。目前,研究人员主要从生理功能、细胞结构和生化组分等方面解析微生物抵御有机溶剂胁迫的生理机制:①通过改变细胞膜中不饱和脂肪酸的顺-反异构化、脂肪酸饱和度及磷脂极性头部等结构特性,增强细胞膜的坚固性并降低细胞膜的流动性,从而增强微生物对有机溶剂的适应性[2-3];②通过改变细胞壁组分构成比例,增强对外界环境胁迫的抵抗能力[4];③外排泵,可将胞内与细胞结构和生理功能不相关物质转运至胞外,以维持细胞正常生理功能[5],如ATP结合盒超家族(ABC)外排泵、主要易化子超家族(MFS)、多重抗药性家族(SMR)、多药物和毒性化合物运输蛋白(MATE)以及耐药结节细胞分化(RND)家族[6-8];④热激蛋白等调控蛋白及其相应调控系统,调控蛋白质合成、转运、折叠及降解等生理过程,提高微生物抵御外界环境(低酸、缺氧、高温、饥饿和高盐等)胁迫的能力[9-10]。此外,微生物还存在其他耐受机制,包括脱毒降解效应[11-13]、能量代谢[11]以及合成海藻糖、甘油及氨基酸等相容性溶质[14]。
然而,外排泵、细胞壁、细胞膜及脱毒反应等保护机制的形成均是高耗能过程,且与胞内能量代谢密切相关。而对于真核微生物,线粒体不仅是ATP主要合成场所,为细胞生理代谢活动提供能量和动力[15],还参与维持胞内Ca2+、Fe3+稳定,物质代谢及细胞凋亡等生理过程,在细胞抵御各种复杂环境胁迫中发挥着重要作用[16]。同时,作为不断融合分裂的高度动态细胞器,高度动态线粒体比静态线粒体更有利于实现微生物的生理功能。在酵母细胞中,动力蛋白相关GTP酶(Dnm1,the dynamin-related GTPase)和线粒体机动蛋白GTPase(Fzo1)调控着线粒体融合分裂过程,影响线粒体生理功能和形态[17-18]。其中,正常线粒体分裂过程可修复细胞氧化损伤,提高细胞对外界或内部环境胁迫的能力[19];而增强线粒体融合过程能促进线粒体间相互协同作用,有利于增强线粒体能量传递、信息沟通、DNA互补、膜电位传递及代谢物交换等生理过程[20-22]。因此,线粒体融合分裂过程在微生物细胞抵御外界环境胁迫中扮演着重要作用。目前,基于细胞凋亡角度研究有机溶剂对微生物细胞毒害作用的相关研究鲜见报道[23]。
因此,笔者将从线粒体融合分裂过程角度研究微生物细胞抵御有机溶剂胁迫的耐受机制,拓宽对微生物抵御有机溶剂胁迫生理机制的认识理解,为提高微生物抵御有机溶剂胁迫的能力提供新策略。
1 材料与方法
1.1 菌株和质粒
本研究中所用菌株和质粒见表1。

表1 本研究中所使用的菌株和质粒Table 1 Strains and plasmids used in this study
1.2 培养基和缓冲液的配制
种子培养基(g/L):葡萄糖20,(NH4)2SO45,KH2PO45,MgSO40.8,乙酸钠6。
发酵培养基(1 L):葡萄糖100g,尿素7g,KH2PO45g,MgSO40.8g,CaCO320g,乙酸钠6g,微量元素液10mL。用于研究不同乙偶姻浓度对光滑球拟酵母生长的影响。
以上培养基中加维生素液10mL,调pH 5.5后115℃高压灭菌15min。
磷酸盐缓冲液(PBS,pH 7.4,g/L):NaCl 8.0,KCl 0.2,KH2PO40.2,Na2HPO4·12H2O 2.9。
1.3 分析方法
1.3.1 细胞培养
挑取一环菌体接种于含有25mL种子培养基的250mL锥形瓶中,于30℃、200r/min下摇瓶培养24 h,以体积分数10%接种量接种于50mL含不同乙偶姻浓度发酵培养基的500mL锥形瓶中,30℃、200r/min培养。
1.3.2 细胞生理特性的测定
当细胞培养至对数生长初期(24 h),添加不同质量浓度乙偶姻(0、6、12、15和18g/L)至发酵培养基中;30℃、200r/min培养36 h,分别取2mL发酵液用于测定不同乙偶姻浓度对光滑球拟酵母细胞生理特性的影响:①利用噻唑蓝(MTT)法检测不同乙偶姻胁迫条件下细胞活力的变化;②2,7-二氯双乙酸钠(DCFH-DA)在微生物胞内通过酯化水解和氧化作用,可形成具有荧光特性的荧光物质2,7-二氯DCF,通过测定胞内DCF荧光强度计算胞内活性氧(ROS)水平;③利用试剂盒测定胞内ATP;③线粒体膜电位(ΔΨm)测定,罗丹明 123(rhodamine 123)能透过细胞膜作为线粒体跨膜电位指示剂,通过荧光信号强弱检测线粒体膜电位和细胞凋亡情况的变化[24]。
1.4 工程菌株的构建
根据S.cerevisiae中基因fzo1和dnm1序列,分别设计PCR引物Con-fzo-F/R和Con-dnm-F/R。下划线序列分别为限制性内切酶Bam HⅠ和XhoⅠ的识别位点(表2)。PCR反应采用50 μL体系,反应条件:94℃ 5min;94℃50 s,60℃ 50 s,72℃90 s,30个循环;72℃ 10min。利用质量分数0.8%琼脂糖凝胶电泳回收PCR扩增产物,并使用相应的限制性内切酶消化3 h,再利用T4 DNA连接酶将目的片段连接至质粒pYX212;借助氨苄青霉素抗性和双酶切方法筛选获得阳性重组质粒pYX212-fzo1和pYX212-dnm1。最后,将对照质粒pYX212及重组质粒电转化至C.glabrata Δura3感受态中,并利用尿嘧啶缺陷型回复突变筛选获得相应重组菌株CON,C-Fzo1p和C-Dnm1p。
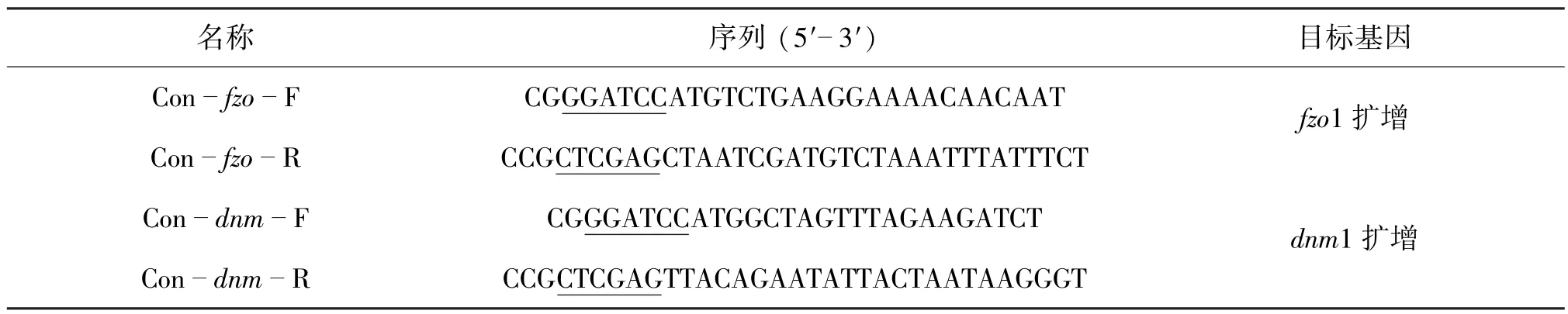
表2 本研究中所用引物Table 2 Primers used for PCR amplication in this study
2 结果与讨论
2.1 乙偶姻浓度对光滑球拟酵母生长的影响
为研究有机溶剂乙偶姻对C.glabrata细胞的毒害抑制作用,利用摇瓶培养,考察不同乙偶姻浓度对酵母细胞生长的影响,结果如图1所示。由图1可知:低浓度乙偶姻胁迫对细胞毒害和正常生理功能影响较小。与对照组(0g/L)相比,低乙偶姻质量浓度(6g/L)对细胞生长影响较小,其生物量仅降低了7.5%;但当乙偶姻质量浓度提高至12g/L时,可有效地抑制细胞的生长,使其生物量降低了26.3%,仅为8.11g/L。
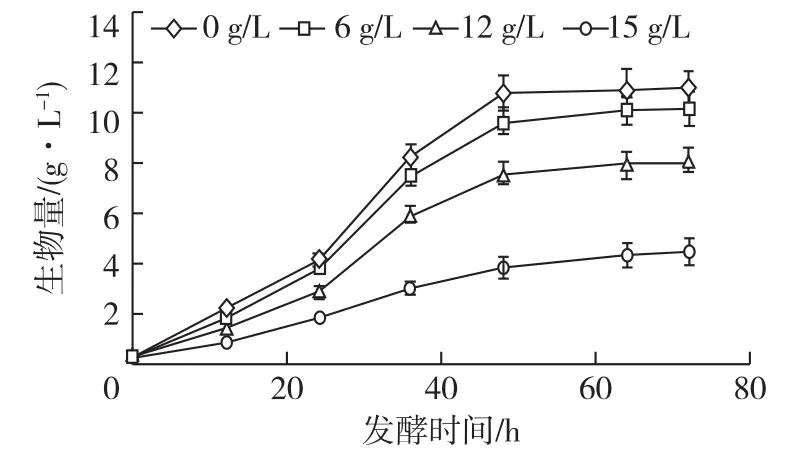
图1 摇瓶培养测定不同乙偶姻质量浓度对细胞生长的影响Fig.1 Effects of acetoin concentrations on cell growth(DCW)in liquid culture
2.2 柠檬酸对C.glabrata抵御乙偶姻胁迫的影响
柠檬酸可提高C.glabrata胞内ATP供给,从而提高细胞抵御外界酸胁迫的能力[25]。因此,考察柠檬酸盐(50mmol/L)对C.glabrata细胞抵御乙偶姻胁迫的影响,结果如图2所示。由图2可知:与对照条件(0mmol/L柠檬酸盐)相比,添加柠檬酸使细胞生物量分别提高了13.2%(6g/L乙偶姻)、14.2%(10g/L乙偶姻)、17.8%(12g/L乙偶姻)和25.2%(15g/L乙偶姻)。然而,当乙偶姻质量浓度增加至18g/L时,柠檬酸盐对细胞生长保护作用基本消失,使细胞生物量比对照组仅提高了4.2%。因此,提高胞内ATP水平能有效提高细胞抵御高浓度乙偶姻胁迫的能力。但当外界环境胁迫超过一定阈值时,仅依赖能量代谢难以保护细胞抵御高浓度乙偶姻的胁迫。
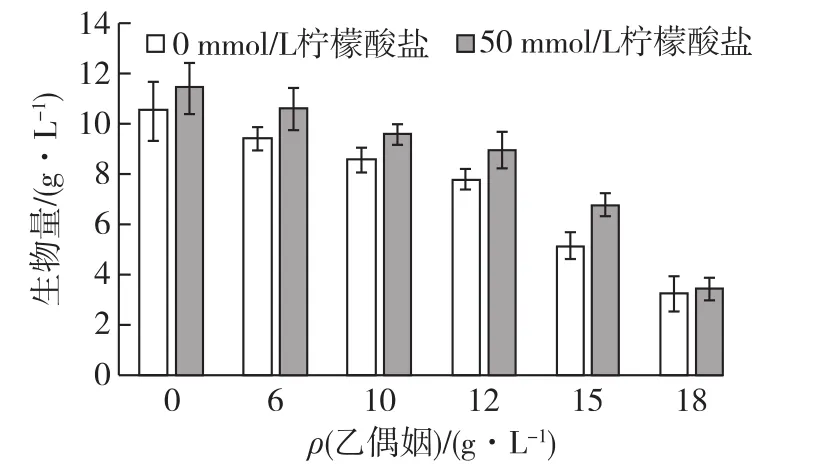
图2 柠檬酸盐对细胞抵御乙偶姻胁迫的影响Fig.2 Effects of citrate on cell growth under different acetoin concentrations
2.3 过量表达fzo1和dnm1对C.glabrata抵御乙偶姻胁迫的影响
为研究线粒体融合分裂过程对细胞抵御乙偶姻胁迫的影响,利用平板点样法和摇瓶培养,分别考察不同乙偶姻浓度对不同菌株生长的影响,结果如图3所示。由图3(a)可知:30℃培养72 h后,在低质量浓度乙偶姻胁迫下(6和12g/L),不同菌株细胞生长情况相似;在15g/L乙偶姻条件下,不同菌株生长呈显著差异,工程菌株C-Fzo1能正常生长,但菌株C-Dnm1和CON生长却受到显著的抑制作用;当乙偶姻质量浓度增加至18或20g/L时,菌株CON和C-Dnm1的生长被完全抑制,而菌株C-Fzo1仍能正常生长,表现出良好的乙偶姻耐受性。这一结果表明,过量表达基因fzo1可显著提高C.glabrata抵御乙偶姻胁迫的能力。图3(b)证明:在对照条件(0g/L乙偶姻)下,菌株CON、C-Dnm1和C-Fzo1细胞生长情况差异较小,分别为10.16、10.01和10.25g/L。当乙偶姻质量浓度增加至12和18g/L时,与对照菌株CON细胞生物量(7.71和3.23g/L)相比,菌株C-Fzo1的细胞生物量分别为8.41g/L和4.19g/L,分别提高了9.1%和29.7%;而菌株C-Dnm1的细胞生物量却分别降低至6.59和3.01g/L。这一结果再次证明:增强线粒体融合过程更有利于 C.glabrata抵御高浓度乙偶姻的胁迫。

图3 乙偶姻浓度对不同菌株生长的影响Fig.3 Effects of acetoin concentration on cell growth in different engineered strains
2.4 过量表达fzo1和dnm1对C.glabrata生理特性的影响
2.4.1 乙偶姻浓度对不同菌株细胞活力的影响
采用MTT法,以吸光度表征乙偶姻对细胞活力的影响,结果如图4所示。由图4可知:随着乙偶姻浓度的增加,菌株CON、C-Dnm1和C-Fzo1细胞活力均逐渐降低,但其下降比例差异较大。与对照条件(0g/L)相比,15g/L乙偶姻使对照菌株CON细胞活力降低了43.4%;而菌株C-Dnm1细胞活力降低比例最大,为45.7%;然而,菌株C-Fzo1细胞活力仅降低了31.3%。同时,当乙偶姻质量浓度提高至18g/L或20g/L时,菌株C-Fzo1细胞活力进一步降低(比对照条件分别减少了 44.5%和47.6%),而菌株CON和C-Dnm1细胞活力并没有持续减少,但却维持在较低水平(约为0.3)。因此,C.glabrata对乙偶姻胁迫的最高耐受质量浓度可能为15g/L,而过量表达基因fzo1能有效延缓或削弱高浓度乙偶姻对细胞活力的影响,提高细胞抵御乙偶姻胁迫的能力。

图4 乙偶姻质量浓度对不同菌株细胞活力的影响Fig.4 Effects of acetoin concentration on the cell proliferation in different strains by MTT analysis
2.4.2 乙偶姻浓度对不同菌株胞内ROS、ATP水平的影响
研究乙偶姻对不同菌株胞内ROS和ATP水平变化的影响,为进一步解析乙偶姻对细胞的毒害机制提供实验支持,结果如图5所示。与对照条件(0g/L乙偶姻)相比,12g/L和18g/L乙偶姻使菌株CON胞内ROS水平分别提高了17%和44%。但与对照菌株CON相比,菌株C-Dnm1胞内ROS水平却分别提高了10.2%(12g/L)和13.4%(18g/L);菌株C-Fzo1能有效消除抑制胞内ROS的产生,使胞内ROS水平分别降低了9.3%(12g/L)和16.2%(18g/L)。同时,通过对不同菌株胞内ATP水平的测定分析发现:与对照菌株CON相比,高浓度乙偶姻胁迫使菌株C-Dnm1胞内ATP水平分别降低了13.2%(12g/L)和20%(18g/L);而菌株C-Fzo1胞内ATP水平却分别提高了9.7%(12g/L)和36.1%(18g/L)。
综上所述,高浓度乙偶姻可改变胞内ROS和ATP水平,而胞内低水平ATP可导致胞内各代谢反应供能不足,从而影响细胞正常的生理活动,促进胞内ROS水平的提高,可能是降低C.glabrata抵御乙偶姻胁迫能力的关键因素。然而,增强线粒体融合过程可提高胞内ATP的合成能力,延缓胞内ROS的产生,从而维持线粒体膜电位的稳定,为细胞正常生理活动提供更多能量供给和适宜的胞内微环境,提高细胞应对高浓度乙偶姻胁迫的能力。
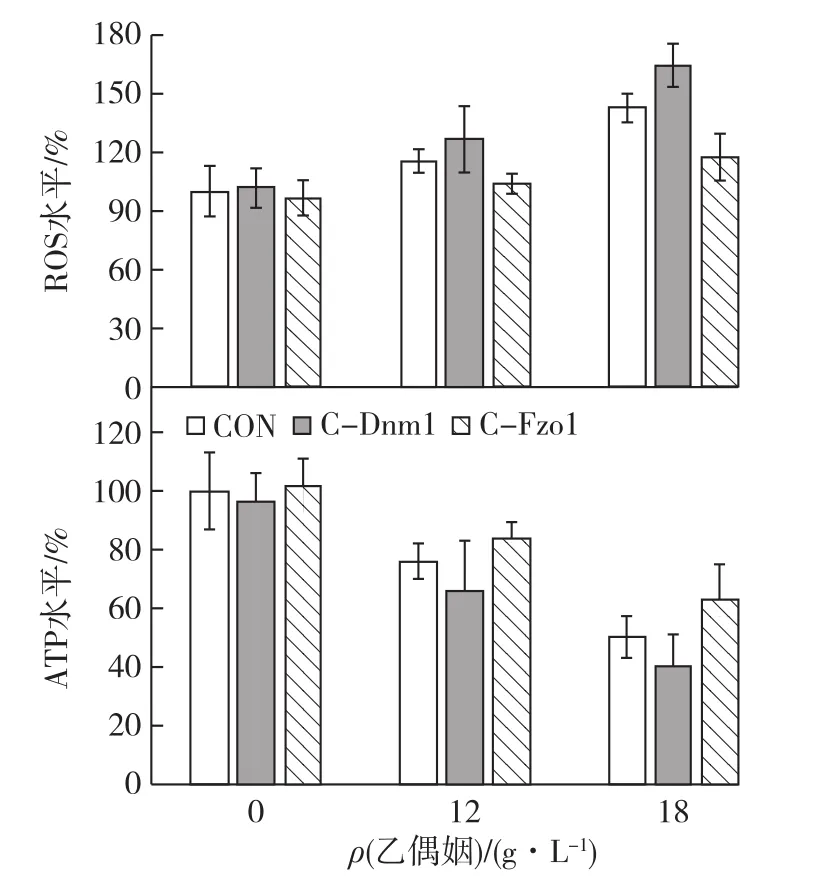
图5 乙偶姻浓度对不同菌株生理特性的影响Fig.5 Effects of acetoin concentrations on the levels of cellular ROS and ATP production in different strains
3 结论
以有机溶剂乙偶姻为例研究微生物抵御有机溶剂胁迫的生理机制,并为提高微生物抵御有机溶剂胁迫能力提供新的方法策略。通过外源添加柠檬酸盐实验发现,增加微生物胞内ATP供给可更有利于提高微生物细胞抵御高浓度乙偶姻胁迫的能力。而作为酵母细胞中重要的亚细胞器,线粒体可参与能力代谢、细胞凋亡等多种生理功能。通过过量表达线粒体融合分裂关键调节基因,调控线粒体的融合分裂过程,改变微生物细胞抵御外界环境胁迫的能力。研究结果表明,与对照菌株CON相比,增强线粒体融合过程可有效延缓高浓度乙偶姻胁迫对细胞活力的影响;抑制胞内ROS的产生,使胞内ROS水平分别降低了9.3%(12g/L)和16.2%(18g/L),但却使胞内ATP水平分别提高了9.7%(12g/L)和36.1%(18g/L),有效提高了光滑球拟酵母抵御高浓度乙偶姻胁迫的能力。因此,从线粒体角度解析微生物抵御有机溶剂胁迫的生理机制,不仅拓宽对有机溶剂耐受机制的认识和理解,也为增强微生物细胞抵御外界环境胁迫提供新的策略。
[1]Hun C J,Rahman R N Z A,Salleh A B,et al.A newly isolated organic solventtolerantBacillussphaericus205y producing organic solvent-stable lipase[J].Biocheml Eng J,2003,15(2)(2):147-151.
[2]Sardessai Y,Bhosle S.Tolerance of bacteria to organic solvents[J].Res Microbiol,2002,153(5):263-268.
[3]Borden J R,Papoutsakis E T.Dynamics of genomic-library enrichment and identification of solvent tolerance genes for Clostridium acetobutylicum[J].Appl Environ Microbiol,2007,73(9):3061-3068.
[4]Zhao X,Bai F.Mechanisms of yeast stress tolerance and its manipulation forefficientfuelethanolproduction[J].J Biotechnol,2009,144(1):23-30.
[5]Nicolaou S A,Gaida S M,Papoutsakis E T.A comparative view of metabolite and substrate stressand tolerance in microbial bioprocessing:from biofuels and chemicals,to biocatalysis and bioremediation[J].Metab Eng,2010,12(4):307-331.
[6]Higgins C F.Multiple molecular mechanisms for multidrug resistance transporters[J].Nature,2007,446:749-757.
[7]Krulwich T A,Lewinson O,Padan E,et al.Do physiological roles foster persistence of drug/multidrug-efflux transporters:a case study[J].Nat Rev Microbiol,2005,3(7):566-572.
[8]Ramos J L,Duque E,Gallegos M T,et al.Mechanisms of solvent tolerance in gram-negative bacteria[J].Annu Rev Microbiol,2002,56:743-768.
[9]Alexandre H,Ansanay-Galeote V,Dequin S,et al.Global gene expression during short-term ethanol stress in Saccharomyces cerevisiae[J].FEBS Lett,2001,498(1):98-103.
[10]Alsaker K V,Paredes C,Papoutsakis E T.Metabolite stress and tolerance in the production of biofuels and chemicals:geneexpression-based systems analysis of butanol,butyrate,and acetate stresses in the anaerobe Clostridium acetobutylicum[J].Biotechnol Bioeng,2010,105(6):1131-1147.
[11]Devantier R,Scheithauer B,Villas-Boas S G,et al.Metabolite profiling for analysis of yeast stress response during very high gravity ethanol fermentations[J].Biotechnol Bioeng,2005,90(6):703-714.
[12]Papoutsakis E T.Engineering solventogenic clostridia[J].Curr Opin Biotech,2008,19(5):420-429.
[13]Mao S M,Luo Y A M,Zhang T R,et al.Proteome reference map and comparative proteomic analysis between a wild type Clostridium acetobutylicum DSM 1731 and its mutant with enhanced butanol tolerance and butanol yield[J].J Proteome Res,2010,9(6):3046-3061.
[14]Xu S,Zhou J W,Liu L M,et al.Proline enhances Torulopsis glabrata growth during hyperosmotic stress[J].Biotechnol Bioproc E,2010,15(2):285-292.
[15]Zhou J W,Liu L M,Shi Z P,et al.ATP in current biotechnology:regulation,applications and perspectives[J].Biotechnol Adv,2009,27(1):94-101.
[16]Salahudeen A K,Huang H,Joshi M,et al.Involvement of the mitochondrial pathway in cold storage and rewarming-associated apoptosis of human renal proximal tubular cells[J].Am J Transplant,2003,3(3):273-280.
[17]Bleazard W,McCaffery J M,King E J,et al.The dynamin-related GTPase Dnm1 regulates mitochondrial fission in yeast[J].Nat Cell Biol,1999,1(5):298-304.
[18]Fekkes P,Shepard K A,Yaffe M P.Gag3p,an outer membrane protein required for fission of mitochondrial tubules[J].J Cell Biol,2000,151(2):333-340.
[19]Bossy-Wetzel E,Barsoum M J,Godzik A,et al.Mitochondrial fission in apoptosis,neurodegeneration and aging[J].Curr Opin Cell Biol,2003,15(6):706-716.
[20]Ono T,Isobe K,Nakada K,et al.Human cells are protected from mitochondrial dysfunction by complementation of DNA products in fused mitochondria[J].Nat Genet,2001,28(3):272-275.
[21]Skulachev V P.Mitochondrial filaments and clusters as intracellular power-transmitting cables[J].Trends Biochem Sci,2001,26(1):23-29.
[22]Amati-Bonneau P,Valentino M L,Reynier P,et al.OPA1 mutations induce mitochondrial DNA instability and optic atrophy plus phenotypes[J].Brain,2008,131:338-351.
[23]Kitagaki H,Araki Y,Funato K,et al.Ethanol-induced death in yeast exhibits features of apoptosis mediated by mitochondrial fission pathway[J].FEBS Lett,2007,581(16):2935-2942.
[24]Guo X M,Wu J J,Du J J,et al.Platelets of type 2 diabetic patients are characterized by high ATP contentand low mitochondrial membrane potential[J].Platelets,2009,20(8):588-593.
[25]Zhou J W,Liu L M,Chen J.Improved ATP supply enhances acid tolerance of Candida glabrata during pyruvic acid production[J]. J Appl Microbiol,2011,110(1):44-53.
(责任编辑 管 珺)
Physiological mechanism of mitochondrion against acetoin stress in Candida glabrata
LI Shubo1,LIU Liming1,2,CHEN Jian1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.The Key Laboratory of Industrial Biotechnology of the Ministry of Education,Jiangnan University,Wuxi 214122,China)
To elucidate the tolerant mechanism of Candida glabrata against acetoin stress,we studied its physiological and biochemical characteristics through two strategies.First,50mmol/L of citrate was added to increase intercellular energy production under different concentrations of acetoin(6,10,12 and 15g/L),and cell growth increased by 13.2%,14.2%,17.8%and 25.2%,respectively,compared to the control condition(without addition of citrate).Furthermore,the genes of fzo1 and dnm1 were also over-expressed to regulate mitochondrial function,and some important parameters(the intracellular reactive oxygen species(ROS)and adenosine triphosphate(ATP))were analyzed.Compared to the control strain,improving mitochondrial fusion (over-expressing fzo1) could effectively decrease intercellular ROS production with 9.3%and 16.2%,respectively,under 12g/L and 18g/L of acetoin. Moreover,it could significantly increase intracellular ATP generation with 9.7%and 36.1%,and DCW 9.1%and 29.7%,respectively.Based on the above results,increasing intercellular energy levelsthrough adding some citrate and improving mitochondrial fusion function was favorable to enhance the cellular robustness for acetoin stress.
acetoin;reactive oxygen species;Candida glabrata;energy metabolic;mitochondrial fusion-fission
TQ224.22
A
1672-3678(2015)03-0001-06
10.3969/j.issn.1672-3678.2015.03.001
2014-04-18
国家自然科学基金重点项目(20836003);全国优秀博士学位论文作者专项基金(200962)
李树波(1985—),男,广西桂林人,博士,研究方向:微生物食品制造;陈 坚(联系人),教授,E-mail:jchen@jiangnan.edu.cn

