米根霉交替呼吸途径高活性突变株的选育及其对富马酸合成的影响
孙小龙,付永前,徐 晴,李 霜,黄 和
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 210009)
米根霉交替呼吸途径高活性突变株的选育及其对富马酸合成的影响
孙小龙,付永前,徐 晴,李 霜,黄 和
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 210009)
米根霉交替呼吸强度与富马酸合成之间存在重要关联。以米根霉F-14为出发菌株,通过常压室温等离子体(ARTP)离子诱变技术,筛选出1株交替呼吸强度增强的突变菌株S-1。该菌株的交替呼吸初始强度是出发菌株F-14的3.5倍,然而,该菌株富马酸积累量(28g/L)却远低于出发菌株(42g/L)。进一步考察突变株S-1和出发株F-14菌株在发酵过程中交替呼吸及富马酸生产强度,总呼吸变化和还原力NADH/NAD+的变化。结果表明:突变株在富马酸发酵初始阶段,过高的交替呼吸强度反而降低了富马酸的生产速率,并导致了发酵后期菌体的早衰现象。交替呼吸强度与发酵进程存在适配性,只有当适配性达到最佳状态时,才有利于产物的高效积累。
米根霉;富马酸;交替呼吸;生产强度
富马酸作为初级代谢产物,在微生物发酵过程中与能量代谢密切相关。丝状真菌米根霉(Rhizopus oryzae)是富马酸发酵研究的主要菌株[1]。现有研究发现,丝状真菌体系中除了电子传递呼吸链外,还存在2个额外的还原型辅酶(NADH)脱氢酶和2个黄素还原酶,它们可以不经过呼吸链而直接把电子传给氧,促成胞内三磷酸腺苷(ATP)水平低,从而保证了糖酵解途径(EMP)的畅通,这个过程称为交替呼吸途径[2-5]。交替呼吸起到了能量溢流的作用[2],平衡碳代谢和电子传递的关系,将ATP合成与三羧酸循环(TCA)独立开来,使得TCA继续进行,促进了碳骨架的流通,有利于代谢产物的生成[6-7]。在真菌发酵体系中,如柠檬酸、头孢菌素等发酵过程中,均发现了交替呼吸途径与产物积累具有重要关联[8-9];王庆昭等[10]通过筛选高强度交替呼吸活性黑曲霉菌株(水杨氧肟酸(SHAM)敏感型菌株),获得了高产柠檬酸突变株。
笔者所在课题组的Gu等[11]在米根霉的富马酸发酵过程中也发现了交替呼吸途径的存在,并对该途径的呼吸活性与富马酸积累的相关性以及关键酶——交替氧化酶及其调控方式进行了研究。然而,交替呼吸强度如何影响米根霉合成富马酸的研究鲜有文献报道。笔者通过交替呼吸抑制剂水杨氧肟酸(SHAM)筛选高交替呼吸强度的突变株,并考察其对富马酸合成的影响。
1 材料与方法
1.1 菌株
出发菌株米根霉Rhizopus oryzae F-14为保藏于笔者所在实验室的富马酸高产菌株。
1.2 培养基
菌种保藏培养基(培养基A)为PDA斜面培养基(1 L):马铃薯200g、葡萄糖20g、琼脂20g;
筛选培养基(培养基B):PDA培养基中添加SHAM 0.6g/L;
孢子萌发培养基(1 L):蛋白胨2g、CaCl22.5g、葡萄糖60g;
发酵培养基(1 L):葡萄糖80g、尿素0.1g、MgSO4·7H2O 0.6g、ZnSO4·7H2O 0.018g、KH2PO40.5g、FeSO4·7H2O 0.001g、CaCO350g。
1.3 培养条件
米根霉于斜面培养基培养5~6 d,孢子成熟后,制备成孢子悬浮液(107个/mL)。取孢子悬液1mL接种至装有50mL种子培养基的250mL三角瓶中,200r/min、35℃培养12 h后,按10%接种量(体积分数),接入发酵培养基(250mL三角瓶装50mL)产酸,200r/min、35℃培养12 h。
1.4 葡萄糖、富马酸和呼吸强度测定
葡萄糖和富马酸的测定参照文献[12];呼吸强度分析采用液相氧电极法[13]。
1.5 米根霉胞内NADH和NAD+测定
NADH和氧化型辅酶(NAD+)的测定方法参照文献[14]。
2 结果与讨论
2.1 米根霉交替呼吸突变株的选育
2.1.1 SHAM浓度的确定
将原始菌株孢子液涂布在添加不同浓度SHAM的PDA培养基上观察其萌发情况,结果如表1所示。由表1可知:随着SHAM浓度的增加,米根霉孢子萌发数量显著减少,菌丝形态由粗壮发达变为纤细短小。当SHAM质量浓度为0.8g/L时,孢子萌发数目明显减少,说明此时药物浓度已经对菌株生长造成明显的影响,而0.6g/L之前的药物浓度对菌株生长及萌发未造成显著影响。因此,选取0.6g/L的SHAM作为筛选剂量,交替呼吸增强菌株在此浓度下不萌发,而原始菌株可以正常萌发。

表1 SHAM浓度对米根霉孢子萌发的影响Table 1 Effects of SHAM titers on spore germination
2.1.2 交替呼吸增强菌株的选育
取新鲜米根霉菌株F-14斜面,适量生理盐水洗下孢子并调整成密度约105个/mL孢子液,取10 μL孢子液涂布于直径8 mm小铁片上,无菌条件下自然晾干。常压室温等离子体(ARTP)离子机室温诱变,气流量(QHe)=10.0 L/min,照射距离2 mm,电功率100 W,以时间控制辐射剂量。无菌水洗涤照射以后的铁片,并稀释至合适浓度,取200 μL稀释液涂布于培养基B,35℃恒温培养12 h,用打孔器将已萌发菌落挑走舍弃,平板继续放置35℃恒温箱培养至18 h,挑出生长延迟的菌落,即为疑似交替呼吸突变株初筛菌,将其移至培养基A,35℃恒温培养至孢子成熟,准备进一步验证。
从筛选平板上初筛出60株菌株,收集孢子,调整至密度约107个/mL的孢子悬液,取1mL孢子悬液接种于种子培养基内,35℃、200r/min摇瓶培养12 h后,取样测定菌体的基础交替呼吸强度,从中筛选出10株交替呼吸强度相对较高的菌株,进一步开展富马酸发酵,结果见表2。由表2可知:10株SHAM敏感型菌株的基础交替呼吸强度比出发株提升1倍以上,达到了总呼吸强度的32%~52%;而富马酸的产量反而有所下降,并未达到通过增加交替呼吸强度来提高富马酸产量的预想。菌株S-1的基础交替呼吸强度达到了总呼吸的52%,是出发菌株的3.5倍,而富马酸产量却下降了36%。

表2 诱变菌株初始交替呼吸强度和富马酸产量Table 2 The alternative respiration ratio and fumaric acid production of mutants
2.2 突变株S-1与原始菌株F-14的富马酸发酵进程
考察米根霉交替呼吸突变株S-1与原始菌株F-14的富马酸合成过程中糖耗和富马酸生成情况,结果见图1。由图1可知:在发酵前期,S-1糖耗与F-14相比相对较快;当发酵进入到24 h以后,糖耗开始减慢,并逐渐低于F-14;发酵结束后,S-1富马酸的产量为28g/L,远远低于F-14富马酸的产量(42g/L),发酵液中残糖高达18g/L。
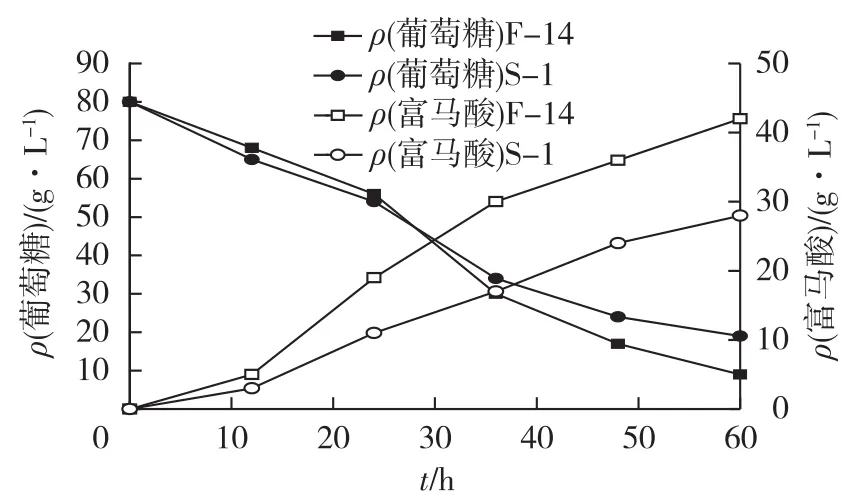
图1 S-1与F-14的糖耗与产酸曲线Fig.1 Glucose consumption and fumaric acid production of S-1 and F-14
2.3 交替呼吸强度与富马酸生产强度的关联性
考察菌株S-1和F-14发酵过程中的交替呼吸强度与富马酸生产强度之间的关系,结果见图2。由图2可知:在产酸发酵前期(0~24 h),交替呼吸强度与富马酸生产速率在表观上具有一致性,当交替呼吸强度达到最大时(发酵24 h),生产速率也达到最大值,这与Xu等[12]之前得到的结论基本吻合。S-1菌株在发酵前期的交替呼吸强度明显高于原始菌,这也验证了在发酵前期突变株S-1糖耗快于出发株F-14(图1),但S-1菌株的富马酸生产强度却低于F-14;发酵中后期(24~60 h),S-1的交替呼吸强度迅速下降,下降幅度大于F-14,在发酵28 h左右,F-14的交替呼吸强度开始大于S-1,此时F-14富马酸生产强度始终高于S-1。突变株S-1在发酵初期通过较强的交替呼吸作用虽然能提高糖耗速率,但并不利于富马酸的高效积累,其原因可能与发酵早期细胞的能量储备及代谢调控有关;突变株在发酵中后期交替呼吸强度迅速下降来调节能量平衡,从而影响后期的糖耗及产物合成。可见,交替呼吸的调节对富马酸合成有影响,集中在发酵中后期进行调节,将更有利于富马酸的生成。

图2 交替呼吸及富马酸生产强度的关系Fig.2 Time courses of alternative respiration ratio and fumaric acid productivity of S-1 and F-14
2.4 菌株S-1与F-14总呼吸强度的比较
考察S-1和F-14这2株菌株总呼吸强度的变化情况,结果见图3。由图3可知:S-1的总呼吸强度随着发酵的进行而下降,当进入到中后期,开始迅速下降;虽然F-14也呈现下降的趋势,但是下降幅度明显小于S-1。分析原因认为,米根霉在发酵初期,标准呼吸将提供充足的能量以供应菌体生长以及酶系的调节,如果发酵前期供氧不足,在发酵后期,菌体代谢体系将调整交替呼吸与标准呼吸平衡,从而导致交替呼吸迅速下降,这也可能是糖耗以及富马酸生产强度明显慢于F-14的原因。通过比较2株菌的总呼吸情况进一步发现,S-1发酵过程中存在提前衰老现象,因而科学并合理地调节胞内能量代谢来提高菌体的产物积累速率就显得尤为重要。
2.5 胞内还原力的比较
通过胞内还原型辅酶(NADH)和氧化型辅酶(NAD+)的摩尔比值来进一步考察S-1和F-14发酵过程中胞内还原力的变化,结果见图4。由图4可知:同交替呼吸变化趋势一样,发酵前期,S-1和F-14胞内还原力逐渐上升,S-1的n(NADH)/ n(NAD+)高于F-14,而此时S-1菌株的糖耗速率也大于F-14,随着发酵的进行,S-1和F-14的胞内还原力逐渐下降,而S-1的胞内还原力开始低于F-14,而此时S-1菌株的糖耗速率也小于F-14。整个过程中存在着相似的规律,胞内还原力越高,糖耗越快。这可能是跟富马酸发酵过程的碳代谢和能量供应有关。Lambers[2]研究发现,交替呼吸链每传递2个电子只产生1分子ATP;而经典呼吸每传递2个电子可产生2.5分子ATP;当经典呼吸强度较大时,胞内ATP含量增多,ATP会对EMP途径中的关键酶——磷酸果糖激酶起到抑制作用,从而抑制EMP途径,并最终降低还原力 n(NADH)/ n(NAD+),反之,当交替呼吸强度较大时,电子通过交替呼吸链时产生较少的ATP,从而保证了EMP的畅通,所以胞内还原力n(NADH)/n(NAD+)的值较大,糖耗较快。

图3 菌株S-1与F-14总呼吸曲线Fig.3 Time courses of the total respiratory rate of S-1 and F-14
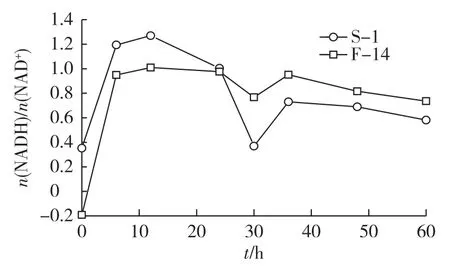
图4 菌株S-1与F-14 NADH/NAD+曲线Fig.4 Time courses of NADH/NAD+ratio of S-1 and F-14
3 结论
通过SHAM敏感型突变株的筛选,获得了1株基础交替呼吸强度大幅增加的米根霉突变菌株S-1,该菌株的基础交替呼吸强度是出发菌株F-14的3.5倍;然而,该菌株富马酸积累量(28g/L)却远低于出发菌株(42g/L)。突变株在富马酸发酵初始阶段过高的交替呼吸强度反而降低了富马酸的生产速率,并导致了发酵后期菌体的早衰现象。因此,针对富马酸发酵过程需调节菌株在不同阶段的交替呼吸强度,而非仅仅增加基础交替呼吸强度。
[1]窦畅,徐晴,宋萍,等.米根霉利用木糖与葡萄糖的代谢差异[J].微生物学报,2011,51(4):468-473.
[2]Lambers H.Cyanide-resistant respiration:a non-phosphorylating electron transport pathway acting as an energy overflow[J]. Physiologia Plantarum,1982,55(4):478-485.
[3]阎澜,李妙海,姜远英.真菌的抗氰呼吸[J].生命的化学,2009,29(4):498-502.
[4]Costa-de-Oliveira S,Sampaio-Marques B,Barbosa M,et al.An alternative respiratory pathway on Candida krusei:implications on susceptibility profile and oxidative stress[J].FEMS Yeast Res,2012,12(4):423-429.
[5]Li F,Zhang Y,Wang M,et al.Molecular cloning and expression characteristics of alternative oxidase gene of cotton(Gossypium hirsutum)[J].Mol Biol Rep,2008,35(2):97-105.
[6]Diano A,Bakker-Jensen S,Dynesen J,et al.Polyol synthesis in Aspergillus niger:influence of oxygen availability,carbon and nitrogen sources on the metabolism[J].Biotechnol Bioeng,2006,94(5):899-908.
[7]Sándor E,Fekete E,Karaffa L.Regulation of the cyanide-resistant alternative respiratory pathway in the fungus Acremonium chrysogenum[J].Food Technol Biotechnol,2003,41(1):43-47.
[8]Kirimura K,Hirowatari Y,Usami S.Alterations of respiratory systems in Aspergillus niger under the conditions of citric acid fermentation[J].Agric Biol Chem,1987,51(5):1299-1303.
[9]Karaffa L,Sándor E,Kozma J,et al.Cephalosporin-C production,morphology and alternative respiration of Acremonium chrysogenum in glucose-limited chemostat[J].Biotechnol Lett,1996,18(6):701-706.
[10]王庆昭,李剑,刘伟,等.高产柠檬酸的SHAM特性黑曲霉突变株的选育[J].食品与发酵工业,2001,27(4):25-29.
[11]Gu S,Xu Q,Huang H,et al.Alternative respiration and fumaric acid production ofRhizopusoryzae[J].ApplMicrobiol Biotechnol,2014,98(11):5145-5152.
[12]Xu Q,Li S,Fu Y,et al.Two-stage utilization of corn straw by Rhizopus oryzae for fumaric acid production[J].Bioresour Technol,2010,101(15):6262-6264.
[13]Bahr J T,Bonner W D Jr.Cyanide-insensitive respiration:I.the steady states of skunk cabbage spadix and bean hypocotyl mitochondria[J].J Biol Chem,1973,248(10):3441-3445.
[14]Prömper C,Schneider R,Weiss H.The role of the proton-pumping and alternative respiratory chain NADH: ubiquinone oxidoreductases in overflow catabolism of Aspergillus niger[J]. Eur J Biochem,1993,216:223-230.
(责任编辑 荀志金)
Screening of Rhizopus oryzae mutants with higher activity of alternative respiration for fumaric acid production
SUN Xiaolong,FU Yongqian,XU Qing,LI Shuang,HUANG He
(State Key Laboratory of Materials-Oriented Chemical Engineering,College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 210009,China)
During fumaric acid fermentation,alternative respiration is associated with fumaric acid productivity in Rhizopus oryzae.S-1 mutant with higher activity of alternative respiration was screened by atmospheric and room temperature plasma(ARTP)ion mutagenesis using Rhizopus oryzae F-14 as the original strain.The activity of alternative respiration in S-1mutant is 3.5-fold than that of F-14.However,fumaric acid production(28g/L)was much lower than that of the original strain(42g/L).The relationship between alternative respiration ratio and fumaric acid productivity,the change of total respiration activity and NADH/NAD+of S-1 and F-14 in the fermentation process were further studied.At the initial fermentation stage higher activity of alternative respiration in S-1 mutant reduced the fumaric acid productivity,and ultimately led to the premature aging phenomenon in the fermentation.It means that the activity of alternative respiration should adapt the fumaric acid productivity.
Rhizopus oryzae;fumaric acid;alternative respiration;productivity
TK6;Q819;S216·2
A
1672-3678(2015)03-0026-05
10.3969/j.issn.1672-3678.2015.03.005
2014-03-27
国家重点基础研究发展计划(973计划)(2013CB733605);国家高技术研究发展计划(863计划)重点项目(2011AA02A206);国家自然科学基金(21076104、21106065、21106091)
孙小龙(1989—),女,江苏盐城人,硕士研究生,研究方向:生物基化学品的制备;黄 和(联系人),教授,E-mail:biotech@ njtech.edu.cn

