重组毕赤酵母产植酸酶发酵条件的优化
闵兆升,郭会明,张志强,洪厚胜
(1.南京工业大学 理学院,江苏 南京 211800;2.南京工业大学 生物与制药工程学院,江苏 南京 211800)
重组毕赤酵母产植酸酶发酵条件的优化
闵兆升1,郭会明1,张志强2,洪厚胜2
(1.南京工业大学 理学院,江苏 南京 211800;2.南京工业大学 生物与制药工程学院,江苏 南京 211800)
为研究优化毕赤酵母工程菌H311产植酸酶的发酵条件,采用单因素试验和L18(37)正交试验考察不同工艺条件对产酶活性的影响。结果表明:影响重组毕赤酵母产植酸酶的因素重要性从大到小依次为诱导时间、甲醇添加量、装液量、初始诱导pH、生长时间、接种量和初始生长pH,产酶最佳条件为接种量3%(体积分数)、装液量20mL(250mL摇瓶)、生长时间20 h,诱导时间120 h、甲醇添加量1.5%(体积分数)、生长pH 6.0、诱导pH 5.0,在此条件下进行诱导表达,植酸酶的比酶活可达334 U/mL。
植酸酶;毕赤酵母;发酵;优化;酶活力
植酸酶(phytases)是指能够将植酸及其盐类催化水解,并生成磷酸与肌醇衍生物的一类酶的总称,属磷酸单脂水解酶[1-2]。植酸酶可消除单胃动物对体内植酸的抗营养作用。同时,它能够代替抗生素显著提高畜禽肠胃对蛋白质及磷等多种微量元素的利用率,具有良好的饲用增殖效果,且降低了畜禽排放物中磷的含量,从而减少对环境的污染[3-4]。因此,国内关于植酸酶的应用最为广泛的也是饲料工业,但所产植酸酶品质较为粗放。近些年,国外研究者为将其应用到食品加工行业,开始研究食品级植酸酶,用来提高食品的生理功能和营养效价[5-6]。然而,众所周知,天然来源的微生物往往具有表达量少、分离提取困难、难以实现工业化生产的需要等不足。随着基因工程与发酵技术的发展,使获得高效表达植酸酶的基因工程菌成为了可能[7-10]。笔者就1株重组毕赤酵母产植酸酶基因工程菌的产酶条件进行优化,旨在探索高密度发酵技术中可改进的工艺和设备。
1 材料与方法
1.1 菌株
基因工程酵母H311,来自云南师范大学。
1.2 主要试剂
植酸钠(P8810)(AR级),Sigma公司;其他试剂均为市售分析纯。
1.3 培养基
培养基配制主要参照 Invitrogen公司编著的Multi-Copy Pichia Expression Kit操作手册。
YPD培养基(种子培养基,g/L):葡萄糖20、蛋白胨20、酵母粉10。
BMGY培养基(增殖培养基,g/L):酵母粉10、蛋白胨20、YNB(无氨基酵母氮源)13.4、生物素4× 10-4、甘油10、1mol/L H3PO4缓冲液100;pH 6.0。
BMMY培养基(诱导培养基,1 L):酵母粉10g、蛋白胨20g、YNB 13.4g、生物素4×10-4g、1mol/L H3PO4缓冲液100g、甲醇10mL;pH 6.0。
以上培养基均在105℃低压灭菌30min,生物素与甲醇均过滤除菌,待高温灭菌后加入。
1.4 菌种活化及培养
在无菌环境条件下,将冷冻干燥管中的保藏菌种重悬于YPD液体培养基中,并将其置于装液量为15mL的250mL的摇瓶中,于30℃、220r/min培养24 h;吸取0.1mL发酵液于YPD固体培养基上,并用涂布棒均匀涂布,于30℃恒温培养箱中培养3 d;将菌体于YPD固体培养基上划线培养,挑取2次活化后的单菌落,接种于YPD液体培养基中,30℃、220r/min培养18 h,作为发酵种子液。
1.5 发酵培养及培养条件的优化
将种子液按不同的接种量转接于BMGY培养基中,30℃、220r/min培养。再转接至BMMY诱导培养基中,27℃、220r/min诱导培养。试验分别研究不同接种量、装液量、甲醇添加量、诱导培养时间对产酶的影响,并在此基础上,采用L18(37)正交表设计7因素3水平的正交试验,确定毕赤酵母植酸酶摇瓶发酵最佳诱导条件,并对此最佳条件进行验证。
1.6 植酸酶酶活测定
由于毕赤酵母植酸酶为胞外表达。因此,将诱导结束后的发酵液经4 000r/min离心5min,除去菌体,所得上清液即为发酵粗酶液。发酵液中植酸酶活性的测定采用钒钼酸铵法[11],其酶活定义:样品在37℃、pH5.50条件下,每分钟从浓度为5.0mmol/L植酸钠溶液中释放1 μmol无机磷,即为1个植酸酶酶活性单位,以U表示。
准确吸取适当稀释的酶液0.2mL,并加入1.8mL乙酸-乙酸钠缓冲液混合,于37℃的水浴锅中预热5min,吸取4.0mL 5.0mmol/L的乙酸缓冲液配制而成底物植酸钠,37℃ 水浴反应30min后,再加入4mL反应终止液(由100g/L的钼酸铵溶液、2.35g/L的偏钒酸铵溶液及硝酸溶液按体积比1∶1∶2现配现用)冷却至室温,(对照组先加反应终止液,无需预热、无需水解),在UVmini-1240型紫外-可见光分光光度计415nm处测定吸光值,根据标准曲线回归出的直线方程计算出无机磷的量,进而计算出酶活。
2 结果与讨论
2.1 诱导时间对产酶的影响
在250mL摇瓶中,装液30mL,发酵初始生长pH为6.0,发酵生长温度为30℃,菌体的接种量为6%(体积分数),初始诱导pH 5.5,甲醇添加量为1%(体积分数),诱导温度为 27℃,转速220r/min,在此条件下研究诱导时间对产植酸酶的影响。0~84 h,每隔12 h测定酶活;84~136 h,每隔8 h测定酶活,考察诱导时间对酶活的影响,结果如图1所示。由图1可知:随着诱导时间的延长,植酸酶酶活越来越高,且在92~136 h能保持较高的酶活。这是因为随着诱导时间的延长,菌体的生物量不断积累,目的蛋白表达量随之增加。但是,在108 h后,植酸酶的酶活是呈缓慢下降趋势的。这是因为到了发酵后期,菌体的大量生长需要消耗更多的O2,而由于摇瓶发酵自身的局限性,容易导致溶氧不足,导致菌体自溶,pH上升,这些都会影响菌体的生物量,进而影响诱导表达。

图1 诱导时间对产植酸酶的影响Fig.1 Effect of induction time on phytase production
2.2 接种量对产酶的影响
在250mL摇瓶中,装液30mL,发酵初始生长pH为6.0,发酵生长温度为30℃,初始诱导 pH 5.5,甲醇添加量为1%,诱导温度为27℃,转速220r/min,诱导表达96 h,考察菌体的接种量(3%、6%、9%、12%和15%)对酶活的影响,结果如图2所示。由图2可知:接种量较小时,酶活相对较高。当接种量为6%时,所产植酸酶活性最高。但当接种量增大时,酶活反而有所下降。这是因为培养基中菌体密度太大,而基因工程菌发酵属于高耗氧发酵,这就使得菌体生长所需的养分和溶氧都出现供应不足的状况,菌体生长状态不良,进而使得蛋白表达量降低,即植酸酶分泌量减少。
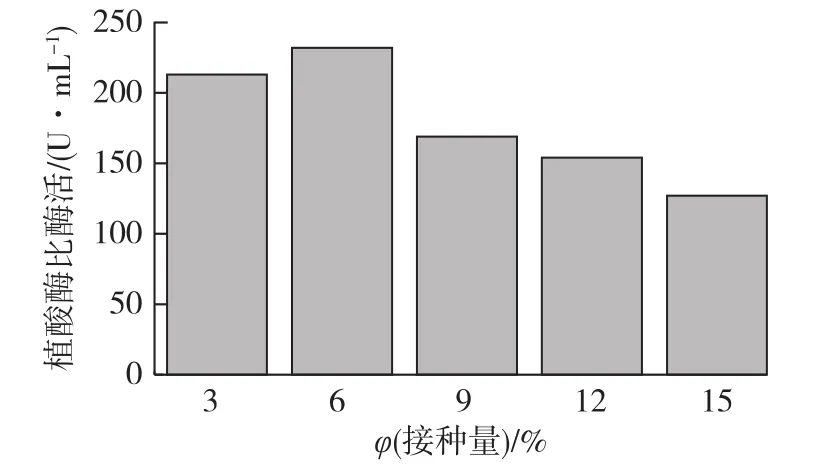
图2 接种量对产植酸酶的影响Fig.2 Effects of inoculation on phytase production
2.3 装液量对产酶的影响
摇瓶发酵培养过程中,主要是以装液量来控制溶氧。在250mL的摇瓶中,发酵初始生长 pH为6.0,发酵生长温度为30℃,菌体的接种量为6%,初始诱导pH 5.5,甲醇添加量为1%,诱导温度为27℃,转速220r/min,诱导表达96 h,考察装液量对酶活的影响,结果如图3所示。由图3可知:当装液量在20~30mL时,酶活较高;大于30mL时,酶活显著降低。这是因为装液量过大,会直接导致溶氧不足,影响菌体的代谢生成,从而影响植酸酶的诱导分泌表达。

图3 装液量对产植酸酶的影响Fig.3 Effect of containted quantity on phytase production
2.4 诱导剂甲醇添加量对产酶的影响
在250mL的摇瓶中,装液30mL,发酵初始生长pH为6.0,发酵生长温度为30℃,菌体的接种量为6%,初始诱导pH 5.5,甲醇添加量分别为0.5%、1.0%、1.5%、2.0%和2.5%(体积分数),诱导温度为27℃,转速220r/min,诱导表达96 h,考察甲醇添加量对酶活的影响,结果如图4所示。由图4可知:在甲醇添加量控制在1.0%~1.5%时,酶活力较高;但是在甲醇添加量较高(>1.5%)或较低(<0.5%)时,酶活力下降则比较显著,都不到最高酶活的一半。显然,在重组毕赤酵母的高密度发酵中,控制适宜的甲醇添加量是十分重要的。甲醇添加量过低,会导致AOX1启动子不能有效启动,进而使得外源基因不能够高效转录;而由于甲醇自身的特性,当甲醇添加量过高时,会造成发酵液中甲醇的积累,从而对菌体细胞产生毒害,也不能高效表达植酸酶。因此,在基因工程菌高密度发酵过程中,适宜的甲醇添加量是实现外源蛋白高效分泌的保证。

图4 甲醇添加量对产植酸酶的影响Fig.4 Effect of methanol concentration on phytase production
2.5 正交试验结果
在设定的水平范围内,根据正交试验设计及结果(表1),利用SPSS 10.0对结果进行极差分析,结果见表2。由表2可知:重组毕赤酵母产植酸酶的因素主次顺序从大到小依次为诱导时间、甲醇添加量、装液量、初始诱导pH、生长时间、接种量和初始生长pH,其中初始生长pH对发酵产酶的影响最小,诱导时间及诱导甲醇量对产酶的影响较大。通过极差分析,确定了重组毕赤酵母摇瓶发酵产植酸酶的优组合和优水平:接种量3%、装液量20mL、生长时间20 h,诱导时间120 h,甲醇添加量1.5%、初始生长pH 6.0,初始诱导pH 5.0。按照此条件进行验证试验,诱导表达出的植酸酶比酶活可达334 U/mL,比优化前(230 U/mL)提高了45%。

表1 L18(37)正交试验设计及结果Table 1 Results and designs of L18(37)orthogonal experiments

表2 正交试验极差分析Table 2 Range analysis of orthogonal experiments
3 结论
利用单因素及正交试验对毕赤酵母基因工程菌H311产植酸酶的摇瓶发酵工艺条件进行初步优化,并对正交试验条件进行了验证,优化后的摇瓶产植酸酶活性可达 334 U/mL,与优化前(230 U/mL)发酵产酶酶活相比有显著提高。但是,在摇瓶发酵水平上,由于不能较好地控制菌体生长所需要的溶氧、也不能实时监测发酵过程中甲醇浓度和pH值变化,因此摇瓶发酵并不能实现菌体的高密度培养,即重组基因工程菌的产酶水平若需达到工业化生产要求,则要进一步放大到发酵罐中发酵,并对其工艺条件进行优化。
[1]黄遵锡,章克昌.植酸酶基础与应用研究概况[J].食品与发酵工业,1999,25(2):54-58.
[2]朱启忠,王文君,黄梅娜,等.中性植酸酶菌株的筛选及性质[J].生物加工过程,2012,10(2):63-67.
[3]贺建华.植酸磷和植酸酶研究进展[J].动物营养学报,2005,17(1):1-6.
[4]谢子文,王红宁.毕赤酵母工程菌产植酸酶补料分批发酵研究[J].中国酿造,2007(6):9-13.
[5]丁强,杨培龙,黄火清,等.植酸酶发展现状和研究趋势[J].中国农业科技导报,2010,12(3):27-33.
[6]施安辉,王光玉,李桂杰,等.目前国内外植酸酶研究进展[J].中国酿造,2005,24(5):5-10.
[7]Cervantes H M,曹玉娟.饲用抗生素在家禽生产中的应用进展[J].中国家禽,2013,35(4):41-44.
[8]孔静静,王长城,杨海麟,等.产HSA-CP融合蛋白毕赤酵母的发酵条件优化[J].生物加工过程,2009,7(5):25-28.
[9]Jorquera M,Martínez O,Maruyama F,et al.Current and future biotechnological applications of bacterial phytases and phytaseproducing bacteria[J].Microbes Environ,2008,23(3):182-191.
[10]Vohra A,Satyanarayana T.Phytases:microbial sources,production, purification, and potential biotechnological applications[J].Crit Rev Biotechnol,2003,23(1):29-60.
[11]Casey A,Walsh G.Purification and characterization of extracellular phytase from Aspergillus niger ATCC9142[J]. Bioresour Technol,2003,86(2):183-188.
[12]Liu M,Potvin G,Gan Y,et al.Medium optimization for the production of phytase by recombinant Pichia pastoris grown on glycerol[J].Int J Chem React Eng,2011,9(1).
[13]洒荣波,唐瑜菁.发酵液中植酸酶活性测定方法的研究[J].中国酿造,2010,29(4):167-169.
(责任编辑 管 珺)
Optimization of phytase production by recombinant Pichia pastoris
MIN Zhaosheng1,GUO Huiming1,ZHANG Zhiqiang2,HONG Housheng2
(1.College of Sciences,Nanjing Tech University,Nanjing 211800,China;2.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
To optimize the condition for fermentation of phytase production by recombinant Pichia pastoris H311.The effects of inoculum,liquid volume,growth time,induction time,methanol concentration,initial growth pH and initial induction pH on expression of phytase in recombinant P.pastoris H311were studied by single factor experiment and L18(37)orthogonal experiment.Recombinant phytase was then characterized.The influencing factors on the expression of phytase were in the following order:induction time,methanol concentration,liquid volume,the initial induction pH value,growth time,inoculum and initial growth pH value.The optimal condition was with 3%(v/v)inoculum,20mL liquid volume(250mL flask),20 h growth time,120 h induction time,1.5%(v/v)methanol concentration,initial growth pH 6.0 value and initial induction pH 5.0.Under the optimal condition,the recombinant phytase reached an activity of 334 U/mL.
phytase;Pichia pastoris;fermentation;optimization;enzymatic activity
Q786
A
1672-3678(2015)03-0031-05
10.3969/j.issn.1672-3678.2015.03.006
2014-04-08
国家高技术研究发展计划(863计划)(2012AA021201)
闵兆升(1989—),男,江苏盐城人,硕士研究生,研究方向:基因工程、酶制剂;洪厚胜(联系人),教授,E-mail:hhs@njtech.edu.cn

