耐高糖米根霉菌株的生理特性
吕春微,徐 晴,陈 姣,李 霜
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 210009)
耐高糖米根霉菌株的生理特性
吕春微,徐 晴,陈 姣,李 霜
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 210009)
高糖发酵是提高产物浓度的常用方法,但天然菌株不能耐受高的糖浓度。为了解析高糖环境对菌株生理代谢的影响,以驯化获得的耐高糖菌株和原始菌株为对象,研究不同糖浓度对二者生理特性的影响。结果发现:与原始菌株相比,耐高糖菌株细胞膜不饱和脂肪酸的含量、胞内三磷酸腺苷(ATP)含量较高,且表现出更强的侧系呼吸强度。在此基础上,尝试通过调节碳氮比(C/N)或添加甘氨酸的方式补足原始菌株的代谢不足。结果表明:在150g/L糖质量浓度条件下,调节C/N为500时,原始菌株富马酸产量可由37.4g/L增至40.2g/L。而添加0.5g/L甘氨酸,原始菌株富马酸产量可以增至43.8g/L,提高了17.1%。
米根霉;富马酸;生理代谢;高糖
富马酸是一种重要的C4二羧酸,被广泛应用于食品、饲料、树脂合成等领域,随着全球石油资源的不断消耗和枯竭,发酵法生产富马酸愈来愈受到人们的广泛关注[1-2]。米根霉被认为是富马酸的最优生产菌株之一[3],但在批次发酵中,产物富马酸的质量浓度较低,仅为30g/L左右,增加了后续分离成本,削弱了生物基富马酸与石油基产品的竞争优势。
高糖发酵具有产物单位浓度高、设备利用率高、提取工艺简单等优点,在工业发酵中被广泛应用。目前,工业上高糖发酵往往采用流加补料的方式实现,但这种方式存在底物利用率低、染菌概率大、需要增加额外能耗及设备投资等问题[4-6],主要是自然微生物不能耐受高浓度的底物。针对这一问题,研究者多采用菌种诱变选育、高糖驯化等方式对菌株进行改造,以期提高其糖耐受性。
笔者所在实验室成员在前期研究过程中,亦通过高糖驯化的方法获得了具有较高葡萄糖耐受能力的富马酸发酵菌株。本文中,笔者拟以前期获得的耐高糖菌株及原始菌株(不耐受高葡萄糖浓度)为研究对象,对2株菌生理代谢差异进行比较,发掘影响菌株糖耐受性的关键生理因子,揭示微生物在高糖胁迫下的应激响应机制,以期为进一步提高米根霉高糖发酵水平奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种
耐高糖米根霉(Rhizopus oryzae H15),为Rhizopus oryzae ME-F14的突变株,保藏于南京工业大学代谢工程实验室。
1.1.2 培养基及培养条件
马铃薯葡萄糖琼脂(PDA)斜面培养基(g/L):去皮马铃薯200、蔗糖20、琼脂20。pH自然。
种子培养基(g/L):葡萄糖30、尿素20、KH2PO40.6、MgSO4·7H2O 0.11、FeSO4·7H2O40.008 8;pH 2.5。培养条件为250mL摇瓶装液量50mL,35℃、200r/min,培养30 h。
发酵培养基(g/L):葡萄糖80、120、150,尿素0.2,CaCO3为中和剂;pH自然。其他成分与预培养基相同。培养条件为250mL摇瓶装液量40mL,以体积分数10%接入种子液,于35℃、200r/min培养3~4 d。
1.2 分析方法
1.2.1 生物量的测定
菌体抽滤,无菌水洗涤,抽干,60℃烘干至恒质量后称质量,取平均值[7]。
1.2.2 葡萄糖浓度的测定
参照文献[8]使用SBA-40C型生物传感分析仪测定葡萄糖浓度。
1.2.3 富马酸产量的测定
由戴安P680型高效液相色谱检测[8]。具体条件:Chromeleon工作站,Sepax HP-C18色谱柱(250 mm×4.6 mm,5μm),流动相为0.1%磷酸-乙腈溶液(体积比为96.5∶3.5),流速0.6mL/min,柱温25℃,紫外检测波长210nm,进样量20 μL。
1.2.4 细胞膜脂肪酸的测定
细胞膜脂肪酸样品的制备按照文献[9]的方法进行。气相色谱分析条件:Thermo finnigan GC2000 DSQ型气相色谱仪,色谱柱DB-5MS(30 mm×0.32 mm,0.25μm);载气 He,载气流量 1mL/min。升温程序:初始温度80℃,以40℃/min速率升温,升到200℃,然后继续以10℃/min速率升温到300℃。传输线温度250℃,电离方式EI,70 eV,扫描范围50~600 aum。接口温度250℃,进样温度250℃。
1.2.5 三磷酸腺苷(ATP)含量的测定
胞内样品的制备根据文献[10]的方法进行改进。取菌体1mL于-40℃甲醇中猝灭 5min,-8℃ 5 000g离心5min,加入1mL 50%高氯酸冰浴10min,滴加一定量的K2CO3中和,5 000g离心10min。上清液用于检测ATP。高效液相色谱检测,戴安 P680,Chromeleon工作站,Sepax HPC18色谱柱(250 mm×4.6 mm,5μm)。流动相为磷酸盐缓冲液(10.93g NaH2PO4和 3.04g Na2HPO4溶于纯水中,加入四丁基溴化铵3.22g,调节pH为6.5,真空抽滤定容至1 L)和乙腈(体积比为86∶4);流速1mL/min;检测波长254nm;柱温35℃。
1.2.6 渗透压的测定
发酵液渗透压采用OSMOMAT030冰点渗透压仪测定[11]。
1.2.7 侧系呼吸强度测定
发酵36 h,采用液相氧电极 Chlorolab-3测定[12]。测定呼吸速率1~2min后,取30g/L的水杨氧肟酸(SHAM)30 μL,继续测定1~2min,记录加入菌体初始的呼吸速率R1及加入SHAM之后的呼吸速率R2,侧系呼吸强度由式(1)计算。

2 结果与讨论
2.1 高低糖条件下菌株发酵特性的比较
分别将耐高糖菌株及原始菌株接入葡萄糖质量浓度为80、120和150g/L的发酵培养基中培养,考察其生长情况,结果见图1。由图1可知:在低糖浓度下,2株菌的发酵差异不明显。发酵60 h时,富马酸产量约为29g/L。但随着糖浓度的增加,2株菌差异逐渐显现。当糖质量浓度为120g/L时,耐高糖菌株的整体发酵时间为84 h,发酵结束时,富马酸产量达37.7g/L,而原始菌株发酵120 h后葡萄糖才被完全消耗,富马酸产量为31.03g/L。当糖质量浓度增至150g/L时,发酵108 h,耐高糖菌株富马酸产量达41.6g/L,而此时原始菌株富马酸产量仅为35.36g/L。表明在高糖浓度下,经多次传代驯化后的富马酸生产菌细胞代谢可能发生了变化,从而能够耐受外界较高的糖浓度。
2.2 菌株耐高糖生理特性的研究
2.2.1 高糖环境对细胞膜脂肪酸组分的影响
细胞膜是菌体应对环境变化的第一道屏障,决定了糖是否能够顺利进入细胞,参与代谢。在对耐高糖菌株生理代谢的研究中,考察高糖胁迫条件下原始菌株与耐高糖菌株细胞膜组分的变化,结果见表1。由表1可知:随着糖浓度的增加,2株菌总不饱和脂肪酸(TUFA)含量及不饱和与饱和脂肪酸的质量比例(U/S)均逐渐上升,而总饱和脂肪酸(TSFA)则逐渐下降,且存在明显差异。当糖质量浓度为80g/L时,耐高糖菌株中TUFA质量分数为60.54%,较原始菌株(48.76%)高11.78%,而U/S较原始菌株高61%;当葡萄糖质量浓度高达150g/L时,耐高糖菌株与原始菌株细胞膜脂肪酸组分的差异愈加明显,耐高糖菌株中TUFA比原始菌株质量分数高出17.29%,U/S比例较原始菌株提高了108%。上述结果表明,在响应外界高糖环境时,菌株细胞膜的脂肪酸组分发生改变,不饱和脂肪酸组分增多,增加细胞的流动性,促进底物进入细胞,更好地适应外界环境。
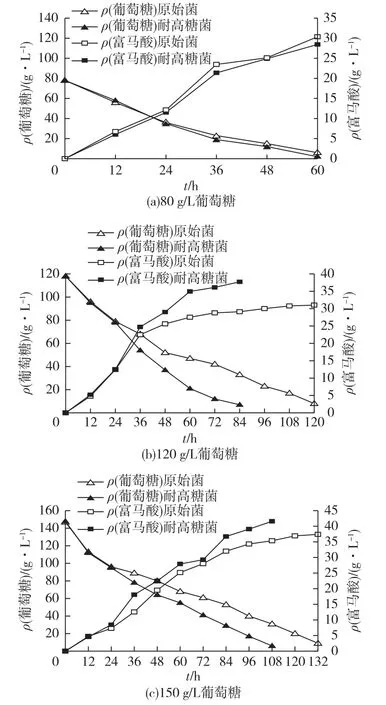
图1 不同初糖浓度条件下原始菌株与耐高糖菌株富马酸发酵曲线Fig.1 Time course of fumaric acid production by parent strain and high-glucose resistant strain under different glucose concentrations

表1 不同糖浓度条件下,原始菌株与耐高糖菌株细胞膜脂肪酸成分的变化Table 1 Changes in membrane fatty acids composition of parent strain and high-glucose resistant strain under different glucose concentrations
2.2.2 高糖环境对胞内ATP含量的影响
ATP是胞内的能量货币,是细胞代谢的重要参与者。考察了在不同底物浓度下,原始菌株与耐高糖菌株胞内ATP的变化,结果见表2。由表2可知:在同一糖浓度下,耐高糖菌ATP含量明显高于原始菌株,且随着糖浓度的增加,2株菌胞内ATP含量差异逐渐增大,在80g/L葡萄糖条件下,原始菌胞内ATP含量为0.37 nmol/mg,耐高糖菌为0.41 nmol/mg;当糖质量浓度增加到150g/L时,原始菌胞内ATP为0.44 nmol/mg,耐高糖菌为0.76 nmol/mg。产生这种现象的原因可能是随着糖浓度的增加,糖酵解和三羧酸循环(TCA)等途径调控作用显现,并伴随着胞内ATP再生速度的显著加快[13]。而耐高糖菌株胞内较高的ATP为细胞在高糖环境下提供了更多的代谢动力,从而实现对外界不良环境的抵御。

表2 不同糖浓度条件下原始菌株与耐高糖菌株的胞内ATP浓度Table 2 Changes in the intracellular ATP concentration levels of parent strain and high-glucose resistant strain under different glucose concentrations
2.2.3 高糖环境对细胞呼吸特性的影响
考察高糖浓度对发酵液的渗透压,结果见表3。由表3可知:当糖质量浓度由80g/L增至150g/L时,发酵液的渗透压由1.36 kPa增至2.44 kPa。高渗环境可能会引起胞内活性氧(ROS)水平的变化,从而使细胞遭受毒害,减少ROS的产生,成为提高菌体抵御高渗环境的关键。电子传递链复合物Ⅲ是ROS的主要产生位点,产生20%~80%的超氧阴离子·,而本课题组Gu等[14]在前期研究中发现,米根霉产富马酸的过程中除了电子传递链还存在着1条侧系呼吸途径,该途径能够绕过复合物Ⅲ和Ⅳ,由交替氧化酶(AOX)直接将泛醌的电子交给终端受体O2(图2),有助于降低胞内ROS的产生,从而有望增强菌株的抗胁迫能力。基于这一认识,笔者对原始菌株及耐高糖菌株在不同糖浓度下的侧系呼吸强度进行了测定,结果见表4。由表4可知:随着糖浓度的增加,细胞侧系呼吸强度逐渐增强。而在同一糖浓度下,耐高糖菌株的侧系呼吸强度明显高于原始菌株,当糖质量浓度达150g/L时,耐高糖菌株的侧系呼吸强度为46.7%,而原始菌株仅为38.5%。此实验结果进一步证实了侧系呼吸途径在减少ROS产生中的重要作用。

表3 不同糖浓度条件下发酵液渗透压的变化Table 3 Changes in osmolality under different glucose concentrations

图2 标准呼吸链和侧系呼吸链酶系[14]Fig.2 Enzymes of CN-sensitivity and SHAM-sensitivity respiration[14]

表4 不同糖浓度条件下原始菌株与耐高糖菌株侧系呼吸强度的变化Table 4 Changes in SHAM-sensitivity respiration of parent strain and high-glucose resistant strain under different glucose concentrations
2.3 外源添加对米根霉高糖发酵产富马酸的影响
菌种选育是目前提高菌株糖耐受性的主要方法,但菌种选育的随机性较大,且存在传代多次后退化的潜在风险。若能够通过简单的发酵工艺调控,即能增强菌株对高糖的耐受性,将极大地简化工艺,提高效率。笔者拟基于上述对菌株耐高糖机制的解析,探讨利用外源添加的方法补充原始菌株在生理代谢上的不足,以期提高菌株糖耐受能力。
2.3.1 调节C/N,提高米根霉产富马酸过程的糖耐受性
高氮含量能够激活TCA循环的关键酶柠檬酸合酶,从而有望合成更多的ATP,供菌体抵御外界环境胁迫。以原始菌株为研究对象,分别考察不同C/N条件下,米根霉发酵产富马酸的性能,结果见图3。由图3可知:随着C/N的升高,菌株的耗糖速率逐渐加快,C/N为500条件下,富马酸的发酵时间比C/N为1 500时缩短了12 h,同时富马酸产量由37.4g/L增加至40.2g/L。表明通过C/N的调节能够有效增强菌株的高糖耐受性。
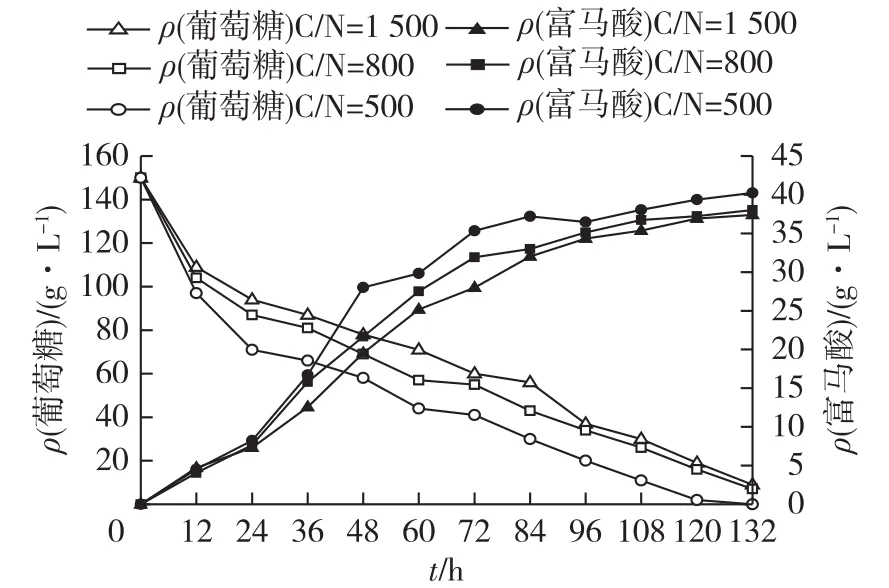
图3 高糖条件下不同C/N对富马酸发酵的影响Fig.3 Effects of C/N ratios on fumaric acid production under high-glucose concentration
2.3.2 添加甘氨酸,提高米根霉糖耐受性
氨基酸代谢与胞内能量代谢密切相关,能够增强己糖路径(EMP)与三羧酸循环(TCA),从而提高细胞代谢活力,增加细胞抵御不良环境的能力。而甘氨酸(Gly)可以在微生物胞内积累到较高浓度而对胞内其他微生物生理过程没有明显的负面影响。因此,笔者尝试在高糖发酵初期添加甘氨酸,考察甘氨酸对富马酸发酵的影响,结果见图4。由图4可知:以未添加甘氨酸的为对照,加入0.5g/L甘氨酸的菌株糖耗及产酸速率得到提高,发酵周期缩短24 h,富马酸产量由37.4g/L增加至43.8g/L。表明甘氨酸能够促进细胞能力代谢,提高细胞抵御高糖压力的能力。

图4 高糖条件下添加甘氨酸对富马酸发酵的影响Fig.4 Effects of addition of glycine on fumaric acid production under high-glucose concentration
3 结论
通过比较原始菌株与耐高糖菌株的代谢差异,发现耐高糖菌株细胞膜不饱和脂肪酸含量较高,胞内ATP含量增加,抵御ROS的侧系呼吸途径增强,表明耐高糖菌株具有更好的流动性、更大的细胞代谢动力以及抵御高渗环境的能力,从而使得细胞在高糖条件下具有较优的发酵性能。基于这一发现,在高糖质量浓度(150g/L)下,通过调节C/N或添加甘氨酸以弥补细胞的能量不足。当C/N为500时,原始菌株发酵周期可缩短12 h,富马酸产量由37.4g/L增加至40.2g/L,当添加0.5g/L甘氨酸时,原始菌株发酵周期可缩短24 h,富马酸产量由37.4g/L增加至43.8g/L。表明通过外源添加的方法可以提高细胞的代谢动力,缓解高糖胁迫。
[1]高振,张昆,黄和,等.利用根霉菌生产富马酸[J].化学进展,2009,21(1):251-258.
[2]李霜,徐晴,黄和,等.发酵法制备富马酸的关键技术及其进展[J].生物加工过程,2013,11(2):52-56.
[3]Xu Q,Li S,Huang H,et al.Key technologies for industrial production of fumaric acid[J].Biotechnol Adv,2012,30(6):1685-1696.
[4]Shimizu H,Araki K,Shioya S,et al.Optimal production of glutathione by controlling the specific growth rate of yeast in fedbatch culture[J].Biotechnol Bioeng,1991,38(2):196-205.
[5]Afschar A S,Bellgardt K H,Rossell C E,et al.The production of 2,3-butanediol by fermentation of high test molasses[J].Appl Microbiol Biotechnol,1991,34(5):582-585.
[6]Alfafara C G,Miura K,Shimizu H,et al.Fuzzy control of ethanol concentration and its application to maximum glutathione production in yeast fed batch culture[J].Biotechnol Bioeng,1993,41(4):493-501.
[7]徐晴,高振,付永前,等.米根霉ME-F12发酵产富马酸的菌体形态控制[J].生物加工过程,2009,7(2):48-52.
[8]何四龙,徐晴,李霜.D301树脂对富马酸的吸附性能[J].南京工业大学学报:自然科学版,2012,34(6):32-36.
[9]丛蕾蕾,纪晓俊,聂志奎,等.花生四烯酸油脂高产菌株的选育[J].生物加工过程,2012,10(5):34-38.
[10]窦畅,徐晴,宋萍.米根霉利用木糖与葡萄糖的代谢差异[J].微生物学报,2011,51(4):468-473.
[11]陈克杰,周景文,刘立明,等.高渗条件下利用蔗糖提升2-酮基-L-古龙酸生产效率[J].生物工程学报,2010,26(11):1507-1513.
[12]Deng Y F,Li S,Xu Q,et al.Production of fumaric acid by simultaneous saccharification and fermentation of starchy materials with 2-deoxyglucose-resistant mutant strains of Rhizopus oryzae[J].Bioresour Technol,2012,107:363-367.
[13]Varela C,Agosin E,Baez M,et al.Metabolic flux redistribution in Corynebacterium glutamicum in response to osmotic stress[J]. Appl Microbiol Biotechnol,2003,60(5):547-555.
[14]Gu S,Xu Q,Huang H,et al.Alternative respiration and fumaric acid production of Rhizopus oryzae[J].Appl Microbiol Biotechnol,2014,98(11):5145-5152.
(责任编辑 荀志金)
Physiological characteristics of a high-glucose resistant Rhizopus oryzae
LYU Chunwei,XU Qing,CHEN Jiao,LI Shuang
(State Key Laboratory of Materials-Oriented Chemical Engineering,College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 210009,China)
Fermentation in high glucose is a common strategy to improve the product concentration in industry.However,natural strains can not withstand high glucose.With the aim of elucidating the effects of high glucose on physiological metabolism of fumaric acid producer Rhizopus oryzae,membrane fatty acid composition,intracellular adenosine triphosphate(ATP)level,and the salicylhy-droxamic acid sensitivity respiration of the parent strain and the high-glucose resistant strain were determined and compared at different glucose concentrations.Compared to that of the parent strain,the high-glucose resistant strain exhibited higher content of the unsaturated fatty acids and higher membrane fluidity,higher ATP level and stronger salicylhy-droxmic acid sensitivity respiration.To compensate the deficiencies in metabolic of the parent strain,C/N ratio was adjusted or glycine was added.In fermentation with 150g/L glucose medium,and 500 C/N,fumaric acid could increase from 37.4 to 40.2g/L.The addition of 0.5g/L glycine also improved the productivity of fumaric acid by 17.1%,it increased to 43.8g/L.
Rhizopus oryzae;fumaric acid;physiological metabolism;high glucose
Q939.97
A
1672-3678(2015)03-0036-05
10.3969/j.issn.1672-3678.2015.03.007
2014-01-12
国家重点基础研究发展计划(973计划)(2013CB733600);国家高技术研究发展计划(863计划)(2011AA02A206);国家自然科学基金(21106065)
吕春微(1988—),女,江苏新沂人,硕士研究生,研究方向:微生物细胞生理;李 霜(联系人),教授,E-mail:lishuang@njtech.edu.cn

