蒸煮对红小豆及其汤汁抗氧化特性的影响
蒸煮对红小豆及其汤汁抗氧化特性的影响
姚鑫淼1, 2,郑先哲1*,卢淑雯2,任传英2,张英蕾2,谢学军2
(1.东北农业大学工程学院,哈尔滨150030;2.黑龙江省农业科学院食品加工研究所,哈尔滨150086)
摘要:为保证蒸煮后红小豆及其汤汁抗氧化成分含量,研究选择不同粒形、大小和色泽的3个代表性红小豆品种(系)龙引09-05、中红7号和宝清红,对其蒸煮过程中汤汁pH、色值以及汤汁和豆粒总抗氧化能力、DPPH清除率及总酚含量变化进行跟踪监测,随着蒸煮时间延长,不同品种红小豆汤汁pH均由接近中性(pH 6.8)快速降低至弱酸性(pH 6.1)并保持稳定,汤汁亮度逐渐降低,彩度先增加后稳定在一定水平。品种间汤汁和豆粒总抗氧化能力、DPPH清除率及总酚含量差异均极显著(P<0.01)。蒸煮过程中,各指标在变化趋势上具有较高一致性,即随着蒸煮时间延长,红小豆汤汁和豆粒总抗氧化能力均由相对最高值明显下降(P<0.01),20 min后基本保持稳定(P> 0.05);在煮沸30 min内蒸煮时间对汤汁DPPH清除率影响显著(P<0.05);在煮沸10~50 min各样品豆粒DPPH清除率呈上升趋势,蒸煮时间对豆粒DPPH清除率影响极显著(P<0.01),清除率最终稳定在较高水平;汤汁总酚含量先逐渐增大,后呈小幅上下波动,最终稳定在较高水平,蒸煮时间对汤汁和豆粒总酚含量影响均极显著(P<0.01);3个红小豆品种(系)以宝清红抗氧化能力和清除自由基能力最强。对各指标间相关性进行分析。结果表明,汤汁的总酚含量与色值具有较大相关性,其中彩度C*值与总酚含量相关性可高达0.97,具有通过红小豆汤汁彩度值快速预测其总酚含量的可行性,而蒸煮红小豆豆粒中酚类物质含量与其抗氧化能力或者清除DPPH能力无明显相关性。
关键词:红小豆;总酚;总抗氧化能力;相关性
网络出版时间2015-1-12 9:54:26
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150112.0954.013.html
姚鑫淼,郑先哲,卢淑雯,等.蒸煮对红小豆及其汤汁抗氧化特性的影响[J].东北农业大学学报, 2015, 46(1): 101-108.
红小豆营养丰富,含有多种生物活性物质,如多酚、黄酮类、生物碱、香豆素等[1],其中多酚类物质具有强抗氧化活性,对多肽和蛋白质有强亲和力,能抑制淀粉酶和胰蛋白酶,具有潜在的降血糖活性[2],这些功能特性对于预防和控制目前多发的心血管疾病、肝损伤、动脉硬化、糖尿病和癌症等[3]具有明显功效。
蒸煮是豆类常规加工方式。蒸煮过程可软化豆类表皮和内部组织,产生良好的风味和口感[4],但可能使豆类中抗营养因子失去活性,影响其抗氧化能力,降低豆类食品品质。红小豆在蒸煮过程中,产生一定量剩余汤汁,尤其在红小豆淀粉糊化、风味形成初期,汤汁色泽鲜艳,较澄清,溶解大量红小豆种皮中生物活性成分,包括黄酮、花色苷和皂素类化合物等[5],非常适宜加工成饮料。国内外对红小豆加工特性研究主要集中在红小豆淀粉理化特性、品种粒形和淀粉颗粒度、加工方式、加工条件、添加剂(糖类及甜味剂)对红小豆及其产品红豆沙、红豆粉等的品质特性(如色泽、口感、质构特性、碳水化合物消化速率等)影响[6]。随着豆类抗氧化特性的研究深入[2,7],豆类加工产品的品质研究重点将转移到其生物活性成分变化方向,易建勇等对煮制红豆汤抗氧化特性进行分析指出,红小豆中86%抗氧化能力由红小豆种皮中的物质决定,并对煮制时间(60 min内)、煮制pH及有氧光照下贮存对红小豆汤抗氧化能力变化情况进行研究[8]。蒸煮过程中豆粒和汤汁抗氧化特性均与相关产品(豆馅、豆汁饮料等)最终的功能特性有关。本文研究不同品种红小豆在蒸煮过程中,汤汁pH、色值及汤汁和豆粒总酚含量、总抗氧化能力和DPPH清除率的变化规律,分析各指标间相关性,确定表征红小豆加工过程中抗氧化特性变化指标,为优化红小豆产品加工工艺、提高产品营养特性提供理论依据。
1 材料与方法
1.1材料与试剂
选择具有较好田间性状、不同色泽、粒形和颗粒大小的3个有代表性的红小豆品种(系)龙引09-05、中红7号和宝清红,分别由黑龙江省农业科学院作物育种所和黑龙江省农业科学院齐齐哈尔分院提供,为2012年新种。
蒸煮红小豆所用纯净水购自乐百氏公司;化学分析用水取自实验室自制超纯水;盐酸(分析纯)产自天津基准化学试剂有限公司;总抗氧化能力(T-AOC)测试盒产自南京建成生物工程研究所;DPPH试剂(257621-100MG)产自ALOAICH Chem⁃istry;无水乙醇(分析纯)产自天津基准化学试剂有限公司;没食子酸(分析纯)产自天津市科密欧化学试剂开发中心;Folin试剂(F-9252)产自SIGMA公司;碳酸钠(分析纯)产自中国天津市巴斯夫化工有限公司。
1.2仪器与设备
CARY100分光光度计产自德国贺利氏瓦里安公司;漩涡混合器产自上海琪特分析仪器有限公司;雷磁PHS-3G pH计产自上海精科有限公司;3-18K离心机产自德国西格玛公司;CM-5色差计产自柯尼卡美能达(中国)投资有限公司;C19S04电磁炉产自浙江苏泊尔股份有限公司;光明电热恒温水浴锅产自北京市永光明医疗仪器厂;DHG-9240A恒温干燥箱产自上海恒科科学仪器有限公司;RL-2002IC电子天平产自梅特勒-托利多仪器(上海)有限公司;国华SHA-B恒温水浴振荡器产自常州国华电器有限公司;CT410旋风磨产自福斯公司;实验室超纯水设备产自美国密理博公司。
1.3方法
1.3.1红小豆蒸煮
准确称取(500±0.5)g红小豆样品,室温下用流水清洗干净。采用“蒸饭式”煮豆技术[9],在特制煮豆装置中,如图1所示,控制煮豆过程加水量,将洗好的红小豆加入直径12 cm,高18 cm柱形不锈钢丝笼内,笼壁均匀分布有直径为2 mm小孔,豆平铺底部后,上方加网盖,可一定程度保持豆粒在煮制过程中完整性,按料液比1ϑ7加入纯净水(3 500±5)mL,将豆笼放入不锈钢煮锅中,移至电磁炉上,P4档(加热功率1.1 kW)进行加热蒸煮。1.3.2汤汁样品制备

图1 实验室“蒸饭式”煮豆装置Fig. 1 Laboratory equipment for bean cooking
待锅内汤汁沸腾后开始取样,每间隔10 min 取50 mL汁液,共取10份(沸腾90 min),待汤汁冷却至室温后,以10 000 r·min-1离心10 min,取上清液过0.2 μm滤膜备用。1.3.3豆粒样品制备
取样开始后,在取汤汁的同时,用不锈钢勺取笼内中部豆粒约20 g,每间隔10 min取1次,共取10份(沸腾90 min),分别用玻璃平皿盛好,放入电热鼓风干燥箱中以50℃低温烘24 h。干燥结束后,用旋风磨将样品粉碎至过60目筛备用。分别取粉碎样品1.5 g于锥形瓶内,加入15 mL无水乙醇(含1%盐酸)溶液,放入恒温水浴振荡器(50℃)中振荡提取2 h(振荡速率以样品充分混合为准)。以10 000 r·min-1离心10 min后,取上清液过0.2 μm滤膜用于后续测试。
1.3.4测定方法
1.3.4.1红小豆汤汁pH测定
将pH计电极放入汤汁提取液(室温22℃)中进行测定,待读数稳定后读取各时段汤汁pH,每个样品平行3次,不同样品间测定时需进行电极清洗。
1.3.4.2红小豆汤汁色值测定
红小豆汤汁色值以1976年国际照明委员会(CIE)规定的3个参数L*、a*、b*记录数值,:L*代表亮度指数,数值越大说明越明亮;a*和b*被称为色度指数,分别表示红色度与黄色度,a*数值越大说明色泽越红,b*数值越大说明色泽越鲜艳,计算公式如下[10]:

将各时段汤汁样品分别倒入测试用石英杯中(1 cm)并至标准液位刻度处,将其固定在测试台,读数并记录。
1.3.4.3煮制红小豆及其汤汁总抗氧化能力的测定
采用总抗氧化能力(T-AOC)测试盒(南京建成生物工程研究所)测定,3次重复。准确吸取待测样品0.5 mL放入样品管中,加入3.5 mL混合试剂(试剂一、二、三以体积比1ϑ2ϑ0.5比例添加混合),对照管中只加入3.5 mL混合试剂,迅速放入37℃恒温水浴锅中,水浴30 min后取出,在样品管和对照管中分别加入试剂四0.2 mL,混匀后在对照各管中补加入待测样品0.5 mL,最后在样品管和对照管中分别加入0.2 mL试剂五,充分混匀后,室温放置10 min,于520 nm处测量各管吸光度值。按下式进行计算:
T=(OD测量-OD对照)/0.03/30×(V反/V取)×A
式中,T—总抗氧化能力(mL;g);
OD测量—样品管中待测样品吸光度值;
OD对照—对照管中待测样品吸光度值;
V反—反应液总体积(mL);
V取—样品取样量(mL);
A—样品测试前稀释倍数。
1.3.4.4煮制红小豆及其汤汁DPPH清除率的测定
准确称取DPPH标准品(10±0.01)mg,用无水乙醇定容至250 mL,配制成0.004%的DPPH标准溶液。
样品吸光值测定:取3 mL待测样品,加入3 mL DPPH标准溶液,将其充分混匀,静置70 min后于517 nm处测其吸光值;
本底吸光值测定:取3 mL待测样品,加入3 mL无水乙醇,其余操作同上;
空白吸光值测定:取3 mL无水乙醇,加入3 mL DPPH标准溶液,其余操作同上[11]。
按下式进行计算:

式中,S—DPPH清除率(%);A0—空白吸光值;
Ai—样品吸光值;
Aj—本底吸光值。
1.3.4.5煮制红小豆及其汤汁总酚含量的测定
准确称取(30±0.01)g无水碳酸钠于烧杯中,加适量蒸馏水于60℃恒温水浴溶解,转入250 mL容量瓶,冷却至室温定容,配制成12%碳酸钠溶液。
分别配制0、4、8、12、16、20 μg·mL-1没食子酸系列标准溶液。用移液枪分别移取1 mL没食子酸系列标准溶液和待测样品,为使该显色反应充分且稳定,依次加入2 mL Folin试剂(Folin试剂与样品体积比为2ϑ1)和4 mL 12%碳酸钠溶液(碳酸钠溶液与Folin试剂体积比为2ϑ1)[12],用蒸馏水定容至25 mL,混匀后室温避光静置2 h,在波长为760 nm处测定溶液吸光值,以没食子酸浓度为横坐标、吸光值为纵坐标绘制标准曲线,如图2所示。
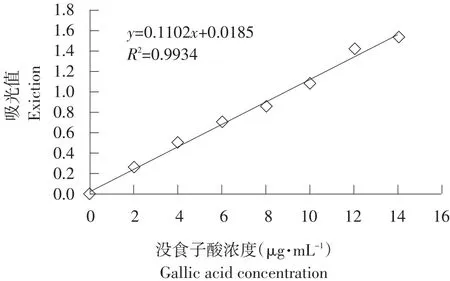
图2 没食子酸标准曲线Fig. 2 Standard curve of gallic acid
取0.5 mL待测样品,依次加入1 mL Folin试剂和2 mL 12%碳酸钠溶液,用蒸馏水定容至25 mL,混匀后避光放置2 h,于760 nm处测定其吸光值,在标准曲线上查得总酚含量。
2 结果与分析
2.1煮制时间对汤汁pH的影响
煮制时间对各样品汤汁pH的变化情况见图3。随着煮制时间延长,3个品种(系)的红小豆汤汁pH均迅速降低,在沸腾后30 min内汤汁pH从6.8快速下降至6.2,之后70 min持续沸腾,汤汁始终在pH 6.1处趋于平稳。在蒸煮过程中,红小豆汤汁由中性转为弱酸性,3个品种(系)汤汁pH差异不大,这是由于随着蒸煮进行,红小豆表皮中各种物质不断溶出,累积的氢离子浓度大于氢氧根离子浓度,使整个体系环境呈现弱酸性。
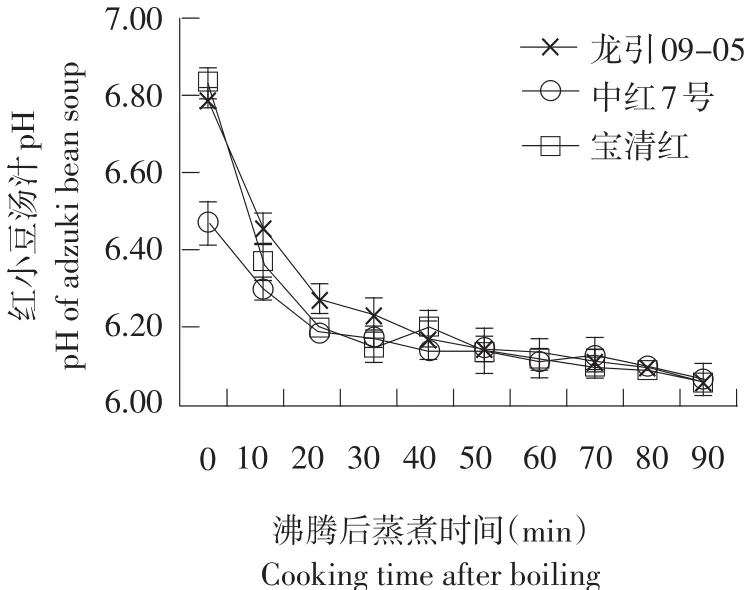
图3 汤汁pH随煮制时间的变化情况Fig. 3 pH of adzuki bean soup varied with cooking time
2.2煮制时间对汤汁色值的影响
图4为煮制不同时间各样品色值的变化情况。
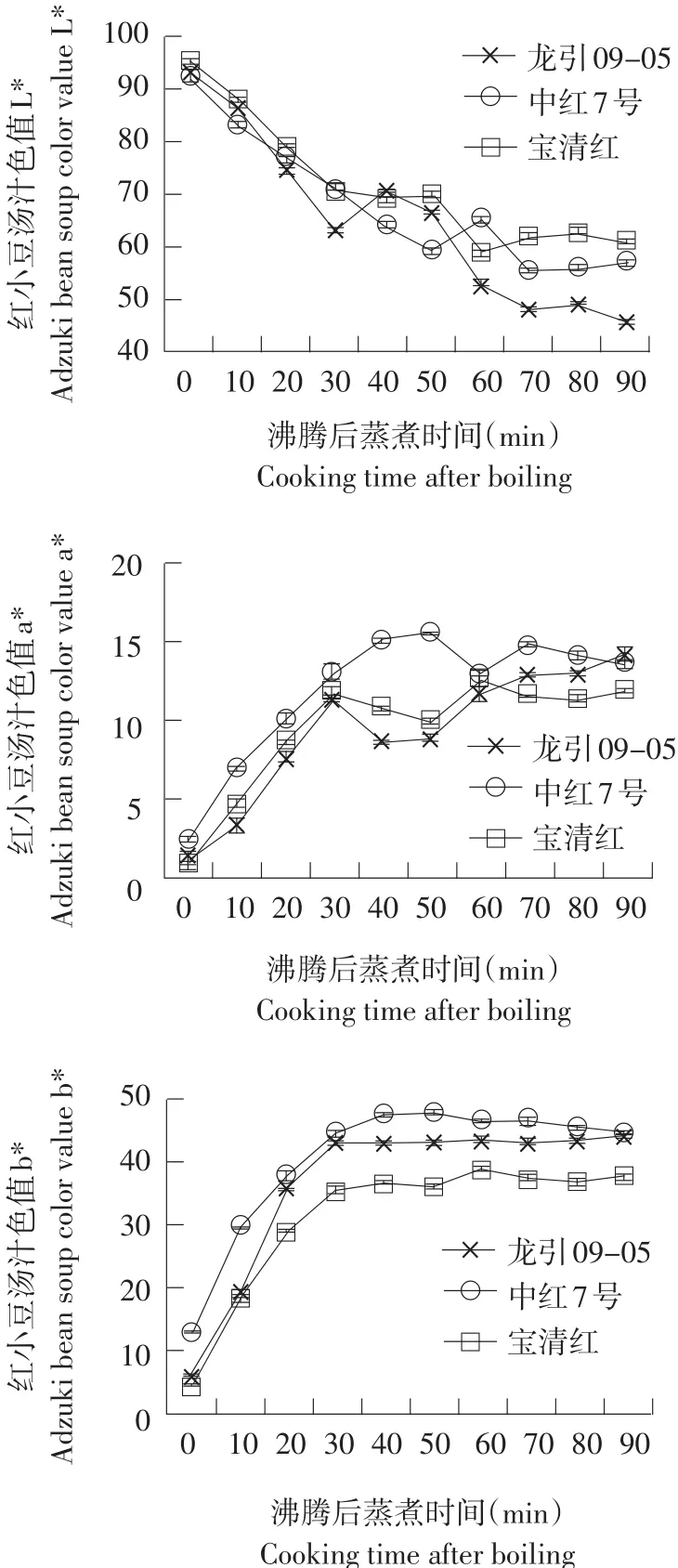
图4 样品不同煮制时间汤汁色值L*、a*、b*变化情况Fig. 4 Color value (L*, a*, b*) ofadzuki bean soup varied with cooking time
经方差分析可知,蒸煮时间对红小豆汤汁L*、a*、b*值有极显著影响(P<0.01)。随着煮制时间延长,红小豆汤汁色值变化呈现出一致趋势。L*代表亮度指数,数值越大说明越明亮,由于蒸煮过程中红小豆表皮和内部物质逐渐溶解到汤汁中,因此3个样品汤汁明亮度均随着煮制时间延长而减小,约在70 min后趋于平稳;a*值代表红色度,数值越大说明汤汁色泽越偏红,b*值代表黄色度,数值越大说明汤汁色泽越鲜艳,3个样品a*值和b*值均随着煮制时间延长而呈现先迅速升高后趋于稳定趋势。由此可知,在煮制红小豆时,沸腾40 min,可获得相对色泽鲜艳的棕红色红小豆汤汁,进一步加热,在沸腾90 min时间段内,汤汁红色度和黄色度相对稳定,红小豆种皮中融入汤汁的色素颜色受温度影响变化不明显,在100℃以内对温度相对稳定。
2.3煮制时间对总抗氧化能力的影响
由图5可知,3个红小豆品种汤汁总抗氧化能力在煮沸前20 min内均有下降趋势,经统计分析呈极显著(P<0.01);而在30~90 min抗氧化能力变化不显著(P=0.061>0.05);品种间抗氧化能力差异极显著(P<0.01);汤汁抗氧化能力来自溶解于汤汁的红小豆种皮中的黄酮、花色苷、烟酸和皂素等,在加热初始阶段,这类物质溶出,因此汤汁抗氧化能力有短暂升高,但随着加热过程进行,这部分物质温度升高发生降解或失活,抗氧化能力减弱。中红7号样品汤汁总抗氧化能力从沸腾开始不断下降,无上升阶段,可能是由于其种皮结构疏松,各种成分溶出较快,其抗氧化能力最高点出现在预煮阶段。采用本研究的红小豆“蒸煮”方式,在沸腾后10 min可获得较高抗氧化能力的红小豆汤汁。
3个品种(系)红小豆豆粒总抗氧化能力在煮沸0~20 min明显下降,经方差分析抗氧化能力变化极显著(P<0.01),之后在20~90 min不同品种豆粒抗氧化能力差异不显著(P=0.056>0.05),而蒸煮过程对其抗氧化能力仍具有极显著影响(P<0.01)。蒸煮完成时略有上升,抗氧化能力增强,这可能是由于红小豆种皮中结合态的抗氧化物质发生解离,一定程度提高其抗氧化能力[8]。3个品种(系)红小豆煮制过程中抗氧化能力有一致变化规律:在沸腾10 min内红小豆抗氧化能力最强。但从红小豆加工成食品方面考虑,要求在煮制过程使其内部淀粉充分溶胀、糊化,产生良好风味和口感,煮制时间一般要达到60 min,红小豆抗氧化能力虽有所下降,但仍然保留部分抗氧化活性。
蒸煮过程中,各样品汤汁总抗氧化能力由强到弱依次是:宝清红>中红7号>龙引09-05;红小豆样品豆粒总抗氧化能力由强到弱依次是:宝清红≈龙引09-05>中红7号。
2.4煮制时间对DPPH清除率的影响
由图6可知,各品种蒸煮后汤汁DPPH清除率变化极显著(P<0.01),而在煮沸30 min内蒸煮过程对汤汁DPPH清除率影响显著(P=0.020<0.05);在煮沸10~50 min各样品豆粒DPPH清除率呈上升趋势,蒸煮过程对豆粒DPPH清除率影响极显著(P< 0.01),且不同品种红小豆豆粒DPPH清除率差异极显著(P<0.01),清除率最终稳定在较高水平。
各样品汤汁DPPH清除率从大到小依次是:宝清红>中红7号>龙引09-05;各样品豆粒DPPH清除率从大到小依次是:宝清红>中红7号>龙引09-05,平均以宝清红汤汁和豆粒DPPH清除效果最好。

图5 不同煮制时间总抗氧化能力变化情况Fig. 5 Total antioxidant activity varied with cooking time

图6 不同煮制时间DPPH清除率变化情况Fig. 6 DPPH scavenging rate varied with cooking time
2.5煮制时间对总酚含量的影响
由图7可知,各样品在沸腾后30 min内汤汁总酚含量逐渐增大,30~90 min蒸煮时间对汤汁总酚含量影响极显著(P=0.004<0.01),品种间汤汁总酚含量变化极显著(P<0.01),最终稳定在较高水平。中红7号和宝清红在沸腾后60 min内有小幅下降趋势,在沸腾70 min时总酚含量达到最大值,之后10 min内迅速下降至平均值并继续保持小幅波动;而龙引09-05在沸腾10 min时总酚含量达到最大,之后迅速下降,在20~40 min又上升至第2高点,随后下降至最低值,并保持基本恒定。蒸煮时间对豆粒总酚含量影响极显著(P<0.01),品种间豆粒总酚含量变化极显著(P<0.01)。
各样品汤汁总酚含量由高到低依次是:龙引09-05>中红7号>宝清红;各样品豆粒总酚含量由高到低依次是:中红7号>宝清红>龙引09-05。
2.6红小豆样品各项指标相关性分析
2.6.1红小豆汤汁各项指标相关性分析
将3个红小豆品种煮制汤汁的各项指标分别进行相关性检验,结果见表1。

图7 不同煮制时间总酚含量变化Fig. 7 Total phenol content varied with cooking time
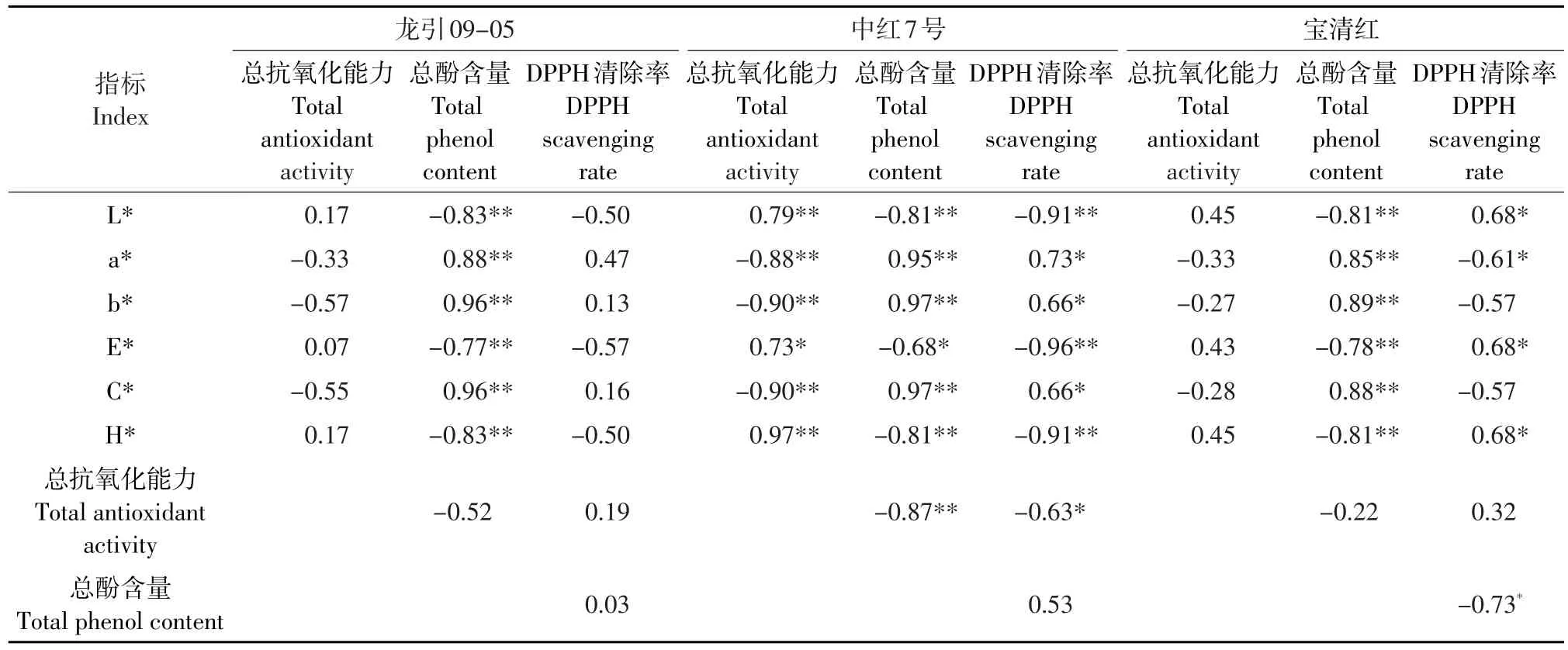
表1 红小豆煮制过程中汤汁各项指标相关性分析Table 1 Correlation among indices of adzuki bean soup during cooking
由表1可知,总酚含量与色值具有较大相关性。各品种(系)汤汁总酚含量与亮度(L*)、色值(E*)和色调(H*)呈正相关;与红色度(a*)、黄色度(b*)和彩度(C*)呈负相关。由于彩度(C*)包含更全面的色彩信息,可以通过彩度(C*)来预测样品中总酚含量,规律为彩度(C*)越大样品中总酚含量越高。由于彩度(C*)包含更全面的色彩信息,因此更具有全面性与可靠性。红小豆中酚类物质中绝大部分是花青素类(呈现红色),因此彩度C*值与总酚含量理论上具有相关性,通过本试验得到进一步验证,相关系数可达到0.97。
2.6.2红小豆籽粒各项指标相关性分析
将3个红小豆品种煮制后的豆粒各项测定指标之间分别进行相关性检验,结果见表2。
由表2可知,龙引09-05总抗氧化能力与DPPH清除率呈极显著负相关,宝清红总抗氧化能力与DPPH清除率呈显著负相关,但中红7号样品并没有呈现相同规律,且3个红小豆品种(系)蒸煮后豆粒总酚含量与总抗氧化能力和DPPH清除率并无明显相关性,因此不能简单地以酚类物质含量来评价红小豆抗氧化能力或者清除DPPH能力,这可能是由于酚类物质只是红小豆多种功能特性组分中的一类,Amarowicz等通过试验对红小豆中总酚和单宁两种物质进行总抗氧化活性及DPPH自由基的抗氧化试验,研究发现,总酚和单宁含量与抗氧化性呈正相关[2]。此外,红小豆还含有丰富的黄酮类、生物碱类等化学物质,也具有很强的抗氧化活性[13]。

表2 红小豆煮制过程中籽粒各项指标的相关性分析Table 2 Correlation among indices of adzuki beans during cooking
3 结 论
不同品种(系)红小豆样品,在蒸煮过程中,汤汁和籽粒各种特性指标变化有一定规律,在蒸煮过程中,红小豆汤汁pH逐渐降低,汤汁呈弱酸性,亮度降低,彩度增加,汤汁变得厚重浓郁;红小豆中各种成分随着加热蒸煮不断溶解到汤汁中,使汤汁总酚含量、总抗氧化能力和DPPH清除率有不同程度增加,随着加热略有降低,红小豆籽粒中各项指标也有明显降低趋势,但在适当加工时间(馅料加工时间约60 min,汤汁加工时间约25 min)仍保留很大程度含量和活性。红小豆汤汁彩度值与汤汁总酚含量具有很高相关性,可作为快速简便预测指标。无论是红小豆汤汁还是籽粒,总酚含量都不能简单地与其抗氧化能力和自由基清除力建立相关性,需进一步研究样品中其他生物活性成分如黄酮类、生物碱、香豆素等,探究在抗氧化贡献和协同作用。
[参考文献]
[1]Breene W M, Hardman L L. Anatomy of a specialty crop-the adzu⁃ki bean experience. A symposium on grain legumes as alternative crops[C]. Minnesoto: Centre for Alternative Crops and Products, University of Minnesota, 1987: 67-77.
[2]Amarowicz R, Estrella I, Hernandez T, et al. Antioxidant activity of extract of adzuki bean and its fractions[J]. Journal of Food Lip⁃ids, 2008, 15(1): 119-136.
[3]Mukai Y, Sato S. Polyphenol-containing azuki bean (Vigna angu⁃ laris) seed coats attenuate vascular oxidative stress and inflamma⁃tion in spontaneously hypertensive rats[J]. Journal of Nutritional Biochemistry, 2011, 22(1): 16-21.
[4]Vijayakumari K, Sidduraju P, Pugalenthi M, et al. Effect of soak⁃ing and heat processing on the levels of antinutrients and digest⁃ible proteins in seeds of Vigna aconitifolia and Vigna sinensis[J]. Food Chemistry, 1998, 63: 259-264.
[5]张志宏,张颜宇,佟敏强.红小豆国际市场需求与变化[J].产品跟踪, 2003(1): 46.
[6]Kaur M, Sandhu K S, Singh N. Amylose content, molecular struc⁃ture, physicochemical properties and in vitro digestibility of starches from different mung bean (Vigna radiata L.) cultivars[J]. Starch/Starke, 2011, 63: 709-716.
[7]Jayawardana B C, Hirano T. Utilization of adzuki bean extract as a natural antioxidant in cured and uncured cooked pork sausages [J]. Meat Science, 2011, 89: 150-153.
[8]易建勇,梁皓,王宝刚,等.煮制红小豆的抗氧化特性分析[J].农产品加工学刊, 2007(7): 78-81.
[9]任传英,姚鑫淼,卢淑雯.粒状红豆馅和红豆饮料的制备方法[P].中国: 201310134143. 7 .
[10]刘浩学. CIE均匀颜色空间与色差公式的应用[J].北京印刷学院学报, 2003, 11(8): 5-6.
[11]汤昆,邱娜,邱金东.核桃仁抗氧化活性成分对自由基DPPH清除时间和清除率的研究[J].中成药, 2009, 31(8): 1287-1288.
[12]李巨秀,王柏玉.福林-酚比色法测定桑椹中总多酚[J].食品科学, 2009, 30(18): 292-295.
[13]赵建京,范志红,周威.红小豆保健功能研究进展[J].中国农业科技导报, 2009, 11(3): 46-50.
Yao Xinmiao, Zheng Xianzhe, Lu Shuwen, et al. Effect of cooking on antioxidant activity of adzuki beans and its soup[J]. Journal of Northeast Agricultural University, 2015, 46(1): 101-108. (in Chinese with English abstract)
Effect of cooking on antioxidant activity of adzuki beans and its soup/
YAO Xinmiao1,2, ZHENG Xianzhe1, LU Shuwen2, REN Chuanying2, ZHANG Yinglei2, XIE Xuejun2
(1. School of Engineering, Northeast Agricultural University, Harbin 150030, China; 2.Food Processing Research Institute, Heilongjiang Academy of Agricultural Sciences, Harbin 150086, China)
Abstract:Antioxidant properties of cooked adzuki beans and soup in terms of pH, color, total antioxidant activity, DPPH scavenging rate, total phenol content were investigated during cooking to ensure its antioxidant ingredients. Three adzuki bean varieties (strains) with different kernel shape, size and color named Longyin 09-05, Zhonghong No.7 and Baoqinghong were selected as materials. pH of all adzuki bean varieties rapidly decreased from nearly neutral pH (pH 6.8) to slightly acidic (pH 6.1) and then kept stablebook=46,ebook=107with the cooking time. Brightness gradually decreased while chroma increased firstly and then stabilized at a certain level. Very significant differences(P<0.01)were found among the total antioxidant capacity, DPPH scavenging rate and total phenol content of varieties of adzuki beans and soup. The change trends of these properties had high consistency during cooking process, and the bean and soup's total antioxidant capacity decreased gradually(P<0.01)from the relatively high level, and then remained stable(P>0.05)in 20 min. Soup's DPPH scavenging rate tended to the declining trends in 30 min, and the difference was significant (P<0.05). The beans' DPPH scavenging rates rose slowly with fluctuations from 10 to 50 min(P<0.01), the final scavenging rates were stable at a high level, total phenol content in soup increased gradually at first 30 min, and then had the slight fluctuations till to a high level. The difference of total phenol content on cooking time was very significant in both beans and soup. Among three varieties (strains), Baoqinghong bean had the highest antioxidant capacity and free radical scavenging ability. The correlations among various indices were analyzed. The results showed that the total phenol content of soup had a significant correlation with the color value, especially the correlation between value of Chroma C* and the total phenol content reached 0.97. This result suggested that it was feasible to rapidly estimate the total phenolic content of adzuki soup based on the Chroma values. And the content of polyphenols in cooked adzuki bean had no significant correlation with its antioxidant capacity or its ability to scavenge DPPH.
Key words:adzuki bean; total phenols; antioxidant activity; correlation
*通讯作者:郑先哲,教授,博士生导师,研究方向为农产品加工。E-mail: zhengxz@neau.edu.cn
作者简介:姚鑫淼(1980-),女,副研究员,博士研究生,研究方向为农产品加工。E-mail: cocoyococo@163.com
基金项目:黑龙江省科技厅对外合作项目(WB12B10104);农业部“948”项目(2012-Z45)
收稿日期:2013-10-15
文章编号:1005-9369(2015)01-0101-08
文献标志码:A
中图分类号:TS214.9

