Netherton综合征一例SPINK5基因突变研究
许桂文 尹菁华 汪慧君 周云 张洁 陈官芝 林志淼 杨勇 汤占利
·论著·
Netherton综合征一例SPINK5基因突变研究
许桂文 尹菁华 汪慧君 周云 张洁 陈官芝 林志淼 杨勇 汤占利
目的 检测Netherton综合征患者SPINK5基因的突变情况。方法 收集患者临床资料,提取患者及其相关亲属外周血DNA,用PCR扩增SPINK5基因编码区的全部外显子及其侧翼序列并测序。结果直接测序发现患者SPINK5基因的第13号外显子中的第1111位碱基发生C→T杂合突变(c.1111C>T),导致其编码第371位氨基酸变为终止密码子(p.R371X);第32号外显子中的第3121位碱基发生C→T杂合突变(c.3121C>T),导致其编码第1041位氨基酸发生错义突变(p.R1041C),其健康父母为相应突变的杂合携带者,200例健康对照未见该突变。结论 SPINK5基因的p.R371X及p.R1041C复合杂合突变可能是引起该患者临床表现的病因之一。
Netherton综合征;基因,SPINK5;突变
Netherton综合征(Netherton syndrome,NS,OMIM 256500)由Netherton于1958年首先命名,是一种严重的常染色体隐性遗传性皮肤病,发病无性别及种族差异[1]。NS的临床特征包括,迂回状鱼鳞病、套叠性脆发征(竹节状发)及特应性体质[2]。NS的致病基因为编码Kazal型丝氨酸蛋白酶抑制因子(LEKTI)的SPINK5基因,该基因编码的蛋白LEKTI作为一系列生物学通路的调节因子参与皮肤表皮分化、皮肤渗透屏障功能、炎症及变态反应[3]。我们在临床上收集到1例Netherton综合征患者,检测其SPINK5基因的突变情况。
资料与方法
一、病历资料
患者男,24岁。出生40余天,颈、胸、腹部皮肤出现弥漫性红斑、水疱,伴有瘙痒、少汗。水疱干燥后边缘出现白色鳞屑。每年夏季加重,冬季好转。随年龄增长水疱减轻,但全身红斑脱屑逐渐加重,伴反复的皮肤潮红、剧烈瘙痒及少汗,且10个趾甲有逐渐增厚倾向,指甲无受累。患者自幼头发和眉毛粗糙、干枯、易断。曾在当地医院就诊数次,涂抹外用药(名称不详)后症状无明显改善。患者对海虾和螃蟹过敏,否认哮喘或者过敏性鼻炎病史。否认父母近亲结婚,家族中无类似疾病史(图1)。体检:颈、胸、腹、四肢、手足部位皮肤可见弥漫性、不规则形红斑,周边覆有白色圈领状脱屑;10个趾甲不规则增厚;头发略稀少,眉毛外侧明显稀疏,伴毛发粗糙、干燥(图2~5)。
二、方法
1.DNA的提取:取患者、患者父母和姐姐以及200例健康人(受试者来源于北京大学第一医院皮肤科遗传组DNA标本数据库,所有标本均来自于健康人群,并且已签署知情同意书)。外周血5 ml,2%乙二胺四乙酸抗凝,以低渗溶血以及酚-氯仿抽提法提取DNA。
2.PCR引物设计:根据SPINK5基因序列(来源于网站www.ensembl.org/index.html),利用Primer 3在线版(http://bioinfo.ut.ee/primer3-0.4.0)设计32对特异性引物扩增患者SPINK5基因编码区33个外显子及其侧翼序列,引物由北京天一辉远生物科技有限公司合成。
3.PCR反应体系及条件:PCR反应体系25μl,含基因组 DNA50ng,dNTP0.4mmol/L,MgCl22.0mmol/L,上下游引物各10 μmol/L,Taq DNA聚合酶2.5 U。反应条件:95℃预变性5 min后进行以下10个循环:94℃变性30 s,62℃退火30 s(每个循环后退火温度降低0.5℃),72℃延伸45 s;接着进行35个循环:94℃变性 30 s,57℃退火 30 s,72℃延伸 45 s,共45个循环,最后72℃延伸9 min,DNA扩增在Eppendorf Mastercycler Gradient PCR扩增仪(德国艾本德股份公司)上进行。1%琼脂糖凝胶电泳检测扩增产物。所有PCR产物纯化后送至北京天一辉远生物科技有限公司测序。
结 果
以患者的基因组DNA为模板,所有32对引物在各自的条件下分别扩增出各自的产物,包括所有外显子的编码序列以及两端至少60bp的侧翼序列。所有扩增产物纯化后测序结果与Ensembl网站所公布的序列进行对照,发现患者SPINK5基因13号外显子中的第1111位核苷酸(从cDNA编码起始位点ATG算起)发生C→T杂合突变(c.1111C>T),导致其编码第371位氨基酸发生无义突变(p.R371X),突变来自于父亲。第32号外显子中的第3121位核苷酸发生C→T杂合突变(c.3121C>T),导致其编码第1041位氨基酸发生错义突变(p.R1041C),突变来自于母亲,姐姐为c.3121C>T突变携带者(图6,7)所有突变均由反向测序得到验证。200例健康人中未发现这两种突变。光镜下毛发呈“竹节样”改变,在竹节处有套叠(图5)。真菌镜检趾甲示真菌阳性。
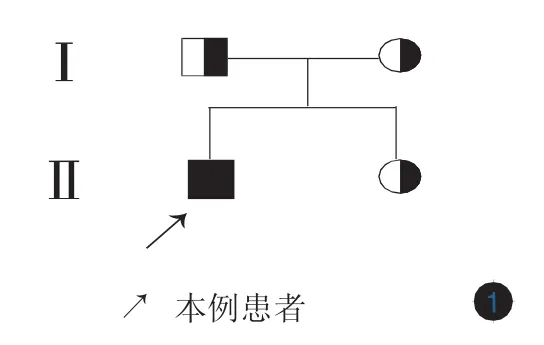
图1 患者家系图
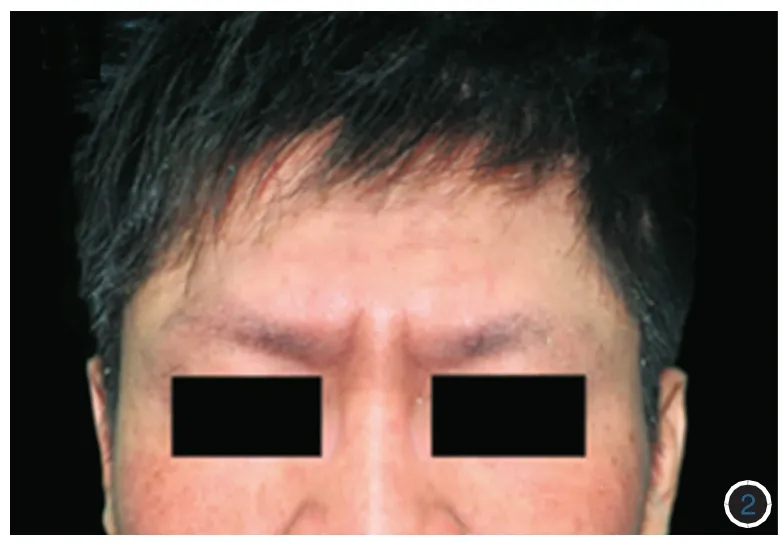
图2 患者头发粗糙,不易梳理,眉毛稀疏,部分脱落

图3 小腿内侧皮肤呈现典型的双边状脱屑

图4 手指背侧皮肤出现大小不同、形状不规则的红斑,周边覆有白色圈状脱屑

图5 光镜下头发呈“竹节样”改变
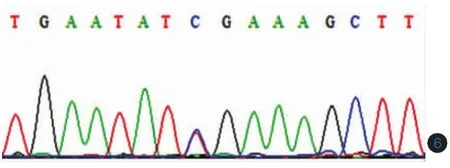
图6 Netherton综合征患者SPINK5基因测序结果 患者第13号外显子发生c.1111C>T杂合突变(突变来自于父亲)
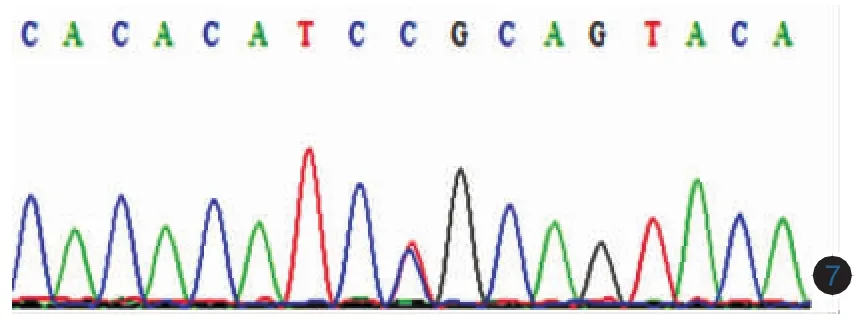
图7 第32号第32号外显子发生c.3121C>T杂合突变(突变来自于母亲)
讨 论
NS出生时一般表现为典型的先天性红皮病,较重病例可表现为典型的迂回状鱼鳞病。患者头发稀少、生长缓慢、细而尖且易断,常于1岁后光镜下表现为特征性的套叠性脆发征或竹节状头发。成年后病变范围可局限化,但波动较大,可出现湿疹样皮损,伴瘙痒,腘窝、肘窝出现苔藓样变。
NS的致病基因SPINK5基因包含33个外显子,编码的LEKTI蛋白分布于所有的复层上皮和Hassal胸腺小体内[4-6]。LEKTI含有 15 个 Kazal型丝氨酸蛋白酶抑制结构域(D1-D15)[4],可以抑制Kazal型丝氨酸蛋白酶,或参与体内蛋白水解级联反应,被水解为小片段后行使其抑制功能。NS患者表皮内颗粒层和毛囊内根鞘的LEKTI表达水平下降,表皮内LEKTI的减少可导致缓激肽释放酶5(KLK5)活性增强[7]。KLK5 可以通过 PAR-2 依赖性和PAR-2非依赖性途径引发皮肤炎症和过敏反应。KLK5活性增强在PAR-2依赖性途径中可通过激活NF-κB信号通路,导致IgE增加,引发过敏反应,也可直接导致肿瘤坏死因子α、IL-8、I-CAM1等产生,可促进皮肤炎症并加剧皮肤损伤。在PAR-2非依赖性途径中,KLK5活性增强可促进 KLK7、KLK14及表皮蛋白酶ELA2的活性,这些蛋白酶在角质层脱落、表皮分化、中间丝相关蛋白加工及脂质代谢过程中起着作用[8],其异常活动影响皮肤内环境稳定,导致皮肤屏障功能受损,引发临床表现。
迄今为止,文献已报道70余种SPINK5基因的不同突变,大部分为小片段替换、插入或缺失而导致的无义突变或移码突变[7]。NS患者中大部分的无义突变导致终止密码子的提前出现,介导其mRNA降解,使LEKTI蛋白完全无法表达。此外,也有学者报道一些剪切位点发生突变,而仍有部分LEKTI可以表达,则出现较轻的临床表型[9-11]。本例患者SPINK5基因的突变为第13号外显子中的第1111位碱基发生C→T杂合突变(c.1111C>T),使其编码第371位氨基酸发生无义突变(p.R371X),故可导致其编码的LEKTI蛋白不能表达。第32号外显子中的第3121位碱基发生C→T杂合突变(c.3121C>T),使其编码第1041位氨基酸发生错义突变(p.R1041C),可导致LEKTI蛋白功能减低。该患者SPINK5基因的复合杂合突变可导致其编码的LEKTI蛋白不能表达或功能减低,引起KLK5活性增强,从而引发皮炎和过敏反应,出现一系列临床表现。p.R371X的突变位点已被国外文献报道[12],而p.R1041C属新发突变。目前,对于NS尚缺乏治疗方法,治疗手段主要以营养支持治疗和对症治疗为主,以预防脱水、生长迟缓及严重并发症的出现。有文献报道,少数严重NS患者注射免疫球蛋白和抗肿瘤坏死因子α单克隆抗体治疗取得了明显的疗效[13-14],但疗效尚待进一步评价。
[1]Pruszkowski A,Bodemer C,Fraitag S,et al.Neonatal and infantile erythrodermas:a retrospective study of 51 patients [J].Arch Dermatol,2000,136(7):875-880.
[2]石得仁,甘恒芳,红霞.Netherton综合征一例报告[J].中华皮肤科杂志,1982,15(4):251-252.
[3]Ovaere P,Lippens S,Vandenabeele P,et al.The emerging roles of serine protease cascades in the epidermis[J].Trends Biochem Sci,2009,34(9):453-463.
[4]Mägert HJ,Ständker L,Kreutzmann P,et al.LEKTI,a novel 15-domain type of human serine proteinase inhibitor[J].J Biol Chem,1999,274(31):21499-21502.
[5]Chavanas S,Bodemer C,Rochat A,et al.Mutations in SPINK5,encoding a serine protease inhibitor,cause Netherton syndrome[J].Nat Genet,2000,25(2):141-142.
[6]Bitoun E,Micheloni A,Lamant L,et al.LEKTI proteolytic processing in human primary keratinocytes,tissue distribution and defective expression in Netherton syndrome[J].Hum Mol Genet,2003,12(19):2417-2430.
[7]Hovnanian A.Netherton syndrome:skin inflammation and allergy by loss of protease inhibition [J].Cell Tissue Res,2013,351(2):289-300.
[8]Fortugno P,Bresciani A,Paolini C,et al.Proteolytic activation cascade of the Netherton syndrome-defective protein,LEKTI,in the epidermis:implications for skin homeostasis[J].J Invest Dermatol,2011,131(11):2223-2232.
[9]DescarguesP,DeraisonC,ProstC,etal.Corneodesmosomalcadherins are preferentialtargets ofstratum corneum trypsin- and chymotrypsin-like hyperactivity in Netherton syndrome[J].J Invest Dermatol,2006,126(7):1622-1632.
[10]Hachem JP,Wagberg F,Schmuth M,et al.Serine protease activity and residual LEKTI expression determine phenotype in Netherton syndrome[J].J Invest Dermatol,2006,126(7):1609-1621.
[11]Komatsu N,Saijoh K,Jayakumar A,et al.Correlation between SPINK5 gene mutations and clinical manifestations in Netherton syndrome patients[J].J Invest Dermatol,2008,128(5):1148-1159.
[12]Bitoun E,Chavanas S,Irvine AD,et al.Netherton syndrome:disease expression and spectrum of SPINK5 mutations in 21 families[J].J Invest Dermatol,2002,118(2):352-361.
[13]Renner ED,Hartl D,Rylaarsdam S,et al.Comèl-Netherton syndrome defined as primary immunodeficiency[J].J Allergy Clin Immunol,2009,124(3):536-543.
[14]Fontao L,Laffitte E,Briot A,et al.Infliximab infusions for Netherton syndrome:sustained clinical improvement correlates with a reduction of thymic stromal lymphopoietin levels in the skin[J].J Invest Dermatol,2011,131(9):1947-1950.
Mutation analysis of the SPINK5 gene in a patient with Netherton syndrome
Xu Guiwen*,Yin Jinghua,Wang Huijun,Zhou Yun,Zhang Jie,Chen Guanzhi,Lin Zhimiao,Yang Yong,Tang Zhanli.*Department of Dermatology,Peking University First Hospital,Beijing 100034,China
ObjectiveTo detect mutations in the SPINK5 gene in a patient with Netherton syndrome.MethodsClinical data were collected from a male patient with Netherton syndrome.Peripheral blood samples were obtained from the patient,his relatives and 200 healthy human controls.DNA was extracted from these samples,and PCR was performed to amplify all the exons and their flanking sequences in the coding region of the SPINK5 gene followed by DNA sequencing.ResultsDirect sequencing revealed a heterozygous nonsense mutation(c.1111C > T)in exon 13 of the SPINK5 gene,which leads to the formation of a premature termination codon at amino acid position 371(p.R371X),as well as a heterozygous mutation (c.3121C > T)in exon 32 of the SPINK5 gene,which leads to a missense mutation at amino acid position 1041 (p.R1041C),in the patient.His healthy parents were heterozygous carriers of the two mutations,whereas neither of the two mutations was found in the unrelated healthy controls.ConclusionThe composite heterozygous mutations p.R371X and p.R1041C in the SPINK5 gene may be partially responsible for the clinical manifestation of Netherton syndrome in this patient.
Netherton syndrome;Genes SPINK5;Mutation
Tang Zhanli,Email:tzldyx2012@163.com
10.3760/cma.j.issn.0412-4030.2015.02.008
山东省自然科学基金(ZR2013HM015);青岛市科技发展计划(13-1-4-146-jch)
100034北京大学第一医院皮肤科(许桂文、尹菁华、汪慧君、林志淼、杨勇);山东大学齐鲁医院皮肤科(张洁、汤占利);南昌大学第一附属医院皮肤科(周云);青岛大学附属医院皮肤科(陈官芝)
汤占利,Email:tzldyx2012@163.com
2014-05-21)
(本文编辑:吴晓初)

