早期斑秃皮损处炎症细胞因子及凋亡因子的异常表达
蔡泽明 赵莹 张斌 巩毓刚 西兰 杨建 章星琪
·研究报道·
早期斑秃皮损处炎症细胞因子及凋亡因子的异常表达
蔡泽明 赵莹 张斌 巩毓刚 西兰 杨建 章星琪
目的 探讨早期斑秃皮损浅层、深层及斑秃生长期毛囊凋亡因子及炎症细胞因子的表达。方法收集25例早期斑秃皮损及15例正常头皮病理取材组织标本,通过荧光定量PCR检测标本中凋亡基因p53、caspase3、Fas和生存素、bcl-2 以及炎症细胞因子白细胞介素(IL)-4、IL-10、干扰素 γ(IFN-γ)、IL-12 mRNA 表达水平,免疫组化检测皮损中生长期毛囊P53的蛋白质表达。结果 斑秃生长期毛囊促凋亡因子caspase3、P53、Fas mRNA表达水平较对照组升高,变化倍数分别为6.78、8.01、9.74,差异有统计学意义(均P<0.05)。抑制凋亡因子bcl-2、生存素mRNA较正常降低,变化倍数分别为0.08、0.03(均P<0.01),炎症细胞因子无改变。斑秃浅层Th1因子IFN-γ、IL-12 mRNA较正常水平升高,变化倍数分别为2.75、85.67(P值分别<0.05、0.01)。Th2因子IL-10表达水平降低,变化倍数为0.002(P<0.01)。而且,斑秃皮损浅层IL-10及IL-12 mRNA改变幅度高于深层(P值分别<0.01、0.05)。免疫组化显示斑秃皮损生长期毛囊每100个细胞中p53阳性细胞数较对照组升高(t=23.79,P<0.01)。结论 斑秃生长期毛囊凋亡因子升高,抑制凋亡因子表达下降提示凋亡因子在斑秃发病中起一定作用。
斑秃;细胞因子类;凋亡诱导因子;肿瘤抑制蛋白质p53
斑秃发病过程中常伴有局部炎症反应,典型改变为生长期毛囊毛乳头周围蜂窝状淋巴细胞浸润,该处炎症细胞在斑秃发病中具体作用存在争议。我们对斑秃皮损进行病理检查发现,早期斑秃存在头皮浅层炎症,前期研究还发现具有此类改变的斑秃预后较好,均提示浅层炎症在斑秃发病中有一定作用[1-4]。探讨斑秃发病时所存在的浅深层炎症及Th1/Th2因子、细胞凋亡因子变化将有助于了解斑秃发病机制。我们检测早期斑秃皮损边缘头皮浅层、深层及分离的生长期毛囊炎症细胞因子及凋亡因子mRNA表达水平,并分析各部位细胞因子变化差异,进而探讨Th1/Th2因子变化及凋亡因子在斑秃发病中的作用。
一、资料
1.2010年8月至2011年3月,收集本院脱发专科早期[3]斑片型斑秃患者25例,其中男13例,女12例,年龄20~47岁,平均27.13岁,平均病程1.78个月。25例患者中1例有斑秃家族史,1例有特应性皮炎病史。正常对照组男8例,女7例,年龄16~49岁,平均29.4岁,与斑秃组在性别及年龄上差异无统计学意义。所有患者近1个月内未系统或局部使用糖皮质激素或免疫抑制剂,15例对照来自本院外科头皮手术如皮肤良性肿瘤或色素痣切除边缘头皮组织正常头皮。本研究通过中山大学附属第一医院伦理委员会批准,患者均签署知情同意书。
2.试剂与仪器:RNA试剂盒产自美国Qiagen公司,S1000 thermal cyclerPCR仪产自美国伯乐BIO-RAD公司,Takara反转录试剂盒产自宝生物工程(大连)有限公司。
二、方法
1.取材:斑秃皮损边缘约1 cm处行组织病理检查,切取约10 mm×8 mm皮肤组织,分为两份。一份用4%甲醛固定,石蜡包埋,切片后行免疫组化染色;另一份标本在皮脂腺水平离断,分为头皮浅层、头皮深层并置入RNA保存液中。部分标本行毛囊分离,头皮深层刀片沿毛囊生长方向切成3 mm×6 mm小份,在解剖显微镜下眼科镊夹住外毛根鞘将毛囊从皮下脂肪组织中拉出,将分离后的毛囊置入RNA保存液中,-20 ℃保存[3]。
2.p53免疫组化染色:常规制备。以磷酸盐缓冲液(PBS)代替p53单抗作阴性对照。在×400光镜下,随机选取5个生长期毛囊中部水平的视野,计数每个视野100个有核细胞中阳性细胞数。
3.荧光定量PCR检测皮损炎症细胞因子及凋亡因子mRNA表达水平:
(1)引物设计:参照基因序列软件由宝生物工程(大连)有限公司合成引物如下:β肌动蛋白,上游5′-CGACAACGG CTCCGGCATGTGC-3′,下游 5′-CGTCACCGGAGTCCATCAC GATGC-3′;白细胞介素(IL)-4,上游 5′-CTTCCCCCTCTGTT CTTCCT-3′,下游 5′-TTCCTGTCGAGCCGTTTCCAG-3′;IL-10,上游 5′-TGCTAACCGACTCCTTAATGCAGGAC-3′,下游 5′-CC TTGATTTCTGGGCCATGCTTCTC-3′;IL-12,上游 5′-TGGGTG GGTCAGGTTTGATG-3′,下游 5′-GCCCAGCTCTGAGGAGAG T-3′;caspase,上游 5′-GACTCTGGAATATCCCTGGACAAC-3′,下游 5′-CTGAGGTTTGCTGCA TCGACA-3′;bcl-2,上游 5′-A GGCACCCAGGGTGATGCAA-3′,下游 5′-GTGGAGGAGCTCTTC AGGGA-3′;p53,上游 5′-TCCA ATACAGCATGACTG-3′,下游5′-AGCCTCCAACATCCTTGAT TTCT-3′;Fas,上游 5′-TTGGT GGACCCGCTCAGTA-3′,下游5′-AATCTAGCAACAGACTAA GAACAAG-3′;生存素,上游5′-CCAAGTCTGGCTCGTTCTC AG-3′,下游 5′-CAGATTTGA ATCGCGGGACCC-3′。
(2)总RNA提取:根据试剂盒说明书提取头皮浅层、生长期毛囊以及头皮深层组织中总RNA,Thermo Nanodrop 2000测定RNA浓度,-80℃保存或立即合成为cDNA。
(3)cDNA的合成:使用S1000 thermal cyclerPCR仪合成cDNA,按照 Takara反转录试剂盒(DDR037A)20 μl反应体系行总RNA逆转录,反应体系如下:缓冲液4 μl,随机引物1 μl,反转录酶混合物 1 μl,寡 dT 引物 1 μl,总 RNA 300 ng加水至 20 μl。反应条件如下:37 ℃ 15 min,85 ℃ 15 s cDNA-20℃保存。
(4)荧光定量PCR反应:反应体系20 μl如下:SYBR染料 Taq TM 酶 10 μl,Rox 校正液 0.4 μl,双蒸水 7.8 μl,DNA模板1 μl(0.25 ng),上下游引物各0.4 μl(20 nmol/L)。反应条件:预变性 95℃ 1 min,95℃ 5 s、63℃ 1 min 40个循环,95℃1 min、65℃30 s 1个循环。基因表达倍数改变(fold change)计算公式为2-ΔΔCt,ΔCt为样本待测目的基因的Ct值与内参照β肌动蛋白Ct差值的均数,ΔΔCt为样本目的基因ΔCt与正常对照ΔCt的差值,以2-ΔΔCt作为基因的相对表达水平。
4.统计学方法:采用SPSS 13.0软件包进行统计分析。荧光定量PCR计量资料先用Shapiro-Wilk法检验正态性,两个均数的比较采用独立样本t检验,多个均数及两两比较分别采用单因素方差分析(One-way ANOVA)及LSD-t检验免疫组化结果采用独立样本t检验,P<0.05为差异有统计学意义。
三、结果
1.斑秃皮损边缘浅层、深层及生长期毛囊炎症细胞因子及凋亡因子mRNA表达:斑秃皮损边缘分离的生长期毛囊促凋亡基因如caspase3、p53、Fas mRNA表达水平均较正常对照组升高(t=2.41、2.27、2.73,均P< 0.05),抑制凋亡因子如bcl-2、生存素mRNA表达水平显著降低(t=6.76 6.87,均P<0.01)。斑秃皮损中生长期毛囊炎症细胞因子IFN-γ、IL-12、IL-10及IL-4mRNA表达水平与正常毛囊差异均无统计学意义。见表1,2。
斑秃皮损边缘浅层IFN-γ、IL-12较正常对照头皮浅层升高(t值分别为 2.59、10.51,P值分别 < 0.05,0.01),IL-10降低(t=9.42,P< 0.01)。凋亡因子如 caspase3、p53、Fas mRNA表达水平在斑秃皮损浅层和正常头皮之间差异无统计学意义。斑秃皮损边缘深层IL-12 mRNA表达水平较正常对照头皮深层显著升高(t=3.28,P < 0.05),IL-4、IFN-γ、IL-10表达水平差异无统计学意义。斑秃皮损深层各凋亡因子表达水平与正常对照之间差异无统计学意义。见表1,2。

表1 斑秃皮损边缘及浅层、深层生长期毛囊各炎症细胞因子表达水平(2-ΔΔCt)

表2 斑秃生长期毛囊、浅层、深层凋亡因子表达水平(2-ΔΔCt)
斑秃皮损浅层IL-12、IL-10变化幅度高于皮损深层,差异均有统计学意义(F=6.36、35.16,P 值分别 < 0.05、0.01)。斑秃浅深层 IFN-γ、IL-4、p53、Fas凋亡受体、bcl-2、生存素等因子变化幅度比较差异无统计学意义。
2.生长期毛囊p53表达情况:免疫组化染色中p53为核内着色,在正常对照的表皮基底层、毛囊内外毛根鞘、皮脂腺、小汗腺以及皮下脂肪细胞均可见p53染色阳性的细胞,其中以毛囊周期性部分的外毛根鞘细胞p53表达程度较强,阳性率较高(图1A)。早期斑秃皮损边缘的生长期毛囊p53阳性细胞数目和阳性率显著高于正常对照,正常对照生长期毛囊细胞中p53阳性细胞数为47.65±5.27,斑秃生长期毛囊细胞 p53阳性细胞数为 89.58±5.32(t=23.79,P <0.01),见图1。
四、讨论
目前研究多认为斑秃发病是在具有遗传易感性基础上,在环境、神经内分泌、免疫等多因素影响下的,由T细胞介导以Th1型反应为特征、针对生长期毛囊的器官特异性自身免疫性疾病[5]。免疫豁免丧失是斑秃发病的重要机制之一,正常生长期毛囊局部主要组织相容性复合体Ⅰ、Ⅱ类分子(MHC-Ⅰ、Ⅱ)、细胞间黏附因子1(ICAM-1)低表达而处于免疫豁免,斑秃发病时上述因子表达升高致免疫豁免丧失,毛囊抗原被自身T淋巴细胞识别而发生免疫应答[5-7]。
研究中,我们发现早期斑秃皮损边缘生长期毛囊仅出现凋亡因子水平上升而趋向凋亡,毛囊自身并不出现可改变周期的炎症细胞因子变化,提示斑秃毛囊的凋亡更可能源于皮损中细胞因子的变化,而不是自身周期的体现。斑秃皮损浅层Th1类细胞因子如IL-12、IFN-γmRNA表达水平显著升高,Th2类细胞因子IL-10表达水平显著降低,该结果与既往研究一致,即Th1占优势的Th1/Th2是斑秃重要发病机制。我们还发现斑秃皮损浅层的Th1类细胞因子IFN-γ升高幅度、Th2类因子IL-10降低幅度均大于深层,细胞因子在皮肤内分布一般由高浓度区向低浓度区弥散,提示引起斑秃的Th1/Th2因子失衡的源头可能存在于浅层,即浅层的炎症重要性可能大于深层,深层毛乳头附近的炎症可能为继发性或反应性的。我们前期研究也发现早期斑秃头皮浅层血管周围有炎症浸润以及浅层毛囊外毛根鞘的外层细胞液化变性[1]。另有报道斑秃皮损毛乳头附近出现含有异物巨细胞的肉芽肿,支持该处的炎症可能是针对毛囊细胞死亡释放产物的Th1型肉芽肿反应[8]。我们曾在急性进展期弥漫性斑秃患者中发现毛乳头附近出现异物巨细胞,估计可能是局部区域内全体毛囊细胞快速凋亡并释放大量细胞产物所致[9-10]。上述过程临床上表现为斑秃生长期毛囊急速广泛退行性变,导致皮损深层毛乳头附近出现继发性炎症,以清除大量出现的退行凋亡毛囊细胞及其分解产物。至于斑秃的发病,我们曾发现斑秃患者的表皮聚丝蛋白表达水平下降,以及斑秃小鼠的垂体-肾上腺系统反应异常,均可作为斑秃的诱发因素[11-12]。
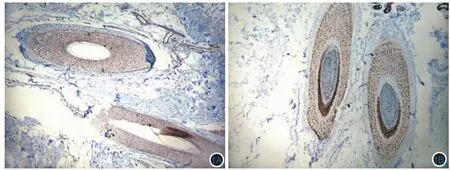
图1 免疫组化检测生长期毛囊p53表达(DAB×100) 1A:正常对照头皮;1B:斑秃皮损
我们推测斑秃可能的发病机制如下:在一定遗传因素下,各种原因如皮肤屏障缺陷或神经因素所致的浅层炎症触发Th1类因子升高和(或)Th2类因子降低,浅层毛囊属于永久毛囊,含有干细胞以及可能对毛囊周期的变化起决定性作用的成分,引起局部区域内毛囊发生退行性变。浅层的细胞因子通过弥散作用逐渐致深层Th1类因子升高、Th2类因子降低,从而诱导深层附近毛囊MHC-Ⅰ、MHC-Ⅱ类分子和ICAM-1表达升高,导致毛囊免疫赦免丧失,局部自身抗原暴露,被抗原提呈细胞提呈,加之细胞凋亡后释放的细胞产物,引起毛囊周围继发性CD4+及CD8+T淋巴细胞浸润及活化,后者进一步分泌释放各种细胞因子,趋化单核巨噬细胞,吞噬死亡细胞产物,引起免疫反应级联扩大,导致斑秃皮损进一步扩大。
[1]蔡泽明,赵莹,杨建,等.斑秃患者189例的疗效与临床和病理的相关关系[J].中国皮肤性病学杂志,2011,25(7):538-541.
[2]张小婷,赵莹,张斌,等.斑秃皮损的炎症浸润和毛囊周期改变特征[J].广东医学,2013,34(6):867-871.
[3]Brzezińska-Wcisło L,Bergler-Czop B,Wcisło-Dziadecka D,et al.New aspects of the treatment of alopecia areata [J].Postepy Dermatol Alergol,2014,31(4):262-265.
[4]Roosen GF,Westgate GE,Philpott M,et al.Temporary hair removal by low fluence photoepilation:histological study on biopsies and cultured human hair follicles[J].Lasers Surg Med,2008,40(8):520-528.
[5]章星琪.斑秃发病机制研究和治疗的新理念[J].皮肤性病诊疗学杂志,2010,17(5):328-331,339.
[6]章星琪.斑秃临床诊治及发病机制研究新进展(上)[J].中国临床医生杂志,2009,37(10):9-12.
[7]章星琪.斑秃临床诊治及发病机制研究新进展(下)[J].中国临床医生杂志,2009,37(11):8-11.
[8]Paniz Mondolfi AE,Cressey BD,Ahmad A,et al.Granulomatous alopecia:a variant of alopecia areata?[J].J Cutan Pathol,2013,40(4):357-360.
[9]赵莹,张斌,杨建,等.弥漫性斑秃11例临床及组织病理研究[J].临床皮肤科杂志,2011,40(2):67-69.
[10]Zhao Y,Zhang B,Caulloo S,et al.Diffuse alopecia areata is associated with intense inflammatory infiltration and CD8+T cells in hair loss regions and an increase in serum IgE level[J].Indian J Dermatol Venereol Leprol,2012,78(6):709-714.
[11]张小婷,李水凤,赵莹,等.斑秃皮损内朗格汉斯细胞及CD8+T细胞的数量及分布分析[J].中华皮肤科杂志,2014,47(1):33-37.
[12]西兰,张小婷,赵莹,等.斑秃患者皮损丝聚蛋白的表达[J].中华皮肤科杂志,2012,45(6):411-414.
Abnormal expressions of inflammatory cytokines and apoptosis-related factors in lesions of early alopecia areata
Cai Zeming*,Zhao Ying,Zhang Bin,Gong Yugang,Xi Lan,Yang Jian,Zhang Xingqi.*Department of Dermatology,Third Affiliated Hospital of Nanchang University,Nanchang 332000,China
ObjectiveTo detect the expressions of apoptosis-related factors and inflammatory cytokines in superficial and deep layers of as well as anagen hair follicles in lesions of early alopecia areata (AA).MethodsScalp biopsy samples were collected from 25 patients with early AA and 15 healthy human controls.Fluorescence-based quantitative PCR was performed to detect mRNA expressions of apoptosis-related genes p53,caspase 3,Fas,survivin and bcl-2,as well as those of inflammatory cytokines interleukin (IL)-4,IL-10,IL-12 and interferon (IFN)-γ.An immunohistochemical assay was conducted to measure the expression of p53 protein in anagen hair follicles.ResultsCompared with control skin samples,anagen hair follicles in AA lesions showed significantly increased mRNA expression levels(expressed as 2-ΔΔCt)of pro-apoptotic factors caspase 3,p53 and Fas(6.78,8.01,9.74,respectively,all P < 0.05),but decreased mRNA expression levels of antiapoptotic factors bcl-2 and survivin (0.08 and 0.03 respectively,bothP < 0.01),and similar mRNA expression levels of inflammatory cytokines.There was a significant increase in mRNA expression levels of Th1 cytokines IFN-γ and IL-12(2.75 vs.1.00,P<0.05;85.67 vs.1.00,P<0.01),but a significant decrease in the expression level of the Th2 cytokine IL-10 (0.002 vs.1.000,P < 0.01)in superficial layers of AA lesions compared with those of normal control skin.The degree of changes in mRNA expression levels of IL-10 and IL-12 was significantly higher in superficial layers than in deep layers of AA lesions (P<0.01 and 0.05 respectively).The immunohistochemical assay showed that the number of p53-positive cells per 100 cells in anagen hair follicles of AA lesions was higher than that in those of control skin (t=23.79,P<0.01).Conclusions Anagen hair follicles in AA lesions exhibit high expressions of pro-apoptosis factors,but low expressions of antiapoptotic factors,suggesting that apoptotic factors play a role in the occurrence of AA.
Alopecia areata;Cytokines;Apoptosis-inducing factor;Tumor suppressor protein p53
Zhang Xingqi,Email:xingqi.zhang@aliyun.com
10.3760/cma.j.issn.0412-4030.2015.02.017
332000南昌大学第三附属医院皮肤科(蔡泽明);山东菏泽市立医院皮肤科(赵莹);中山大学附属第一医院皮肤科(张斌、巩毓刚、西兰、杨建、章星琪)
章星琪,Email:xingqi.zhang@aliyun.com
2014-03-09)
(本文编辑:尚淑贤)

