Clock基因对精子顶体酶的影响*
梁 鑫 成姝婷 王正荣** 何 煊 单旭东
1.成都中医药大学第二附属医院(成都 610041); 2.四川大学基础医学与法医学院
·论 著·
Clock基因对精子顶体酶的影响*
梁 鑫1成姝婷2王正荣2**何 煊2单旭东1
1.成都中医药大学第二附属医院(成都 610041); 2.四川大学基础医学与法医学院
目的 研究雄鼠睾丸Clock基因沉默后,小鼠精子顶体酶的活性及功能。方法 在ICR小鼠睾丸内注射Clock干扰质粒干扰雄性小鼠睾丸节律基因Clock 的表达,研究:(1)进行体外受精,观察精子驱散卵丘颗粒细胞情况及受精率等;(2)检测精子顶体内顶体蛋白酶、透明质酸酶活性及芳香基硫酸酯酶A(ASA)的含量。(3)将精子注射入卵母细胞,观察受精卵及胚胎发育情况。结果 睾丸Clock 基因沉默后,精子驱散卵丘颗粒细胞时间延长,受精率下降;精子顶体蛋白酶活性下降;透明质酸酶活性和ASA含量无明显变化;干扰组精子对卵母细胞及胚胎发育的影响小于未干扰组(P<0.05)。结论 干扰睾丸Clock 基因表达后,影响精子顶体蛋白酶活性,从而影响雄性小鼠的生殖功能。
Clock 基因; 顶体蛋白酶; 精子; 不育,男性
近日节律基因广泛存在于生物体内,调控着机体的生命活动。近来研究发现,近日节律的核心基因Clock与雄性的生殖密切相关。ClockΔ19/Δ19突变的雄性小鼠体内和体外实验都提示生殖力下降[1];干扰睾丸Clock 基因的表达引起小鼠胎仔数下降[2]。研究显示,CLOCK蛋白限制性地表达在精子生成过程中圆形精子的顶体[3],而精子顶体(特别是顶体内水解酶)在受精过程中发挥重要作用。因此,本研究利用RNA干扰(RNAi)技术,限制性干扰小鼠睾丸Clock基因的表达,探讨Clock基因对小鼠生殖功能影响的机制。
材料与方法
一、实验材料
(一)实验动物分组与处理
ICR小鼠,雄性8~10周龄,雌性4~6周龄,购自四川省成都达硕实验动物有限公司。使用标准小鼠笼具分笼饲养于光暗循环箱内(光:暗=12h:12h),自由进食和饮水,保持室温为(24±1)℃。以随机分组原则将小鼠分为两组:(1)干扰组,注射Clock干扰质粒于睾丸内;(2)阴性对照组,注射武汉晶赛公司提供的通用阴性HK质粒于睾丸内。
(二) 实验试剂与仪器
主要试剂和材料:Clock干扰质粒和阴性质粒,质粒提取试剂盒购于OMEGA公司;孕马血清促性腺激素(PMSG)和绒毛膜促性腺激素(HCG)购自宁波市第二激素厂;各类培养皿及试管等购于美国BD公司;巴斯德吸管购自美国SIGMA公司;Quinn's系列培养液购自美国SAGE公司;动物体内转染试剂In vivo-jetPEITM 为Poly Plus公司产品;蛋白酶抑制剂、N-乙酰葡糖胺、透明质酸为Sigma公司产品;芳基硫酸酯酶A(ASA)ELISA 检测试剂盒购自Unionhonest公司。
主要设备:英国Glaxcy二氧化碳培养箱,Nikon倒置显微镜,Nikon体视显微镜,超净工作台, GTL-16AL高速台式离心机(南京大学生物技术开发公司),722分光光度计和酶标仪等。
二、实验方法
(一)质粒注射
用质粒提取试剂盒提取质粒。雄性小鼠乙醚麻醉后,将小鼠腹腔内两侧睾丸推入已经松弛的阴囊,固定后,用微量注射器分别将干扰质粒和阴性质粒溶液20μL注射入干扰组和对照组小鼠的双侧睾丸。由于干扰质粒的干扰效率在注射后的第三天达到高峰,同时小鼠的生精周期显示,干扰效率达到高峰的精子从圆形精子到成熟精子需要15d,因此我们选择在注射干扰质粒的18d,手术法收集雄鼠精子。
(二) 体外受精
1. 雌鼠处理及卵母细胞获得:腹腔注射雌鼠PMSG 10IU/只,间隔48h后,腹腔注射同批雌鼠HCG 10IU/只。注射HCG 15~16h后,颈脱臼法处死小鼠。仰卧小鼠,用酒精棉消毒鼠腹部,用剪刀在腹部剪开一小口后撕开皮肤,用剪刀剪开腹膜,更换剪刀和镊子,找到子宫和输卵管,在输卵管和子宫交汇处剪断输卵管,将输卵管放入装有HEPES-HTF的培养皿中,同样的方法处理小鼠的另一侧。在解剖镜下,用1mL注射器针头撕开膨大的输卵管壶腹部,释放卵丘-卵母细胞复合体(OCCC),将OCCC移入含HTF的皿中冲洗后,移入预先已准备好的卵培养皿中,设立干扰组和对照组,卵培养皿于37℃、5% CO2培养箱中孵育。
2. 精子收集:注射质粒后18d,颈脱臼法处死雄鼠,仰卧小鼠,用酒精棉消毒小鼠腹部,用剪刀在腹部剪开一小口后撕开皮肤,用剪刀剪开腹膜,更换剪刀和镊子,找到睾丸和附睾后,立即摘出附睾于准备好的培养液中,在培养液中洗一次,移入预平衡的培养液HTF(0.5~1mL,3037皿)中。用眼科剪将附睾剪成4~6块,轻轻挤压,将精液挤出,于37℃、5% CO2培养箱中孵育20~30min,使精子自由浮出。将初步孵育、分散好的精子悬液取出于离心管中,300×g,离心5min。吸出上清液,将底部沉淀加入0.5~1mL培养液底部,上游45min,吸出上清液,置培养箱中孵育约1h。
3. 体外受精及胚胎发育观察:将孵育好的精子加入卵培养皿中,精子浓度1×106/mL。每隔3~5min,观察干扰组和对照组精子脱颗粒细胞情况,直到卵丘颗粒细胞完全被驱散为止。精卵共孵育6h后,将受精卵洗数次,转入已准备好的生长皿中继续培养。第1天(受精当天为0天),于受精后24h观察干扰组和对照组卵裂情况,计算受精率。受精率=卵裂胚数/卵丘-卵母细胞复合体数×100%。将分裂的胚胎置新卵裂液中继续培养,观察生长情况。第3天更换新的囊胚培养液,进行胚胎观察后,继续培养至第4天~第6天。分别记录干扰组和对照组到达囊胚期的胚胎数和孵化胚胎数,计算囊胚生成率和胚胎孵化率。囊胚形成率=囊胚数/卵裂胚数×100%,胚胎孵化率=孵出胚胎数/囊胚总数×100%。
(三)顶体内酶的检测
1. 顶体酶活性检测:特异性顶体酶活性的检测采用Kennedy等[4]的方法。各取干扰组和对照组精子悬液约200~500μL,用2% formalin 100μL固定15 min后加入反应液到测定管(T)、对照管(C)两管;然后加入终止液到T、C两管,T、C管再同时在24℃水中孵育至少1h;最后加入100μL终止液到T管,1 500×g,离心10min。双蒸水调零后,用分光光度计(410nm波长、0.5cm比色杯)分别测定T、C两管的OD值。顶体酶活性(μIU/106)= [(mean ODtest) -ODcontrol] ×106/1 485×精子计数。
2. 透明质酸酶活性检测:透明质酸酶活性采用Singer法测定[5]。精子悬液300×g,离心5min,调整精子浓度约108个/mL。取0.2mL精子悬液,加入1mL 0.15mol/L NaCl(1:5)稀释。取1mL稀释后悬液加入到0.1mL醋酸盐缓冲液和0.1mL透明质酸底物的混合物中,37℃恒温孵育24h后,100℃加热5min,进一步冰水浴冷却2~4min。再以500×g,离心5min后,取上清液,加入60μL的四硼酸钾,100℃水浴5min,冰水浴冷却2~4min。加入2mL的DMAB(二甲胺硼烷)混匀后,37℃水浴中孵育20min。将反应混合物以1 500×g,离心10min,取上清液。在30min之内测582nm处的吸光度。一个单位的透明质酸酶的定义是37℃时1h内产生1μmoL等量的N-乙酰葡糖胺(NAG)的释放量。
3. 芳香基硫酸酯酶A(ASA)含量的测定[6]:测定采用ELISA法。将精子悬浊液350×g,离心10min,弃上清液后加入细胞裂解液,调整精子浓度为20×106/mL。混匀后4℃孵育5min,4℃、10 000×g,离心10min,取上清液。按照ASA ELISA 检测试剂盒步骤测定样本的ASA 含量。
(四)卵胞浆内精子注射(ICSI)
1. 去除精子顶体:根据我院常规操作程序,采用密度梯度离心+上游法处理精液,即:先将正常组精子悬液于装有40%和80%PureCeptionTM梯度液的离心管中离心(300×g,15min)后,弃上清液,将沉淀于精子洗涤液和受精液中分别洗涤。最后将洗涤后的沉淀混匀,小心转入装有0.5~1mL受精液的5mL试管底部,置于37℃,5% CO2培养箱,倾斜45°,上游30min后收集高活力精子备用。经过此方法处理后的精子,几乎均为活动精子。吸取约100μL处理后的精子悬液于1.5 mL离心管中,直接投入液氮1min,然后在37℃水浴中解冻。通过这个冷冻解冻程序,大部分精子将失去顶体[7]。
2. ICSI过程及受精卵观察:将处理后的精子加入ICSI操作皿的PVP液滴或HEPES-HTF液滴中,在每个HEPES-HTF液滴加入一个卵子。将注射针转入含精子的液滴中,精子制动后,将精子以先尾后头方式吸入显微注射针内,对处于MII期的成熟卵进行显微注射。将注射后的卵子在已平衡的受精液洗涤皿中冲洗后,移入培养皿微滴中,放入37℃,5%CO2培养箱培养。于5~7h后观察有无第二极体及原核(PN),排出第二极体的卵认为是活化的卵。ICSI后30h观察受精卵发育是否出现异常。我们前期研究已显示,注射5个精子时,顶体完整组与去顶体组相比较,卵母细胞异常率和原核形成率差异较显著。因此,本实验设计注射5个精子,比较阴性质粒顶体完整组(C)、阴性质粒去顶体组(M),干扰质粒顶体完整组(T)之间是否存在差异。
(五)统计学处理
结 果
一、干扰小鼠睾丸Clock基因对精子体外受精过程及体外受精率和早期胚胎发育的影响
(一)干扰小鼠睾丸Clock基因对精子驱散卵丘颗粒细胞过程的影响
干扰组精子驱散卵丘颗粒细胞的时间延后于对照组(绝大部分卵丘颗粒细胞脱落时间延后2~10min不等,甚至更多时间),但随着精卵孵育时间的延长,干扰组卵母细胞的颗粒细胞最终也被完全驱散(图1)。
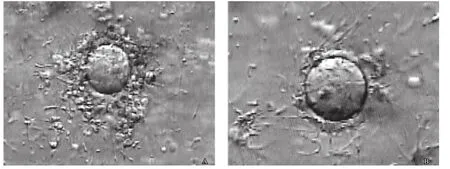
图1 精卵孵育相同时间两组精子驱散卵丘颗粒细胞的程度精卵孵育约5min后,干扰组(A)卵母细胞外围卵丘颗粒细胞没有完全脱落(×200),而对照组(B)已完全脱落(×200)
(二)干扰小鼠睾丸Clock基因对小鼠精子体外受精及早期胚胎发育的影响
表1显示,干扰组受精率和囊胚形成率下降,与对照组比较,差异具有统计学意义(P<0.01,P<0.05),但胚胎孵化率未受影响,两者相比较,差异无统计学意义。

表1 干扰小鼠睾丸Clock基因对小鼠精子体外受精及早期胚胎发育的影响
二、顶体内水解酶的检测
(一)干扰小鼠睾丸Clock基因对精子透明质酸酶和芳香基硫酸酯酶A的影响
由表2可见,两组透明质酸酶的活性和两组ASA含量比较,差异无统计学意义(P>0.05)。

表2 Clock干扰质粒对小鼠精子透明质酸酶和ASA的影响
(二)Clock干扰质粒对小鼠精子顶体发育的影响
由表3可见,干扰组和对照组的精子完整顶体百分率差异无统计学意义(P>0.05),而顶体蛋白酶活性干扰组明显低于对照组(P<0.01)。

表3 Clock干扰质粒对小鼠精子完整顶体百分率和顶体蛋白酶活性的影响
三、注射精子对卵母细胞及原核形成的影响
表4显示,当注射5个精子进入卵母细胞时,阴性质粒顶体完整组(C)、阴性质粒去顶体组(M)与干扰质粒顶体完整组(T)相比较,卵母细胞异常率和≥2PN率差异均具统计学意义(P<0.05)。
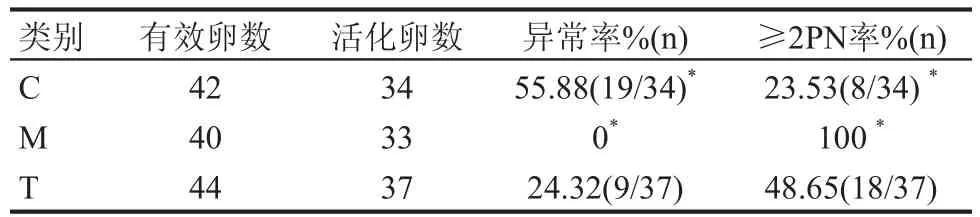
表4 注射精子对卵母细胞及原核形成的影响
讨 论
近日节律是生命活动的基本现象之一,它是由一系列近日节律基因及其表达产物构成,彼此相互作用,调节生物体自身的生理功能。研究发现,近日节律核心基因Clock与生殖功能存在一定的关系[8]。2006年Dolatshad等发现ClockΔ19/Δ19突变的雄性小鼠与野生型比较生殖力下降20.59%[1]。ClockΔ19/Δ19突变的雄性小鼠能引起雌鼠的胎仔数减少[9]。我们前期利用RNA干扰技术,干拢小鼠Clock基因表达发现:雌鼠的胎仔数明显下降。小鼠睾丸组织的免疫组化显示CLOCK蛋白限制性表达在精子生成过程中圆形精子的顶体,这种节律基因分离的表达模式造成睾丸缺乏近日节律。睾丸的主要功能是生成精子,精子的生成经历从精原细胞增殖分化形成精母细胞,最后形成精子的过程[10],在整个过程中具有精确的时间调节。但是CLOCK蛋白高表达在圆形精子的顶体,引起我们的关注。
顶体是膜结合的帽状结构,它覆盖于精子核表面,其功能在受精过程中起十分重要的作用。在圆形精子期,顶体囊泡逐渐融合,发育成形态完整的顶体[11]。当精卵结合时,顶体内的酶释放出来,以溶解卵丘、放射冠和透明带,帮助精子完成受精过程。到目前为止,我们知道CLOCK蛋白在细胞核内促进转录的功能,而CLOCK蛋白的核外表达,并且表达在受精过程中十分重要和关键的顶体部位,提示Clock可能具有一种结构上的非转录功能,值得我们作进一步探索。
受精过程是一个非常复杂的生物过程,中间任何一个环节出现问题都可能导致受精失败。顶体在受精过程中发挥至关重要的作用,精子顶体功能缺陷、没有顶体或顶体反应对精子活力及穿透卵母细胞都会产生极大影响[12,13]。Mahutte等对人常规体外受精周期未受精卵进行免疫荧光染色分析,发现56%~92%的未受精卵母细胞中找不到精子的染色质,提示精子透明带结合和穿透异常是体外受精失败的常见原因[14]。Esfahani等认为,顶体异常可导致体外受精的受精率显著下降[15],本实验研究发现,干扰组较对照组体外受精率明显降低(P<0.01),小鼠精子在受精过程中脱卵丘颗粒细胞的过程相比,对照组有延迟。在人类体外受精过程中,很多患者受精失败是由于精子顶体功能的缺陷所致,结合本实验结果,我们推测:干扰雄性小鼠睾丸Clock基因表达后,影响精子顶体的功能,从而导致受精率下降,并延缓精子和卵母细胞受精的时间。
本实验进一步研究了顶体内水解酶的变化,主要研究顶体蛋白酶与脱颗粒细胞酶(透明质酸酶和ASA)的变化。顶体中含有顶体酶系统,它是一个复合酶系。顶体蛋白酶是精子顶体内主要的酶类,在受精过程中发挥重要的作用。透明质酸酶位于精子顶体后部[16],主要作用是溶解卵丘颗粒细胞间透明质酸,使卵丘细胞分散,精子得以通过这些细胞间隙[17]。ASA位于精子头部表面的顶体嵴和顶体后区[18]。ASA在精子与透明带结合及精卵质膜结合的精卵识别中发挥了重要作用[19,20]。近年研究发现,ASA能特异性结合细胞外基质,对驱散卵丘颗粒细胞起一定的作用。但ASA的这种功能和它的酶活性无关,却与其精子顶体中酶的含量多少有关[21]。本实验分别测定了顶体蛋白酶、透明质酸酶的活性和ASA的含量。结果显示:两组小鼠精子顶体中的透明质酸酶的活性和ASA的含量均无明显差异,而顶体蛋白酶活性显著下降。结合实验组小鼠精子对卵细胞脱颗粒细胞时间延迟的情况,我们分析干扰Clock基因后,主要影响精子的顶体蛋白酶活性,从而导致受精率下降。
为了进一步研究Clock基因与顶体酶的关系,我们通过ICSI的方式,高度模拟精子顶体酶进入卵母细胞后,对卵母细胞及胚胎发育的影响。已有研究显示,顶体酶对卵母细胞结构存在影响[22]。我们前期研究也证明,顶体内水解酶对卵母细胞及胚胎发育存在一定的危害[23]。本研究将5个精子注射入卵母细胞后,发现干扰组对卵母细胞及原核形成影响小于阴性质粒对照组,但其影响大于去顶体组。这进一步证明,干扰Clock基因后,顶体内部分水解酶受到一定程度的影响。
综上所述,近日节律基因 Clock与精子顶体内水解酶的形成有密切关系,具体影响机制还有待我们进一步深入研究和探讨。
1 Dolatshad H, Campbell EA, O’Hara L, et al. Developmental and reproductive performance in circadian mutant mice. Hum Reprod 2006; 21(1): 68-79
2 蒋小辉, 叶珊, 汪宇辉, 等. 近日节律基因Clock对雄性小鼠生殖功能的影响. 航天医学与医学工程 2007;20(5): 354-357
3 Alvarez JD, Chen D, Storer E, et al. Non-cyclic developmental stage-specifi c expression of circadian clock proteins during murine spermatogenesis. Biol Reprod 2003; 69(1): 81-91
4 Kennedy WP, Kaminski JM, Van der Ven HH, et al. A simple clinical assay to evaluate the acrosin activity of human spermatozoa. J Androl 1989; 10(3): 221-231
5 Wiklinson CR,Bower LM, Warren C. Measurementof yaluronidase activity in normal human serum. J Pharm 1996; 14(6): 707-712
6 Tantibhedhyangkul J, Weerachatyanukul W, Carmona E,et al. Role of sperm surface arylsulfatase in mouse spermzona pellucida binding. Biol Reprod 2002; 67(1): 212-219
7 Yamauchi Y, Yanagimachi R, Horiuchi T. Full-Term Development of Golden Hamster Oocytes Following Intracytoplasmic Sperm Head Injection. Biol Reprod 2002; 67(2): 534-539
8 Johnson MH, Lim A, Fernando D, et al. Circadian clockwork genes are expressed in the reproductive tract and conceptus of the early pregnant mouse. Reprod Biomed Online 2002; 4(2): 140-145
9 Beaver LM, Gvakharia BO, Vollintine TS, et al. Loss of circadian clock function decreases reproductive fi tness in males of Drosophila melanogaster. Proc Natl Acad Sci U S A 2002; 99(4): 2134-2139
10 Cobb J, Handel MA. Dynamics of meiotic prophase I during spermatogenesis: from pairing to division. Semin Cell Dev Biol 1998; 9(4): 445-450
11 Clermont Y. Kinetics of spermatogenesis in mammals: seminiferous epithelium cycle and spermatogonial renewal. Physiol Rev 1972; 52(1):198-236
12 Liu DY, Garrett C, Baker HW. Acrosome reacted sperm in medium do not bind to the zona pellucida of human oocytes. Int J Androl 2006; 29(4): 475-481
13 刘睿智, 王忠山, 许宗革, 等. 不育男性精子密度、活动率、活力与顶体酶活性关系的研究. 中国男科学杂志2003; 17(6): 376-377
14 Mahutte NG,Arici A.Failed fertilization: is it predictable?Curr Opin Obstet Gynecol 2003; 15(3): 211-218
15 Esfahani MH, Tavalaee M, Deemeh MR, et al. Can Assessment of Total Acrosin Activity Help Predict Failed or Low Fertilization Rate ICSI for Implementation of Artifi cial Oocyte Activation. Open Androl J 2010; 2: 19-26
16 Meyers SA, Rosenberger AE. A plasma membraneassociated hyaluronidase is localized to the posterior acrosomal region of stallion sperm and is associated with spermatozoal function. Biol Reprod 1999;61(2):444-451
17 Kawakami E, Arai T, Oishi I. Changes in hyaluronidase,acrosin and N-acetylhexosamindase activities of dog sperm after incubation. J Vet Med Sci 1999; 61(2): 183-18418 Tanphaichitr N, Smith J, Mongkolsirikieart S, et al. Role of a gamete-specifi c sulfoglycolipid immobilizing protein on mouse sperm-egg binding. Dev Biol 1993; 156(1): 164-175
19 Carmona E, Weerachatyanukul W, Xu H, et al. Binding of Arylsulfatase A to Mouse Sperm Inhibits Gamete Interaction and Induces the Acrosome Reaction. Biol Reprod 2002; 66(6): 1820-1827
20 Miller BH, Olson SL, Turek FW, et al. Circadian clock mutation disrupts estrous cyclicity and maintenance of pregnancy. Curr Biol 2004; 14(15): 1367-1373
21 Wu A, Anupriwan A, Iamsaard S, et al. Sperm surface arylsulfatase A can disperse the cumulus matrix of cumulus oocyte complexes. J Cell Physiol 2007: 213(1): 201-211
22 Morozumi K, Yanagimachi R. Incorporation of the acrosome into the oocyte during intracytoplasmic sperm injection could be potentially hazardous to embryo development. Proc Natl Acad Sci U S A 2005; 102(40): 14209-14214
23 梁鑫, 单旭东, 漆著, 等.探讨ICSI时注射顶体完整精子对胚胎发育的潜在危害. 生殖与避孕 2011; 31(6): 420-425
(2015-09-08收稿)
Infi uence of circadian Clock gene on acrosomal enzyme*
Liang Xin1,Cheng Shuting2,Wang Zhengrong2**,He Xuan2,Shan Xudong1
1.The Second Affi liated Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610041, China;
2. College of Basic Medicine and Forensic Medicine,Sichuan University,
Corresponding author: Wang Zhengrong, E-mail: Lxin04@sohu.com
Objective To study the infi uence of knocking-down circadian gene Clock on acrosomal enzymes of male mice. Methods After injection of RNAi plasmid into mice testes , the expression of circadian gene Clock in testis of mice was inhibited. in vitro fertilization (IVF) rate, acrosin, hyaluronidase activity and arylsulfatase A content in acrosome were measured to estimate the fertility of male mice. Results The RNAi plasmid reduced the fertility of male mice in vitro and decreased acrosin activity, but other enzymes were not changed obviously. During in vitro fertilization, the slight delay was observed only in the sperm of the test group dispersing granular cells. Conclusion Circadian gene Clock may be associated with the reproductive function in male mice.
Clock gene; acrosin; spermatozoa; infertility,male
10.3969/j.issn.1008-0848.2015.11.001
R 339.2
资助: 四川省教育厅项目(14ZB0092); 成都市科技项目(2014-HM01-00187-SF); 成都中医药大学科技发展基金(ZRMS201344)
**通讯作者, E-mail: Lxin04@sohu.com

