腺病毒介导的p16基因表达对体外细胞增殖和衰老的影响
吴红平 孙娟娟 李林芳 钱其军
作者单位:200438 上海 第二军医大学东方肝胆外科医院病毒及基因治疗实验室
基础研究
腺病毒介导的p16基因表达对体外细胞增殖和衰老的影响
吴红平孙娟娟李林芳钱其军
作者单位:200438上海第二军医大学东方肝胆外科医院病毒及基因治疗实验室
目的探讨p16基因表达对正常细胞和肿瘤细胞增殖和衰老的影响。方法 采用腺病毒载体构建并包装过表达p16基因的腺病毒,分别感染原代小鼠成纤维细胞(MEF)和肝癌SMMC-7721细胞,用CCK8法检测细胞增殖,SA-β-gal染色检测细胞衰老。结果 成功构建腺病毒介导的p16基因表达系统,并在MEF和SMMC-7721细胞中高效表达。CCK8法检测p16基因表达对MEF细胞增殖的抑制率在第1~4天分别为(6.8±0.25)%、(10.6±0.68)%、(12.4±0.93)%和(45.7±1.13)%(P<0.01);但对SMMC-7721细胞增殖抑制不明显;SA-β-gal染色显示p16基因可明显诱导MEF细胞衰老[(15±5)个/视野],但不能诱导SMMC-7721细胞发生衰老(0个/视野)。结论单独p16基因表达在体外不足以诱导肿瘤细胞的衰老和生长阻滞。
肿瘤;p16基因;衰老;增殖;腺病毒
细胞衰老是指正常细胞经过有限的次数分裂后停止生长,细胞形态和生理代谢活动发生显著改变的现象[1,2]。细胞衰老在肿瘤的发生、发展中非常重要,在早期是抑制肿瘤的发生[3],但当细胞衰老引起衰老相关分泌表型(senescence associated secretary phenotype, SASP)时又可促进肿瘤发生[4~7]。p16基因是一种抑癌基因,在细胞周期的G1期起重要调控作用。研究表明,p16基因是细胞衰老的关键效应物,是遗传控制程序中的主要环节,它通过p16-cyclinD/CDK-RB途径调控细胞周期,影响细胞寿命和端粒长度[8]。尽管p16基因表达被认为是衰老的必要因素,但其表达在体外是否可直接诱导肿瘤细胞衰老仍不清楚。本研究通过检测携带p16基因的腺病毒对肝癌细胞衰老的诱导作用,以明确其在肝癌基因治疗中的应用前景。
1 材料和方法
1.1材料
PDC315腺病毒载体购自Microbix Biosystems INC。增强绿色荧光蛋白(enhanced green fluorescentprotein,PDC315-EGFP)、PPE3载体为本实验室前期构建。大肠杆菌DH5α、MEF细胞、SMMC-7721细胞由本实验室保存。293细胞购自加拿大MICROBIX BIOSYSTEMS公司。细胞衰老β-半乳糖苷酶染色试剂盒购自北京碧云天公司。CCK8试剂盒购自同仁化工公司。所有内切酶购自NEB公司。DNA连接酶Solution I、KOD PLUSNEO(KOD-401)购自TOYOBO公司。2×Taq PCR MasterMix(KT201)购自北京天根生化科技有限公司。胎牛血清、DMEM购自GIBCO BRL公司。胶回收试剂盒、质粒DNA制备试剂盒、病毒DNA提取试剂盒购自QIAGEN公司。LipofectAmine2000试剂盒购自GIBCO BRL公司。
1.2方法
1.2.1人源p16序列的克隆与测序(GenBank:JQ694043.1)。在p16前加入c-Myc标签,根据序列设计引物,上游引物W173:CTCATCTCAGAAGAGGATCTGGAGCCGGCGGCGGGGAGCAG,上游引物W174:CCGGAATTCGCCACCATGGAACAAAAACTCATCTCAGAAGAGGATCTG(含有EcoRⅠ酶切位点),下游引物W 175:ACGCGTCGACTTATCAATCGGGGATGTCTGAGGGACCTTC(含有 SalⅠ酶切位点)。以PDC659-p16(捷瑞公司合成)为模板,用引物W 173+ W 175扩增p16(PCR1),然后再以PCR1为模板,用引物W174+W175进行扩增(PCR2)。扩增p16引入Myc标签。扩增条件如下:94℃变性2min,98℃变性10 s,56℃退火30 s,68℃延伸30 s,28个循环,68℃延伸5min。将PCR2产物用1.2%的琼脂糖电泳分离后做胶回收,将回收产物用EcoR I与SalⅠ双酶切后克隆入PDC315腺病毒载体以构建PDC315-p16Myc,经酶切鉴定正确后送测序公司测序。
1.2.2p16载体的构建和鉴定PCR2产物和PDC315
载体均用EcoR I、Sal I双酶切,电泳后分别回收载体和片段,连接后转化DH5α感受态细胞,挑克隆后经EcoRⅠ+SalⅠ、BglⅠ+KpnⅠ、SacⅡ酶切鉴定PDC315-p16Myc是否构建成功。
1.2.3细胞培养MEF细胞用DMEM、10%胎牛血清在37℃下培养,常规传代。SMMC-7721细胞用1640、10%胎牛血清在37℃下培养,常规传代。实验所用细胞均处于对数生长期。
1.2.4腺病毒包装转染前1 d将293细胞按1×105个细胞/孔接种于6孔板中,待293细胞汇合率达到约80%时,根据说明书将质粒PDC315-p16Myc、PPE3和Lipofectamine 2000混合,共转染至293细胞。转染后9~14 d出现病毒空斑,经过三次病毒空斑纯化,应用QIAamp DNA Blood Mini Kit提取腺病毒DNA,应用2×Taq PCR MasterMix进行PCR鉴定。其PCR扩增条件为94℃3 min,94℃30 s,56℃30 s,72℃60 s共33个循环,72℃5min。经鉴定正确的腺病毒命名为腺病毒(adenovirus,Ad)-p16,即携带Myc标签的p16基因的5型非增殖型腺病毒。
1.2.5腺病毒感染腺病毒绿色荧光蛋白(green fluorescent protein,Ad-GFP)或Ad-p16感染SMMC-7721(感染复数MOI:10)和MEF(MOI:100)细胞48 h,以荧光显微镜观察GFP的表达情况。细胞采用IP裂解液裂解后泡SDS-PAGE(10%)电泳,通过Western blot法检测携带Myc标签的p16基因表达情况。
1.2.6CCK8试剂盒检测细胞增殖检测步骤:每孔加入100μl约2 000个细胞,按照实验设计,分别给予不同的腺病毒感染细胞,在不同时间点(d0、d1、d2、d3、d4)每孔加入10μl CCK8检测液,使CCK8检测液与细胞培养液的体积比为1∶10。采用相应细胞培养液和CCK8检测液在没有加入细胞的孔作为空白对照;细胞培养箱中孵育1 h,注意保证每个检测时间点的孵育时间相同,在450 nm处测定吸光度。
1.2.7SA-β-gal染色上述细胞培养于6孔板中,感染相应腺病毒后,采用细胞衰老β-半乳糖苷酶染色试剂盒在96 h时吸除细胞培养液,用PBS洗涤1次,加入1mlβ-半乳糖苷酶染色固定液,室温固定15min。吸除细胞固定液,用PBS洗涤细胞3次,每次3 min。吸除PBS,每孔加入1 ml染色工作液,37℃孵育过夜,用保鲜膜封住6孔板防止蒸发,普通光学显微镜下观察。
1.3统计学方法
采用SPSS 19.0统计学软件进行数据处理和分析。计量资料用均数±标准差(x±s)表示,两组数据的比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1腺病毒介导的p16基因表达
本实验采用腺病毒PDC315载体分别构建和包装GFP基因和p16基因(携带Myc标签)的腺病毒。体外感染MEF细胞和肝癌SMMC-7721细胞后在荧光显微镜下观察,当感染复数(MOI)分别为100和10时,绝大多数MEF细胞和SMMC-7721细胞均表达GFP。采用同样感染复数的p16腺病毒感染上述两种细胞,经Western blot法检测可见p16基因高水平表达。见图1、图2。

图1 腺病毒介导的GFP基因在SMMC-7721细胞和MEF细胞中的表达(×200)
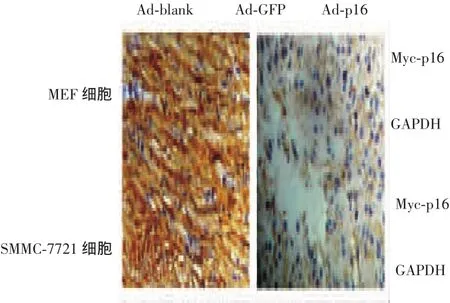
图2 腺病毒介导的p16基因在SMMC-7721细胞和MEF细胞中的表达
2.2腺病毒介导的p16基因表达对细胞增殖的影响腺病毒介导的GFP和p16表达后,采用CCK8法检测MEF和SMMC-7721细胞增殖的变化,结果发现SMMC-7721细胞感染 Ad-blank、Ad-GFP和Ad-p16后三组细胞增殖率差异无统计学意义(P>0.05)。p16表达显著抑制MEF细胞增殖,Ad-p16组与Ad-blank组比较5个检测时间点(d0、d1、d2、d3、d4)的抑制率分别为(0.1±0.03)%、(6.8±0.25)%、(10.6±0.68)%、(12.4±0.93)%和(45.7±1.13)%,经配对t检验,两组细胞增殖明显差异(P=0.007),Ad-blank组和Ad-GFP组比较增殖率无明显差异,(P=0.351)。见图3。
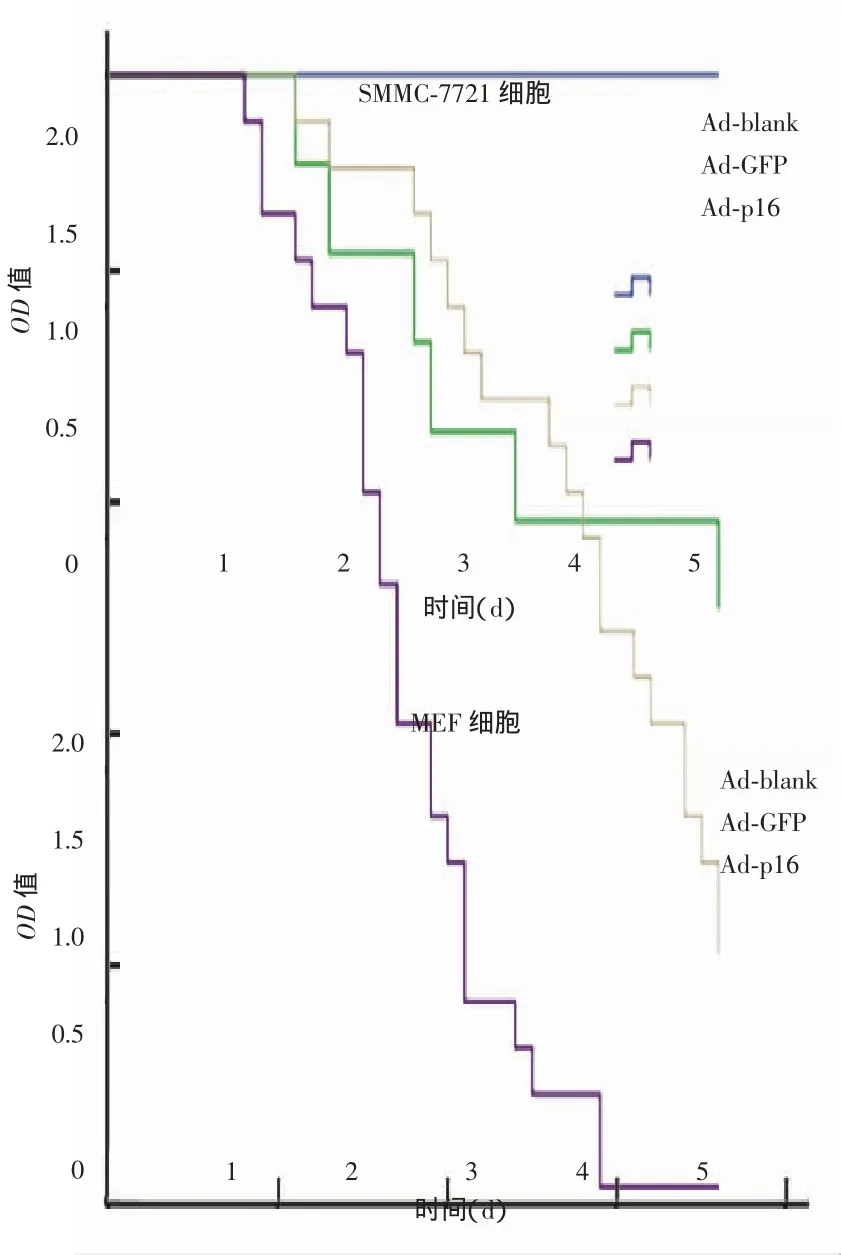
图3 腺病毒介导的p16基因表达对SMMC-7721细胞和MEF细胞增殖的影响
2.3腺病毒介导的p16基因表达对细胞衰老的影响
SMMC-7721细胞和MEF细胞分别感染Ad-GFP和Ad-p16腺病毒并培养96 h后,SA-β-gal染色显示SMMC-7721细胞感染Ad-GFP和Ad-p16腺病毒后没有观察到细胞衰老。MEF细胞感染Ad-GFP和Adp16腺病毒后,Ad-GFP孔未观察到典型的细胞衰老(0个/视野),而Ad-p16孔中可见广泛的细胞衰老[(15±5)个/视野]。见图4。

图4 腺病毒介导的p16基因表达96 h后对SMMC-7721细胞和MEF细胞衰老的影响(×200)
3 讨论
p16基因又称为MTS(multiple tumor suppressor 1)基因,是一种细胞周期调控基因,可抑制细胞增殖及分裂,在人类50%肿瘤细胞中发现有杂合或纯合子缺失或突变。有研究者将p16基因比作细胞周期中的刹车装置,其一旦失灵则会引起细胞恶性增殖,导致恶性肿瘤发生[9]。p16基因已在肺癌、乳腺癌、脑肿瘤、骨肿瘤、皮肤癌、膀胱癌、肾癌、卵巢癌、淋巴瘤和黑色素瘤中发现纯合子缺失以及无义、错义及移码型突变,表明p16基因以缺失、突变方式广泛参与肿瘤形成,检测p16基因有无改变对判断肿瘤的易感性以及预测肿瘤的预后具有十分重要的临床意义[10]。研究发现,细胞衰老时,p16基因表达明显升高;当年轻细胞导入p16基因后可出现衰老表型。因此p16基因也被认为是细胞衰老的关键分子标志[1,11]。
Ad为双链DNA病毒,它能感染各时相的细胞,以其高效转染和高效表达而成为应用广泛的病毒载体。与其他载体相比,腺病毒感染的靶细胞种类多,既可感染分裂期细胞,又可感染非分裂期细胞,还可感染增殖静止期细胞,故在转染原代(肿瘤)靶细胞及体内基因转染上有很大优势;腺病毒基因组较少发生重排,不整合到宿主染色体中,不会引起插入突变,外源基因能游离地表达,因此潜在的致癌危险度较小;腺病毒载体具有容量大、感染性强、导入效率高,可经不同途径进入不同组织;体外稳定性好,滴度高易于制备和纯化等诸多优点[12]。
研究表明,p16基因在肝癌中的表达显著下调,其主要机制可能与p16基因启动子区域的高度甲基化密切相关[13]。基于p16基因在衰老和抑制细胞增殖的重要作用,本实验采用腺病毒介导p16基因表达,观察其对正常小鼠MEF细胞和肝癌SMMC-7721细胞生长和衰老的影响。研究结果显示,腺病毒可介导p16基因在上述两种细胞中高水平表达,但与对照病毒比较,p16基因表达仅显著抑制正常小鼠的MEF细胞而不能显著抑制肝癌SMMC-7721细胞的增殖和衰老。其原因可能与细胞的正常生长依赖于细胞周期中各种调节因子的平衡调控有关。参与细胞周期调控的主要因子有细胞周期蛋白(cyclin)、细胞周期蛋白依赖性激酶(cyclin dependent kinases,CDKs)和CDK抑制蛋白(cyclin dependent kinase inhibitors,CDKIs)。CDKI分为两大类:一类为Ink4,包括p16、p15、p18和p19;另一类为Cip/kip,包括p21cip1、p27kip1、p57 kip2等。上述细胞周期主要调控物质彼此之间关系,并形成一个以CDK为中心的细胞周期网络调控系统,以保障各个细胞周期事件的启动、完成、忠实性及其按序进行[8,14]。由此可见,p16基因与许多CDKIs协同调控细胞周期网络,由于肿瘤细胞发生了显著的细胞周期调控异常,单独的p16基因表达可能不足以阻断肿瘤细胞周期阻滞。另一方面,p16、p21和p19等细胞周期抑制分子在细胞中可经REGγ依赖的蛋白酶体非泛素途径快速降解[15]。此外,p16基因启动子甲基化也是抑制其表达的重要因素[16]。本研究腺病毒介导的p16基因表达与GFP比较,其丰度较低,提示外源的p16分子被快速降解,因而达不到抑制细胞周期的表达水平。今后在本研究基础上,我们拟构建可抵抗降解的p16基因,进一步验证腺病毒介导的p16基因对肝癌细胞衰老诱导作用,明确其在肝癌基因治疗中的有效性和可行性。
[1] Collado M,Blasco MA,Serrano M.Cellular senescence in cancer and aging[J].Cell,2007,130(2):223-233.
[2] Serrano M,Lin AW,McCurrach ME,et al.Oncogenic ras provokes premature cell senescence associated with accumulation of p53 and p16INK4a[J].Cell,1997,88(5):593-602.
[3] Burd CE,Sorrentino JA,Clark KS,etal.Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model[J].Cell,2013,152(1-2):340-351.
[4] López-Otín C,BlascoMA,Partridge L,etal.Thehallmarksofaging[J]. Cell,2013,153(6):1194-1217.
[5]CoppéJP,Rodier F,Patil CK et al.Tumor suppressor and aging biomarker p16(INK4a)induces cellular senescence without the associated inflammatory secretory phenotype[J].JBiol Chem,2011,286(42):36396-36403.
[6] Campisi J.Senescent cells,tumor suppression,and organismal aging:good citizens,bad neighbors[J].Cell,2005,120(4):513-522.
[7]Campisi J,d'Adda di Fagagna F.Cellular senescence:when bad thingshappen to good cells[J].Nat Rev Mol Cell Biol,2007,8(9):729-740.
[8]Michalides RJ.Cell cycle regulators:mechanisms and their role in aetiology,prognosis,and treatment of cancer[J].JClin Pathol,1999,52(8):555-568.
[9]Matheu A,Pantoja C,Efeyan A,et al.Increased gene dosage of Ink4a/Arf results in cancer resistance and normal aging[J].Genes Dev,2004,18(22):2736-2746.
[10] LiggettWH Jr,Sidransky D.Role of the p16 tumor suppressor gene
in cancer[J].JClin Oncol,1998,16(3):1197-1206.
[11] Baker DJ,Wijshake T,Tchkonia T,et al.Clearance of p16Ink4apositive senescent cells delays ageing-associated disorders[J].Nature,2011,479(7372):232-236.
[12]VorburgerSA,HuntKK.Adenoviralgene therapy[J].Oncologist,2002,7(1):46-59.
[13]Zang JJ,Xie F,Xu JF,et al.p16 gene hypermethylation and hepatocellular carcinoma:a systematic review and meta-analysis[J].World J Gastroenterol,2011,17(25):3043-3048.
[14]Morgan DO.Principles of CDK regulation[J].Nature,1995,374(6518):131-134.
[15]Jariel-Encontre I,Bossis G,Piechaczyk M.Ubiquitin-independ ent degradation of proteinsby the proteasome[J].Biochim Biophys Acta,2008,1786(2):153-177.
[16]黄密密,杨春,欧超,等.大鼠肝癌组织中DLC1、ASC、p16和DLK1基因甲基化状态与肝癌的关系[J].中国癌症防治杂志,2015,7(2):80-84.
[2015-04-01收稿][2015-09-21修回][编辑江德吉]
Im pact of adenovirus-mediated p16 expression on cell proliferation and senescence in vitro
Wu Hongping,Sun Juanjuan,Li Linfang,Qian Qijun(Molecular Virology Laboratory,Shanghai Eastern Hepatobiliary Surgery Hospital,Second Military Medical University,Shanghai 200438,P.R.China)
Qian Qijun.E-mail:qianqj@163.com
Objective To investigate the influence of exogenous p16 expression on cell proliferation and senescence in normal and tumor cells.M ethod Genes encoding p16 and GFP were subcloned into an adenovirus vector,then recombinant adenovirus was produced in 293 cells and purified for subsequent infection into MEF and SMMC7721 cells.Cell proliferation was examined by CCK8 assay and senescence by SA-β-gal staining.Results The number of senescent MEF cells was much higher in cultures after infection with adenovirus expressing p16 than after infection with control adenovirus(15±5 vs 0 senescent cells/field),and p16-expressing cultures showed significantly lower proliferation on days 1-4[(6.8±0.25)%,(10.6±0.68)%,(12.4±0.93)% and(45.7±1.13)%;P<0.01].In contrast,no significant differences in proliferation or senescence were observed between control SMMC-7721 cultures or cultures expressing p16.Conclusion Expression of p16 alone is insufficient to induce cell growth arrest and senescence in tumor cells.
Neoplasm;p16 gene;Senescence;Proliferation;Adenovirus
R730.2
A
1674-5671(2015)05-05
10.3969/j.issn.1674-5671.2015.05.02
国家科技重大专项项目(2013ZX10002010-007)
钱其军。E-mail:qianqj@163.com

