蕹菜叶酪氨酸酶的分离纯化与部分性质
孙才云,方 玲,万 骥,傅 婷,王 丹,唐云明
(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
蕹菜叶酪氨酸酶的分离纯化与部分性质
孙才云,方 玲,万 骥,傅 婷,王 丹,唐云明*
(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
蕹菜叶经匀浆、缓冲液提取、硫酸铵分级沉淀、DEAE-Sepharose离子交换层析、Superd ex-200凝胶过滤层析,获得电泳纯的酪氨酸酶。该酶活力达到114.53 U/mg,酶活力回收率为11.33%,纯化倍数为99.59。全酶分子质量为77.60 kD,亚基分子质量为38.70 kD;最适温度为45 ℃,最适pH值为7.5,该酶在25~55 ℃及pH 6.0~8.0的范围内有较好的稳定性;在最适条件下测得其Km值为10.05 mmol/L;甲醇、乙醇、异丙醇及柠檬酸、抗坏血酸、Ca2+和Pb2+对该酶有抑制作用,Mn2+、Zn2+和Co2+对该酶具有一定的激活作用,尿素和十二烷基硫酸钠(sodium dodecyl sulfonate,SDS)对该酶活性影响不大,Li+、K+对该酶活性基本没有影响。
蕹菜叶;酪氨酸酶;分离纯化;性质
酪氨酸酶(tyrosinase,TYR,EC1.14.18.1)是结构复杂的多亚基含铜氧化还原酶,广泛存在于微生物、动植物及人体内[1]。兼有加氧酶和氧化酶的双重功能,能将单酚加氧成二酚,又可以将二酚等多元酚氧化成醌[2]。不仅是生物体合成黑色素等产生色斑的关键酶[3],并且参与多酚类物质的形成[4]。植物中的酪氨酸酶主要与酚类代谢、植物抗病有关[5]。它可以诱导植物抗营养防御反应,降低对食草动物的营养作用,而且对细菌有抑制作用,防止细菌扩散[6]。目前,酪氨酸酶被广泛地应用于医药、环境、食品、精细化工等领域[7],如在食品工业中,一方面由于酪氨酸酶氧化酚类物质生成黑色素,降低了其营养价值和风味[6],因此抑制酪氨酸酶具有重要的意义;另一方面为了增加色调,有意加入酪氨酸酶,如红茶的制作、葡萄干和枣的晒制、啤酒生产等[7]。因此获得来源广泛、成本低廉的酪氨酸酶并对其部分性质进行研究具有重要的理论和经济意义。
蕹菜(Ipomoea aquatica Forsk.),又称空心菜,为旋花科甘薯属一年生或多年生草本蔬菜,具有产量高、抗性强、病虫害少等优点,是堵缺补淡的首选蔬菜[8]。本实验从蕹菜叶中分离纯化了TYR,并对其部分性质进行了研究,不仅可以为寻求蕹菜酪氨酸酶的抑制剂提供参考,还可以提供一种廉价易得的酪氨酸酶来源,从而提高其经济价值。
1 材料与方法
1.1材料与试剂
蕹菜,购自于重庆市北碚区天生路永辉超市。
左旋多巴(levodopa,L-DOPA)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVPP)、考马斯亮蓝R-250、牛血清白蛋白 美国Sigma公司;丙烯酰胺、甲叉双丙烯酰胺 美国Bio-Rad公司;DEAE-Sephrose、Superdex-200分子质量标准品、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfonate-polyacrylamide gelelectrophoresis,SDS-PAGE)蛋白质标准品 美国GE公司;其余试剂均为国产分析纯。
1.2仪器与设备
Milli-Q plus纯水仪 美国Millipore公司;GL-21M高速冷冻离心机 长沙湘仪仪器有限公司;AL204精密电子天平、Seven Easy pH计 瑞士Mettler-Toledo公司;UV-2550型紫外分光光度计 日本岛津公司;AKTA Prime plus纯化系统 美国GE公司;垂直电泳槽和电泳仪 美国Bio-Rad公司;MC4L冷冻干燥机 德国Uni-Equip公司。
1.3方法
1.3.1粗酶液的制备
取蕹菜叶200.00 g清洗干净,晾干后剪碎,按照1∶4(m/V)的比例立即加入预冷的800 mL 50 mmol/L pH 7.5 Tris-HCl的提取缓冲液和4.00 g的PVPP;放入组织匀浆机中匀浆,置4 ℃冰箱提取3 h,经 纱过滤后得到滤液,在4 ℃条件下12 000 r/min离心40 min,收集上清液即为粗酶液。
1.3.2硫酸铵分级沉淀
向粗酶液中缓慢加入硫酸铵粉末至20%饱和度,4 ℃冰箱静置盐析2.5 h,4 ℃条件下12 000 r/min离心40 min收集上清液;继续缓慢加入硫酸铵粉末至65%饱和度,4 ℃冰箱静置盐析3 h,4 ℃条件下12 000 r/min离心45 min收集沉淀;沉淀用预冷的50 mmol/L pH 7.7的Tris-HCl缓冲液完全溶解,用5 mmol/L pH 7.7的Tris-HCl透析液,4 ℃条件下透析过夜,得到酶液并保存。
1.3.3DEAE-Sepharose离子交换层析
用50 mmol/L pH 7.7 Tris-HCl缓冲液平衡层析柱后,取1.3.2节中得到的酶液10 mL上柱,含有0~1.0 mol/L NaCl的50 mmol/L pH 7.7 Tris-HCl缓冲液进行线性梯度洗脱,每管收集5 mL,流速设定为0.5 mL/min,共收集65 管,测定各管酶活力以及蛋白质含量,收集酶活力较高的几管,经透析后冷冻干燥备用。
1.3.4Superdex-200 凝胶过滤层析
层析柱经过50 mmol/L pH 7.7 Tris-HCl缓冲液平衡处理后,取1.3.3节中冷冻干燥的TYR用50 mmol/L pH 7.7 Tris-HCl缓冲液溶解,每次上柱5 mL,用50 mmol/L pH 7.7 Tris-HCl缓冲液进行洗脱,共收集60 管,每管收集3 mL,流速设定为0.3 mL/min,测定各管酶活力以及蛋白含量,收集酶活力较高的几管,经透析后冷冻干燥得到酶的样品,置于-20 ℃冰箱中保存备用。
1.3.5TYR活力的测定
[9]并作修改:酪氨酸酶活力的测定是基于L-DOPA的酶催化氧化产物——多巴色素(dopachrome)在475 nm波长处有最大吸收,其吸光系数为ε= 3 700 mol/(L·cm)。酶活力单位定义为以每分钟多巴色素在475 nm波长处的光密度值增加0.001为一个酶活力单位(U)。因此,通过测定酶催化反应体系的OD475nm随时间的增长曲线,从直线斜率即可求得酶活力。
1.3.6蛋白质含量测定
采用Bradford法[10]以及紫外分光光度法[11]对蛋白质含量进行测定。
1.3.7TYR分子质量测定和纯度鉴定
采用凝胶过滤法对全酶分子质量进行测定[12],用SDS-PAGE对1.3.4节中得到酶活力最高管的样品进行纯度鉴定以及亚基分子质量的测定[13]。
1.3.8蕹菜叶TYR部分性质的研究
1.3.8.1蕹菜叶TYR最适温度和热稳定性研究
分别在20~75 ℃(间隔5 ℃)条件下测定酶活力(以最适温度条件下测定的酶活力为100%)确定其最适温度。将适量的酶液分别置于不同温度(25~75 ℃,间隔10 ℃)条件下,每间隔1 h测定该酶活力,测定1~5 h,以原酶液在35 ℃测得的酶活力为100%,计算相对酶活力,研究其热稳定性。
1.3.8.2蕹菜叶TYR最适pH值和pH值稳定性研究
分别在pH 4.0~10.0条件下测定酶活力确定其最适pH值;将适量的酶液分别保存于pH 4.0~10.0的缓冲液中,每间隔30 min测定该酶活力,测定30~150 min,研究其pH值稳定性。二者均以最适条件下测得的酶活力为100%,计算相对酶活力。
1.3.8.3蕹菜叶TYR的Km的测定
设置底物L-DOPA浓度(2、4、6、8、10 mmol/L),在最适温度和最适pH值条件下测定TYR的活力,采用双倒数作图法(Lineweaver-Burk法)[14]求出该酶的Km值。
1.3.8.4不同有机溶剂对蕹菜叶TYR活性的影响
分别将甲醇、异丙醇、乙醇与适量的酶液混合,使混合后有机溶剂的体积分数分别为10%、20%、30%、40%、50%,在25 ℃条件下保温30 min后,在最适条件下分别测定其活性。以酶液在最适条件下测得酶活力为100%,加入不同有机溶剂后测得的酶活力与之相比得相对酶活力。
1.3.8.5不同化合物对蕹菜叶TYR活性的影响
将乙二胺四乙酸(ethylenediamine tetraaceticacid,EDTA)、尿素、抗坏血酸、SDS、柠檬酸配成100 mmol/L母液,按一定的比例与适量的酶液混合,混合后终浓度分别为10、20、30、40、50 mmol/L;在25 ℃条件下保温30 min后,在最适条件下分别测定其活性。以酶液在最适条件下测得酶活力为100%,加入不同化合物后测得的酶活力与之相比得相对酶活力。
1.3.8.6不同金属离子对蕹菜叶TYR活性的影响
将金属离子(Mn2+、Ca2+、Zn2+、Pb2+、Co2+、Li+、K+)配制成10 mmol/L母液,再按一定比例分别与适量的酶液混合,混合后终浓度分别为1、2、3、4、5 mmol/L,在25 ℃条件下保温30 min后,在最适条件下分别测定其活性。以酶液在最适条件下测得酶活力为100%,加入不同金属离子后测得的酶活力与之相比得相对酶活力。
2 结果与分析
2.1蕹菜叶TYR的分离纯化结果
经硫酸铵分级沉淀透析后的酶液经DEAE-Sepharose层析结果见图1,酶活性最高管为第20管,酶活性峰集中在第17~23管,收集酶活性较高的几管酶液,透析并冷冻干燥后上Superdex-200层析柱,结果见图2,酶活性最高管为第40管,收集酶活性较高几管的酶液,透析冷冻干燥后于-20 ℃冰箱中保存备用。整个分离纯化过程结果见表1。
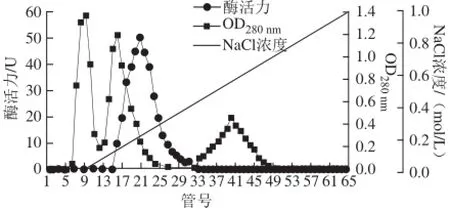
图1 蕹菜叶TYR的DEAE-Sepharose离子交换柱层析结果Fig.1 DEAE-Sepharose ion-exchange chromatography of TYR from Ipomoea aquatica Forsk. leaves
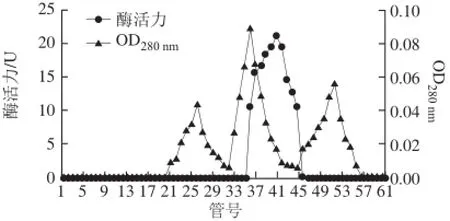
图2 蕹菜叶TYR的Superdex-200凝胶过滤层析结果Fig.2 Superdex-200 gel filtration chromatography of TYR from Ipomoea aquatica Forsk. leaves

表1 蕹菜叶TYR的分离纯化结果Table 1 Purification of TYR from Ipomoea aquatica Forsk. leaves
2.2蕹菜叶TYR纯度鉴定和分子质量测定结果
蕹菜叶TYR纯化后,经SDS-PAGE显示单一条带(图3),说明该酶样品达到电泳纯,通过迁移率推算出该酶亚基的分子质量为38.70 kD;而通过凝胶过滤层析法测定的全酶分子质量约为77.60 kD(图4),可以推断出蕹菜叶TYR是由两个相同的亚基组成。

图3 蕹菜叶TYR的SDS-PAGGEE图Fig.3 SDS-PAGE of purified TYR from Ipomoea aquatica Forsk. leaves
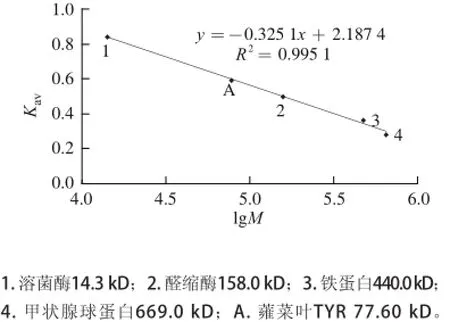
图4 Superdex-200凝胶过滤法测得蕹菜叶TYR的全酶分子质量Fig.4 Estimation of molecular weight of TYR from Ipomoea aquatica Forsk. leaves by Superdex-200 gel filtration
2.3蕹菜叶TYR部分性质研究
2.3.1蕹菜叶TYR最适温度和热稳定性
由图5可知,TYR的最适反应温度为45 ℃。由图6可知,在25~55 ℃范围内,该酶的稳定性较好;超过55 ℃,随着温度的升高,酶活力明显下降;其中在75 ℃保温2 h后,酶活力几乎全部丧失。
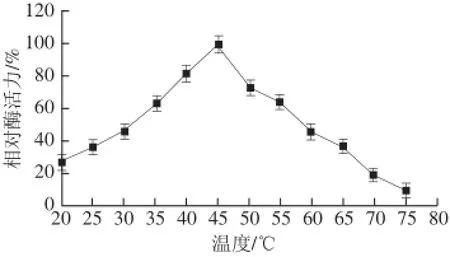
图5 温度对蕹菜叶TYR活力的影响Fig.5 Effect of temperature on the activity of TYR from Ipomoea aquatica Forsk. leaves

图6 蕹菜叶TYR的热稳定性Fig.6 Thermal stability of TYR from Ipomoea aquatica Forsk. leaves
2.3.2蕹菜叶TYR最适pH值和pH值稳定性
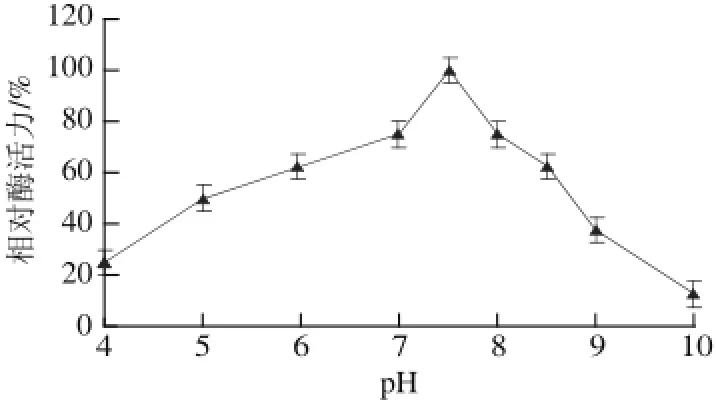
图7 pH值对蕹菜叶TYR活力的影响Fig.7 Effect of pH on the activity of TYR from Ipomoea aquatica Forsk. leaves
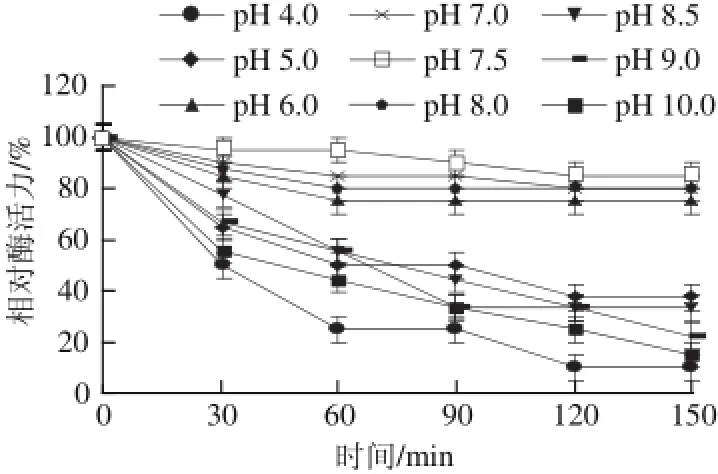
图8 蕹菜叶TYR的pH值稳定性Fig.8 pH Stability of TYR from Ipomoea aquatica Forsk. leaves
由图7可知,该酶的最适pH值为7.5。由图8可知,在pH 6.0~8.0时酶稳定性较好,酶活力变化趋势比较平缓;当pH<6.0或>8.0时,酶蛋白分子结构受到破坏,酶活力迅速下降,其中当pH 4.0时,150 min后酶活力仅剩10%,当pH值为10.0时,150 min后酶活力仅剩15%,说明该酶对酸碱比较敏感。
2.3.3蕹菜叶TYR米氏常数的测定结果
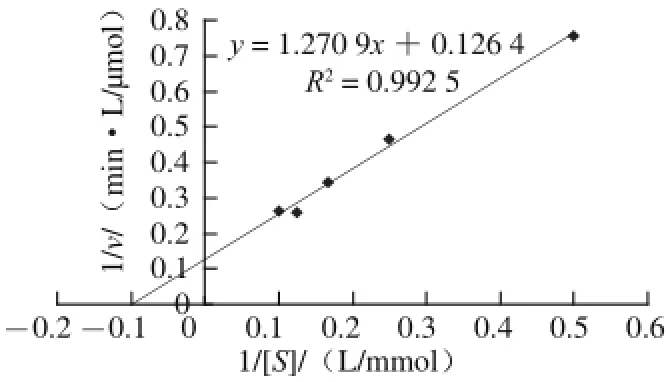
图9 双倒数法测蕹菜叶TYR的米氏常数Fig.9 Lineweaver-Burk plot for Kmdetermination of TYR from Ipomoea aquatica Forsk. leaves
如图9所示,经计算,蕹菜叶TYR对L-DOPA的Km值为10.05 mmol/L。
2.3.4不同有机溶剂对蕹菜叶TYR活力的影响
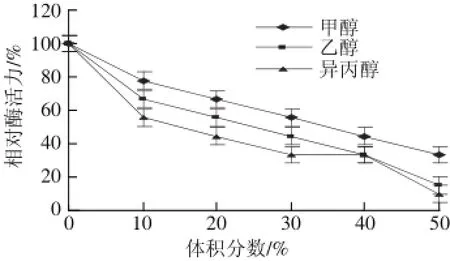
图10 不同有机溶剂对蕹菜叶TYR活力的影响Fig.10 Effects of various organic solvents on the activity of TY R from Ipomoea aquatica Forsk. leaves
由图10可知,该酶在异丙醇、甲醇、乙醇3 种有机溶剂作用下,活性均受到了强烈的抑制,随着有机溶剂体积分数的增大,这种抑制作用越强。特别是异丙醇,当体积分数达到50%,该酶活力仅剩10%,3 种有机溶剂对该酶的抑制强弱依次为异丙醇>乙醇>甲醇。
2.3.5不同化合物对蕹菜叶TYR活力的影响

图11 不同化合物对蕹菜叶TYR活性的影响Fig.11 Effects of various compounds on the activity of TYR from Ipomoea aquatica Forsk. leaves
由图11可知,随着化合物浓度的增大,几种化合物对该酶活性都表现出了抑制作用,其中,抗坏血酸、柠檬酸对该酶的抑制作用非常明显,尿素和SDS对该酶活性影响不大,EDTA在0~40 mmol/L范围内对酶活性有明显的抑制作用,浓度超过40 mmol/L,则对该酶活性不再有影响。
2.3.6不同金属离子对蕹菜叶TYR活力的影响
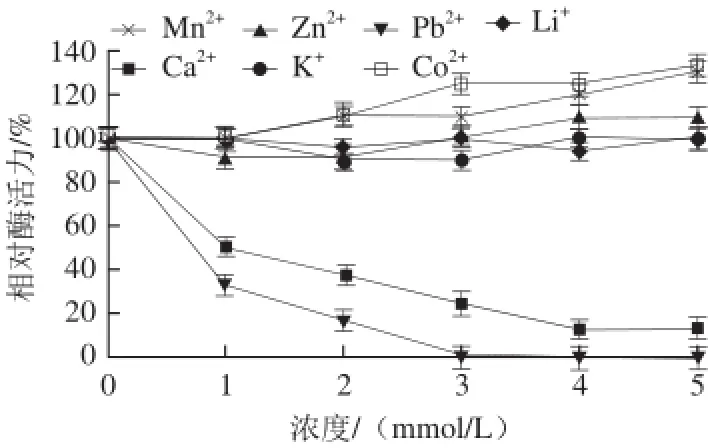
图12 不同金属离子对蕹菜叶TYR活力的影响Fig.12 Effects of various metal ions on the activity of TYR from Ipomoea aquatica Forsk. leaves
由图12可知,不同金属离子对蕹菜叶TYR活性有不同的影响。随着金属离子浓度的增加,Mn2+、Zn2+和Co2+对酶活性有一定的激活作用,Ca2+和Pb2+对该酶均有较强的抑制作用,其中Pb2+对该酶的抑制作用最强烈,当Pb2+浓度达到3 mmol/L时,TYR酶活性几乎完全丧失。Li+、 K+对该酶活性基本没有影响。
3 结论与讨论
本实验以蕹菜叶为材料,经过匀浆、沉淀、层析等步骤后,从蕹菜叶中成功分离纯化得到电泳纯TYR,该酶活力达到114.53 U/mg,酶活回收率为11.33%,纯化倍数为99.59,与胡源等[15]报道的从马铃薯中分离纯化出的酪氨酸酶(回收率为18.44%,纯化倍数为50)和邹宇等[16]报道的黑木耳中分离纯化出的酪氨酸酶(回收率为27.41%,纯化倍数为21.43)相比,回收率偏低,但纯化倍数较高。回收率偏低的原因是蕹菜叶的酪氨酸酶存在着同工酶[17],纯化过程中丢失了同工酶,在今后的实验中可以通过改进方法,获得更好的分离效果。
蕹菜叶TYR最适温度为45 ℃,低于香樟果实(50 ℃)[5],高于克氏原螯虾(35 ℃)[18]、双胞蘑菇(30 ℃)[1];该酶最适pH值为7.5,与香樟果实(pH 7.5)[5]相同,与家蝇(pH 7.4)[19]相近,低于南美白对虾(pH 8.0)[20],高于小菜蛾(pH 6.4)[21];该酶的Km值为10.05 mmol/L,低于香樟果实(12.83 mmol/L)[5],高于中国对虾(1.99 mmol/L)[22]。说明不同来源的TYR在酶学性质方面存在一定的差异,可能与其生存环境、物种甚至组织源性不同有关,也可能与研究中所用缓冲液、底物的种类和浓度不同有关[23]。
蕹菜叶TYR亚基分子质量为38.70 kD。高于链霉菌(30.72 kD)[24],黑木耳(12.62 kD)[9];低于人体(60.40 kD)[25]和中国对虾(77 kD)[22];与香樟果实(43 kD)[5]相近。TYR分子质量大小的不同可能原因是种属差异造成的,或者可能与其生存环境的差异及其长期的分离进化有关[23]。
有机溶剂甲醇、乙醇和异丙醇对蕹菜叶TYR活性有较强的抑制作用,推测原因是加入有机溶剂后破坏了水化层,降低了溶液的极性,使酶分子中维持构象的次级键被破坏,从而改变了酶的构象。Ca2+和Pb2+对蕹菜叶TYR均有较强的抑制作用,推测原因可能是该酶的竞争性抑制剂,或者它们能够与活性中心以外的基团结合,作为重金属离子,高浓度会使该酶变性而达到抑制作用。Mn2+、Zn2+和Co2+对酶活性有一定的激活作用,很可能是通过促进底物与该酶活性中心的亲和力进而有利于酪氨酸酶活性发挥来实现的,或者可能参与该酶酶原的激活过程[22]。Li+、K+对该酶活性基本没有影响,其中K+主要考虑为是细胞内外常见离子,主要中和阴离子的电荷,保持细胞内外渗透压平衡,长期的进化过程使得细胞对这些离子浓度变化有着严密的调控机制[26]。柠檬酸对该酶的抑制作用非常明显,原因可能是其降低了反应体系的pH值,并螯合酶活性中心的铜离子而使酶失活[1],抗坏血酸对该酶的抑制作用强烈,这与张晓晴等[5]报道的香樟果实酪氨酸酶的性质一致。
参考文献:
[1] 蒋萌蒙, 田呈瑞, 王向军. 双孢蘑菇中酪氨酸酶的特性[J]. 江苏农业学报, 2008, 24(2): 194-198.
[2] BURTON S G. Biocatalysis with polyphenoloxidase: a review[J]. Catalysis Today, 1994, 22: 459-487.
[3] 王春丽, 柳伟. 酪氨酸酶的研究进展[J]. 生物加工过程, 2014, 12(4):94-100.
[4] RODRIGUEZ-LOPEZ J N, TUDELA J, VAR☒N R, et al. Analysis of a kinetic model for melanin biosynthesis pathway[J]. Journal of Biological Chemistry, 1992, 267: 3801-3810.
[5] 张晓晴, 蔡宇杰, 廖祥儒, 等. 香樟(Cinnamomum camphora)果实酪氨酸酶的分离纯化及特性分析[J]. 安徽农业科学, 2008, 36(15):6167-6170; 6262.
[6] 胡源. 马铃薯酪氨酸酶的分离纯化及性质研究[D]. 成都: 四川大学,2005: 37-58.
[7] 张廷红, 葛长海, 万海清. 酪氨酸酶的应用研究进展[J]. 沿海企业与科技, 2005(2): 161-163.
[8] 王顺党, 郑宇峰, 赵从新, 等. 蕹菜繁种技术[J]. 中国农技推广, 2009,25(8): 13-14.
[9] 曾亮, 吴靓靓, 官兴丽, 等. 儿茶素对马铃薯酪氨酸酶的抑制作用[J].食品科学, 2010, 31(23): 310-313.
[10] 余瑞元. 生物化学试验原理和方法[M]. 北京: 北京大学出版社,1994: 171-176.
[11] 刘奥梅, 朱怀荣. 生物化学实验教程[M]. 北京: 人民卫生出版社,1997: 23-25.
[12] 胡瑞斌, 李星, 王红杨, 等. 黄瓜过氧化物酶的分离纯化及酶学性质[J].食品科学, 2014, 35(11): 168-173. doi: 10.7506/spkx1002-6630-201411034.
[13] 孙芳, 任美凤, 胡瑞斌, 等. 韭菜酸性磷酸酶的分离纯化及酶学性质[J].食品科学, 2013, 34(17): 187-191. doi: 10.7506/spkx1002-6630-201317040.
[14] 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 北京: 高等教育出版社,2002: 378-380.
[15] 胡源, 刘克武, 喻东, 等. 马铃薯酪氨酸酶的性质[J]. 化学研究与应用, 2005, 17(1): 55-57.
[16] 邹宇, 马堃, 胡文忠, 等. 黑木耳酪氨酸酶的分离纯化与酶学性质研究[J]. 食品工业科技, 2013, 34(23): 177-180.
[17] BOUCHILLOUX S, McMAHILL P, MASON H S. The multiple forms of mushroom tyrosinase. Purification and molecular properties of the enzymes[J]. Journal of Biological Chemitry, 1963, 238(5):1679-1706.
[18] 王建国, 许琴瑟, 王权, 等. 克氏原螯虾酚氧化酶部分生化特性的研究[J]. 淡水渔业, 2012, 42(6): 68-72.
[19] 刘春艳, 高希武, 梁沛, 等. 家蝇酪氨酸酶生物化学性质及农药对其抑制作用[J]. 农药, 2004, 43(11): 497-500.
[20] 吕艳芳, 魏春娇, 王娇, 等. 南美白对虾酚氧化酶的提取及生化特性[J]. 食品科学, 2014, 35(7): 113-117. doi: 10.7506/spkx1002-6630-201407023.
[21] 梁沛, 孟凤霞, 高希武, 等. 小菜蛾酪氨酸酶生物化学性质研究[J].昆虫学报, 2003, 46(5): 553-557.
[22] 樊廷俊, 汪小锋. 中国对虾(Penaeus chinensis)酚氧化酶的分离纯化及其部分生物化学性质[J]. 生物化学与生物物理学报: 英文版,2002, 34(5): 589-594.
[23] 樊廷俊, 任秉新, 樊现远, 等. 甲壳动物酚氧化酶分子结构与生物化学性质的研究进展[J]. 山东大学学报: 理学版, 2012, 47(1): 1-7.
[24] BERNAN V, FIPULA D, HERBER W. The nucleotide sequence of the tyrosi-nase gene from Streptomyces antibioticus and characterization of the gene prod-uct[J]. Gene, 1985, 37: 101-110.
[25] GIEBELL B, STRUNKK M, SPRITZ R A. Organization and nucleotide sequences of the human tyrosinase gene and a truncated tyrosinase-related segment[J]. Genomic, 1991, 9: 435-445.
[26] 杨进孙, 周书林. 金属离子对不同螺龄湖北钉螺酚氧化酶活性的影响[J]. 中国媒介生物学及控制杂志, 2014, 25(3): 246-248.
Isolation, Purification and Characterization of Tyrosinase from Ipomoea aquatica Forsk. Leaves
SUN Caiyun, FANG Ling, WAN Ji, FU Ting, WANG Dan, TANG Yunming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Key Laboratory of Freshwater Fish Reproduction and Development, M inistry of Education, School of Life Science, Southwest University, Chongqing 400715, China)
Electrophoresis-purity tyrosinase (TYR) from Ipomoea Aquatica Forsk leaves was obtained through homogenization, buffer soluti on extraction, ammonium sulfate precipitation, DEAE-Sepharose ion exchange chromatography and Superdex-200 gel filtration chromatography. The specific activity of purified TYR was 114.53 U/mg, with a recovery of 11.33% and a purification factor of 99.59. The molecular weights of TYR and its subunit were 77.60 kD and 38.70 kD,respectively. TYR was relatively stable in the range of 25-55 ℃ and pH 6.0-8.0. Its optimum temperature and pH were 45 ℃ and 7.5, respectively. Furthermore, its Kmwas 10.05 mmol/L under the optimum conditions. The activity of TYR could be inhibited by methanol, ethanol, isopropanol and citric acid and ascorbic acid, as well as some metal ions such as Ca2+and Pb2+. It could be activated by Mn2+, Zn2+and Co2+; however, urea and SDS had little effect on its activity, and Li+and K+has no effect on its activity.
Ipomoea aquatica Forsk. leaves; tyrosinase; isolation and purification; characterization
Q946.5
A
1002-6630(2015)15-0167-06
10.7506/spkx1002-6630-201515031
2014-10-30
重庆市科委重点攻关项目(CSTC,2011AB1027)
孙才云(1988—),男,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:suncai1237@126.com
唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn
——蕹菜

