外界环境和食品体系对菊苣酸稳定性的影响
甘 婧,李光辉,封雨晴,夏效东*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
外界环境和食品体系对菊苣酸稳定性的影响
甘 婧,李光辉,封雨晴,夏效东*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
本实验研究pH值、温度、金属离子、紫外线以及不同食品体系(果汁饮料、奶粉和果冻)对菊苣酸稳定性的影响。菊苣酸的含量由高效液相色谱法(high performance liquid chromatography,HPLC)测定。结果表明:随着pH值(3、5、7、9)和温度(60、70、80 ℃)的升高,菊苣酸的稳定性逐渐降低;相同浓度的Na+和K+对菊苣酸的稳定性无显著影响,但Ca2+溶液遇菊苣酸会瞬间发生变色反应;菊苣酸对紫外线敏感度较高,且在甲醇中的异构化率明显高于在水中的异构化率;菊苣酸在果汁饮料中,室温(25 ℃)贮藏3 个月后保存率约为85%,4 ℃贮藏3 个月后含量无明显变化;室温下避光贮藏3 个月,菊苣酸在奶粉和果冻体系中能够保持相对稳定。不同食品体系对菊苣酸稳定性的影响有差异,总体上食品体系能在一定程度上维持菊苣酸的稳定性,保护其免受降解。
菊苣酸;食品环境;稳定性;高效液相色谱法
菊苣酸属咖啡酸衍生物,为紫锥菊中一种重要的活性成分[1-2]。研究表明,菊苣酸具有抗菌、抗病毒、抗癌、抗氧化等特性[3-7],能够保护胶原蛋白Ⅲ免受自由基导致的降解影响[8],抑制HIV-1的复制和HIV-1整合酶活性[9-11],还对胰岛素抵抗、肥胖等代谢疾病具有重要作用[12-15]。
鉴于其重要的生理功能和药理活性,菊苣酸作为许多保健品和药品的重要成分已被应用于提高人体免疫力以及各类疾病的预防和治疗方面[16-18]。市售的含有菊苣酸的保健品大部分是进口的,并以营养液、胶囊、咀嚼片形式为主。与国外菊苣酸产品相比,国内菊苣酸产品类别、数量较少,市场空白较大,且整个市售菊苣酸的产品形式仍比较单一。目前,菊苣酸应用到食品中仍有许多局限性:菊苣酸自身的不稳定性导致其易受环境因素的影响[19-21];食品本身就是一个复杂的体系,水分、糖分、不同的食品添加剂以及添加的其他功能强化性成分等导致了食品不同的物理形态、化学性质;多种多样的食品环境对菊苣酸的稳定性有不同的影响。因此,本实验研究pH值、温度、金属离子和紫外线对菊苣酸稳定性的影响,以及菊苣酸在3 种不同食品环境中的稳定性,为菊苣酸应用到食品中提供一定的理论依据以及更广泛应用的可能。
1 材料与方法
1.1材料与试剂
菊苣酸(纯度≥98%) 成都曼思特生物科技有限公司;果汁饮料(水溶C100柠檬味) 农夫山泉股份有限公司;奶粉 陕西和氏乳品有限公司;果冻 广东喜之郎集团有限公司;磷酸和乙腈为色谱纯试剂;其他均为分析纯试剂。
1.2仪器与设备
LC-20A高效液相色谱仪 日本岛津公司;JA2003电子天平 上海良平仪器仪表有限公司;实验室超纯水机深圳沃尔奇科技有限公司;KQ3200DV型数控超声波清洗器 江苏昆山超声波仪器厂;ST16R台式高速冷冻离心机 美国热电公司;pH计 上海洪纪设备仪器有限公司。
1.3方法
1.3.1pH值对菊苣酸稳定性的影响测定
用HCl和NaOH配制成pH值分别为3、5、7、9的缓冲溶液,分别取15 mL缓冲溶液和1 mL菊苣酸原液(1.2 mg/mL)振荡摇匀,于水浴锅中80 ℃恒温加热,分别在15、40、60、120、180 min时对pH 3、5、7的样品进行取样测定,pH 9的样品于5、20、35、50、65、120、180 min时取样测定。
1.3.2温度对菊苣酸稳定性的影响测定
取15 mL pH 9的缓冲液与1 mL菊苣酸原液(1.2 mg/mL)2 份振荡混匀,分别于60 ℃和70 ℃的水浴锅中恒温加热,于5、20、35、50、65、120 min时取样测定。
1.3.3金属离子对菊苣酸稳定性的影响测定
配制0.5 mol/L的NaCl、KCl、CaCl2溶液,分别取14 mL和1 mL菊苣酸原液(1.2 mg/mL)共3 份振荡混匀,于水浴锅中80 ℃恒温加热,分别于5、20、35、50、65 min时取样测定。
1.3.4紫外线对菊苣酸稳定性的影响
分别将15 mL的甲醇、水与1 mL菊苣酸原液(1.2 mg/mL)振荡混匀,同时置于紫外灯下照射,于15、30、45、60、90、120 min时取样测定。
1.3.5菊苣酸在果汁饮料中的稳定性研究
将29 mL水溶C100饮料与1 mL菊苣酸原液(1.5 mg/mL)振荡混匀,平行6 次。样品分别于室温(25 ℃)和4 ℃条件下贮藏。室温条件下贮藏的样品于第1、3、6、11、18、24、32、39、48、67、83、96天时平行取样,4 ℃条件下贮藏的样品于第1、8、15、22、29、39、48、67、83、96天时平行取样,于1.5 mL离心管中-80 ℃条件下保存,在96 d后统一上机测定。
1.3.6菊苣酸在奶粉中的稳定性研究
每个样品由(2.0±0.1)mg菊苣酸与1 g奶粉混合,在室温(25 ℃)条件下密封避光保存,第1、8、15、 22、29、39、48、67、83、96天时平行处理3 个样品。先加入40 mL 70%的甲醇提取,振荡后静置,再于冷冻离心机中以转速9 000 r/min,4 ℃条件下离心10 min,取上清液于1.5 mL离心管中-80 ℃条件下保存。
1.3.7菊苣酸在果冻中的稳定性研究
利用微波加热溶解果冻15 mL与1 mL菊苣酸原液(0.75 mg/mL)振荡混匀后降温凝固。30 个样品在室温(25 ℃)条件下密封避光保存,第1、8、15、22、29、39、48、67、83、96天时平行处理,将果冻捣碎后加入15 mL 70%的甲醇提取,振荡后静置,再于冷冻离心机中以5 000 r/min转速,4 ℃条件下离心10 min,取上清液于1.5 mL离心管中-80 ℃条件下保存。
1.3.8稳定性测定方法
1.3.8.1高效液相色谱(high performance liquid chromatography,HPLC)条件
色谱柱:Venusil XBP-C18色谱柱(4.6 mm× 250 mm,5 μm);流动相A(0.5%磷酸-水溶液)和流动相B(乙腈)低压等度洗脱;总流速:1 mL/min,流动相B体积分数为18%;检测时间:20 min;荧光检测波长:326 nm;柱温:30 ℃;进样量:20 μL。
1.3.8.2标准曲线的绘制
称取菊苣酸5.8 mg溶解到20 mL体积分数70%甲醇中,得到质量浓度为0.29 mg/mL的原液。分别取0.25、0.5、2、3.5、5 mL原液于试管中,用70%甲醇定容至5 mL,过0.45 μm有机系滤膜上机测定。以菊苣酸的质量浓度(mg/mL)为横坐标,峰面积为纵坐标绘制标准曲线,得到回归方程为y = 3.6×107x-35 163(R2= 1.000 0)。结果表明,菊苣酸质量浓度在0.014 5~0.29 mg/mL时与峰面积成良好的线性关系。
1.4数据处理
2 结果与分析
2.1pH值对菊苣酸稳定性的影响
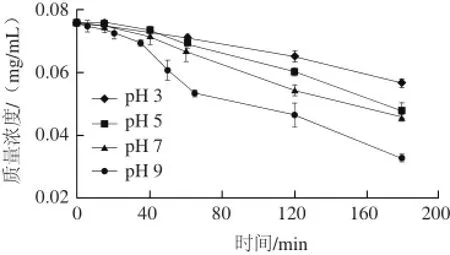
图1 不同pH值条件下菊苣酸质量浓度变化Fig.1 Variation in cichoric acid concentration in aqueous solution at different pH levels (3, 5, 7 and 9)
由图1可知,在80 ℃的水浴中恒温加热3 h,菊苣酸在pH值为3的缓冲液中保存率为(74.6±1.8)%,在pH值为9时保存率为(43.0±1.5)%,差异显著(P<0.05)。说明不同pH值缓冲液对菊苣酸的稳定性影响差异较大,菊苣酸在强酸性环境中的降解速率低于在弱碱性环境中的降解速率。通过分析强酸和弱碱性条件下分解产物的色谱图和质谱图说明,菊苣酸在酸性环境下发生水解反应生成咖啡酸,但在弱碱性环境中菊苣酸的分解产物复杂,机理仍有待研究[22]。将菊苣酸应用到食品中时应考虑到液体环境或者冲调后环境的酸碱性,探寻特定食品环境中菊苣酸保持稳定的最佳条件。
2.2温度对菊苣酸稳定性的影响

图2 不同温度条件下菊苣酸质量浓度变化Fig.2 Variation in cichoric acid concentration in aqueous solution at different temperatures
由图2可知,pH 9的菊苣酸水溶液在不同温度(60、70、80 ℃)条件下加热2 h后,60 ℃条件下菊苣酸的保存率为(92.0±0.7)%,而80 ℃条件下菊苣酸的保存率仅为(61.8±3.2)%,差异显著(P<0.05)。说明高温导致菊苣酸加速降解,低温有利于菊苣酸保持稳定。已有研究[23-24]表明,菊苣酸在水溶液中的热不稳定性主要是由水解作用导致的,且水解反应是吸热过程,温度的升高加速了菊苣酸水解为咖啡酒石酸和咖啡酸。又由于固态的菊苣酸在加热条件下非常稳定[24],当菊苣酸应用到食品中时则应考虑菊苣酸的添加形态,以及灭菌等高温操作的工艺条件是否会导致菊苣酸的降解。
2.3金属离子对菊苣酸稳定性的影响

图3 Na 3 Na+和KK+对菊苣酸质量浓度的影响Fig.3 Variation in cichoric acid concentration in aqueous solution containing Na+or K+
由图3可知,80 ℃水浴加热65 min后,KCl溶液中菊苣酸保存率为(97.02±0.01)%,NaCl溶液中菊苣酸保存率为(94.37±0.05)%,降解速率基本相同,无显著差异(P>0.05)。本实验还将菊苣酸添加到CaCl2溶液中,发现菊苣酸使无色的CaCl2溶液瞬间变成黄色,且在后续的实验中无法检测到菊苣酸。以上结果表明,Na+和K+不与菊苣酸反应;但菊苣酸与CaCl2溶液反应非常迅速,溶液变黄机理还有待进一步探究。食品体系的复杂性导致了多种金属离子混合的情况,Ca2+等其他金属离子可能对菊苣酸产生较大的影响。当菊苣酸应用到食品中时则应考虑液体食品环境或者冲调后的环境中存在的金属离子对菊苣酸的影响,避免发生反应而导致菊苣酸的降解以及食品品质等方面的变化。
2.4紫外线对菊苣酸稳定性的影响
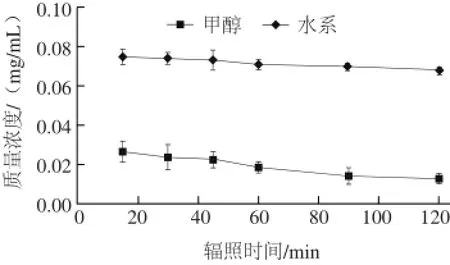
图4 紫外线辐照下菊苣酸质量浓度变化Fig.4 Variation in cichoric acid concentration in two different solvents(water and methanol) under UV (253.7 nm)

图5 紫外线辐照下菊苣酸异构体质量浓度变化Fig.5 Variation in cichoric acid isomer concentration in two different solvents (water and methanol) under UV (253.7 nm)
由图4可知,紫外线(253.7 nm)下辐照2 h后,甲醇中菊苣酸保存率仅有(46.39±0.15)%,水中菊苣酸保存率为(94.27±0.06)%,差异显著(P<0.05)。如图5所示,菊苣酸异构体的含量随着辐照时间的延长而升高,2 h后甲醇中菊苣酸的质量浓度达到(0.015 3±0.001 1)mg/mL,水中菊苣酸的质量浓度仅为(0.007 1±0.000 7)mg/mL,两者菊苣酸异构体质量浓度比大约为2∶1,差异显著(P<0.05)。结果表明,甲醇中的菊苣酸更容易受紫外线的影响,异构化成内消旋菊苣酸[25],且因甲醇极性比水小,菊苣酸异构转化率更高。当菊苣酸应用到食品中时,则应考虑到菊苣酸溶解后对紫外线的敏感度较高,工艺中应减少其与紫外线的接触。
2.5菊苣酸在果汁饮料中的稳定性

图6 不同贮藏温度饮料中菊苣酸质量浓度变化Fig.6 Variation in cichoric acid concentration in beverage during 3 months of storage at 4 and 25 ℃
由图6可知,室温(25 ℃)条件下贮藏3 个月,果汁饮料中菊苣酸的保存率为(85.46±0.01)%,而4 ℃条件下贮藏3 个月,菊苣酸质量浓度在(0.026 8±0.000 6)~(0.028 5±0.000 2)mg/mL小范围内波动,无明显的下降趋势。说明低温贮藏比室温更有利于菊苣酸保持稳定;且室温(25 ℃)条件下水溶液中菊苣酸15 d后基本上完全分解[24],说明饮料体系能一定程度上保护菊苣酸免受降解。果汁饮料体系本身是非常复杂的,且饮料中标明445 mL的体系中添加了100 mg VC,具有抗氧化作用,可对菊苣酸起到一定程度的保护作用,因而即便放置3 个月菊苣酸的质量浓度仍处于较高的水平。实验结果为菊苣酸添加到饮料中提供了可能。
2.6菊苣酸在奶粉中的稳定性

图7 奶粉中菊苣酸质量浓度变化Fig.7 Variation of cichoric acid in milk powder during 3 months of storage at 25 ℃
由图7可知,3 个月贮藏期内奶粉中菊苣酸质量浓度在(0.016±0.009)~(0.031±0.005) mg/mL范围内波动,无明显的下降趋势。考虑到奶粉体系为固体颗粒状,在样品处理阶段,菊苣酸的损失率较大,导致了数据不同程度的波动。总体来看,奶粉作为具有代表性的固体食品环境,各个成分在水分活度非常小、隔绝空气水蒸气、避光环境下是相对稳定的,缺乏导致菊苣酸降解的环境因素,因而菊苣酸的质量浓度变化不受时间以及奶粉体系的影响,在干燥封闭、室温条件下贮藏,菊苣酸在奶粉体系中能保持相对稳定。实验结果为菊苣酸添加到与奶粉类似食品体系中提供了可能。
2.7菊苣酸在果冻中的稳定性

图8 果冻中菊苣酸质量浓度变化Fig.8 Variation in cichoric acid concentration in jelly during 3 months of storage at 25 ℃
由图8可知,3 个月贮藏期内果冻中菊苣酸质量浓度在(0.025±0.001)~(0.038±0.002) mg/mL内波动,无明显下降趋势,质量浓度依然维持在较高水平。果冻体系本身是非常稳定的,其水分活度很小,菊苣酸在这样一个相对封闭的条件下贮藏,隔绝了氧气和水蒸气,能够长期保持稳定。而检测数据轻微的波动可能是由样品处理时的误差引起的。实验结果为菊苣酸添加到胶状食品体系中提供了可能。
3 结 论
菊苣酸在碱性条件下比在酸性条件下更易发生降解,pH 3时最稳定;高温比低温更易使菊苣酸发生降解,低温有助于菊苣酸维持自身稳定;菊苣酸水溶液能与无色的CaCl2溶液反应瞬间变成黄色,机理还有待探究;NaCl、KCl对菊苣酸稳定性没有显著影响;菊苣酸对紫外线非常敏感,且在甲醇中的异构化率明显高于水中。
果汁饮料的食品环境在很大程度上能保护菊苣酸免受降解,并且低温贮藏更有易于菊苣酸维持在饮料中的稳定性;奶粉食品体系自身的稳定性有助于菊苣酸保持稳定;果冻体系的胶体特性也能一定程度上保护菊苣酸免受降解,菊苣酸质量浓度能够长时间维持较高的水平。实验结果为菊苣酸应用到食品体系中提供了可能。
[1] LIM T K. Echinacea purpurea, edible medicinal and non-medicinal plants[M]. Berlin: Springer Netherlands, 2014: 340-371.
[2] 刘晓琳, 郭世宁, 黎建华, 等. 紫锥菊的药理作用和临床应用[J]. 黑龙江畜牧兽医, 2007(6): 83-85.
[3] 陆英. 紫锥菊、紫甘薯中活性成分高效制备技术及紫锥菊生物活性研究[D]. 长沙: 湖南农业大学, 2012.
[4] ZHANG Hongli, DAI Linghao, WU Yihang, et al. Evaluation of hepatocyteprotective and anti-hepatitis B virus properties of cichoric acid from Cichorium intybus leaves in cell culture[J]. Biological and Pharmaceutical Bulletin, 2014, 37(7): 1214-1220.
[5] THYGESEN L, THULIN J, MORTENSEN A, et al. Antioxidant activity of cichoric acid and alkamides from Echinacea purpurea,alone and in combination[J]. Food Chemistry, 2007, 101(1): 74-81.
[6] DALBY B L, BARSETT H, LANDBO A K R, et al. Synergistic antioxidative effects of alkamides, caffeic acid derivatives, and polysaccharide fractions from Echinacea purpurea on in vitro oxidation of human low-density lipoproteins[J]. Journal of Agricultural and Food Chemistry, 2005, 53(24): 9413-9423.
[7] 江玲. 紫花松果菊菊苣酸提取与生物活性研究[D]. 合肥: 安徽农业大学, 2013.
[8] SOICKE H, HASSAN G, GORLER K, et al. Further derivatives of caffeic acid from Echinacea purpurea[J]. Planta Medica, 1988, 54(2):175-176.
[9] ROBINSON J E. L-chicoric acid, an inhibitor of human immunodeficiency virus type 1 (HIV-1) integrase, improves on the in vitro anti-HIV-1 effect of zidovudine plus a protease inhibitor(AG1350)[J]. Antiviral Research, 1998, 39(2): 101-111.
[10] LIN Zhaiwei, NEAMATI N, ZHAO He, et al. Chicoric acid analogues as HIV-1 integrase inhibitors[J]. Journal of Medicinal Chemistry,1999, 42(8): 1401-1414.
[11] 胡建平, 常珊, 陈慰祖, 等. HIV-1整合酶与抑制剂LCA的结合模式及抗药性研究[J]. 中国科学: B辑 化学, 2007, 37(3): 279-287.
[12] TOUSCH D, LAJOIX A D, HOSY E, et al. Chicoric acid, a new compound able to enhance insulin release and glucose uptake[J]. Biochemical and Biophysical Research Communications, 2008,377(1): 131-135.
[13] 潘志生, 许志臻, 陈苓曦, 等. 菊苣酸在HepG2细胞中对SOSC3表达的调节作用[J]. 重庆师范大学学报: 自然科学版, 2012, 29(6): 75-79.
[14] 肖海芳, 袁莉, 王静, 等. 菊苣酸下调3T3-L1前脂肪细胞中PGC-1α及FoxO4蛋白表达[J]. 食品科学, 2013, 34(21): 297-301. doi: 10.7506/ spkx1002-6630-201321059.
[15] CASANOVA L M, SILVA D, SOLA P M, et al. Identification of chicoric acid as a hypoglycemic agent from Ocimum gratissimum leaf extract in a biomonitoring in vivo study[J]. Fitoterapia, 2014, 93: 132-141.
[16] KOUR K, BANI S. Augmentation of immune response by chicoric acid through the modulation of CD28/CTLA-4 and Th1 pathway in chronically stressed mice[J]. Neuropharmacology, 2011, 60(6): 852-860.
[17] 潘竟林. 中草药活性成分清除过氧亚硝酸的研究及抗氧化保健品的研制[D]. 北京: 北京工业大学, 2009.
[18] 刘雪莲. 引种紫锥菊免疫调节作用研究[D]. 成都: 成都中医药大学, 2006.
[19] STUART D L, WILLS R B. Effect of drying temperature on alkylamide and cichoric acid concentrations of Echinacea purpurea[J]. Journal of Agricultural and Food Chemistry, 2003, 51(6): 1608-1610.
[20] BERGERON C, GAFNER S, BATCHA L L, et al. Stabilization of caffeic acid derivatives in Echinacea purpurea L. glycerin extract[J]. Journal of Agricultural and Food Chemistry, 2002, 50(14): 3967-3970.
[21] KIM H O, DURANCE T D, SCAMAN C H, et al. Retention of caffeic acid derivatives in dried Echinacea purpurea[J]. Journal of Agricultural and Food Chemistry, 2000, 48(9): 4182-4186.
[22] 谷彦丽. 穿心莲内酯制剂质量控制、体内代谢及菊苣酸体外稳定性研究[D]. 长沙: 湖南师范大学, 2007.
[23] LIVESEY J, AWANG D V C, AMSON J T, et al. Effect of temperature on stability of marker constituents in Echinacea purpurea root formulations[J]. Phytomedicine, 1999, 6(5): 347-349.
[24] 谢继国. 菊苣酸化学稳定性及其异构体的色谱分离分析研究[D]. 长沙: 湖南师范大学, 2009.
[25] 谢继国, 陈波, 郭建伟, 等. L-菊苣酸在不同溶剂中的光致差向异构化[J]. 天然产物研究与开发, 2010, 22(4): 630-633.
Stability of Cichoric Acid Influenced by Different Physical Factors and Food Environments
GAN Jing, LI Guanghui, FENG Yuqing, XIA Xiaodong*
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
This research was aimed to determine the stability of cichoric acid when it was added to different food environments (juice, beverage, milk powder and jelly) during 3 months of storage, and investigate the influences of pH(3, 5, 7 and 9), temperature (60, 70 and 80 ℃), metal ions (Na+, K+and Ca2+) and ultraviolet (253.7 nm) on the stability of cichoric acid. HPLC was used to measure the content of cichoric acid. The results showed that cichoric acid became more and more unstable as pH and temperature went up; the influences of Na+and K+at the same concentrations on the stability of cichoric acid were not significantly different, but exposure of cichoric acid to Ca2+caused an instantaneous color change;ultraviolet rays led to stronger degradation of cichoric acid in methanol than in water; in fruit drinks for 3 months, cichoric acid remained 85% of its original level when stored at 25 ℃, but it was relatively stable at 4 ℃, and also had a relatively god stability in milk powder and jelly during the storage period.
cichoric acid; food environment; stability; high performance liquid chromatography (HPLC)
TS201
A
1002-6630(2015)15-0024-05
10.7506/spkx1002-6630-201515006
2014-10-16
“十二五”国家科技支撑计划项目(2012BAH30F03);国家自然科学基金青年科学基金项目(31101347)
甘婧(1992—),女,硕士研究生,研究方向为食品科学。E-mail:gggaan92@163.com
夏效东(1981—),男,教授,博士,研究方向为食品安全与营养。E-mail:xdxia@nwsuaf.edu.cn

