柠檬烯的安全性研究进展
黄巧娟,黄林华,孙志高*,郝静梅,郭 莉
(西南大学柑桔研究所,重庆 400712)
柠檬烯的安全性研究进展
黄巧娟,黄林华,孙志高*,郝静梅,郭 莉
(西南大学柑桔研究所,重庆 400712)
柠檬烯是柑橘类水果精油的主要成分,由于其具有抑菌、抗癌等多种生理功能,被广泛应用于食品、药品等行业中。本文综述近些年关于柠檬烯安全性的研究,包括柠檬烯的毒理学评价、遗传毒性、细胞毒性及其对人、动物及环境的影响,以期为柠檬烯有效、安全利用提供参考。
柠檬烯;安全性;毒性
柠檬烯又称苧烯、苎烯,其结构式如图1所示,是一种单萜烯化合物。柠檬烯有3 种异构体,即D-柠檬烯、L-柠檬烯和DL-柠檬烯,一般以D-柠檬烯的形式存在。由于柠檬烯具有抑菌、增香、抗癌、止咳、平喘等生理功能,已被广泛应用于食品、香料、日化、医药等行业[1]。此外,柠檬烯具有较强的溶解能力,可作为烷烃类替代剂应用到油脂等成分的提取当中[2-4]。
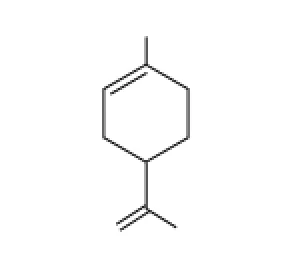
图1 柠檬烯的结构式Fig.1 Structure of limonene
有关柠檬烯安全性研究的报道,与国内相比,国外研究较多。Langman等[5]综述了D-柠檬烯的吸收、代谢、排泄情况及D-柠檬烯对人体及动物的影响,他们认为尽管D-柠檬烯具有一定的危害,但其作为绿色有机溶剂替代烷烃类化合物仍具有很大的发展前景。20世纪90年代国际癌症研究机构(International Agency for Research on Cancer,IARC)及世界卫生组织(World Health Organization,WHO)对D-柠檬烯的安全性及抗癌特性进行了综合评价,发现柠檬烯无基因、免疫及生殖毒性,仅对成年雄性大鼠具有致癌作用,而对其他动物及人类无致癌性[6-7]。Kim等[8]也综述了D-柠檬烯的安全性并对其进行了风险评估,得出D-柠檬烯的极限暴露比(margin of exposure,MOE)为169,危害指数(hazard index,HI)为0.592,并认为D-柠檬烯虽对皮肤具有一定的刺激性,但合理使用仍可应用于化妆品中。对于柠檬烯安全性的研究已有较长时间,本文综述近些年人们对柠檬烯安全性的研究,以期为柠檬烯的安全使用提供一定参考。
1 柠檬烯吸收及代谢特点
早在20世纪50年代,研究者就已开始对柠檬烯的吸收、分布、代谢等情况进行了研究。在不同的物种间,柠檬烯的吸收差异很大,且不同的给药方式也影响柠檬烯的吸收。柠檬烯经口摄入能被胃肠道迅速吸收[9],Api等[10]利用14C同位素示踪法研究了柠檬烯在大鼠和人体皮肤中的吸收情况,发现柠檬烯在大鼠皮肤中的吸收量接近12%,而在人皮肤中吸收量不到1%。进入机体的柠檬烯及其代谢产物紫苏酸均具有很高的生物利用度,能被机体很快吸收利用[11-12]。D-柠檬烯在人体和动物中分布广泛,主要分布于血浆、肾脏及肝脏中,且一段时间后几乎全部消失,不会在体内积累[9,13]。
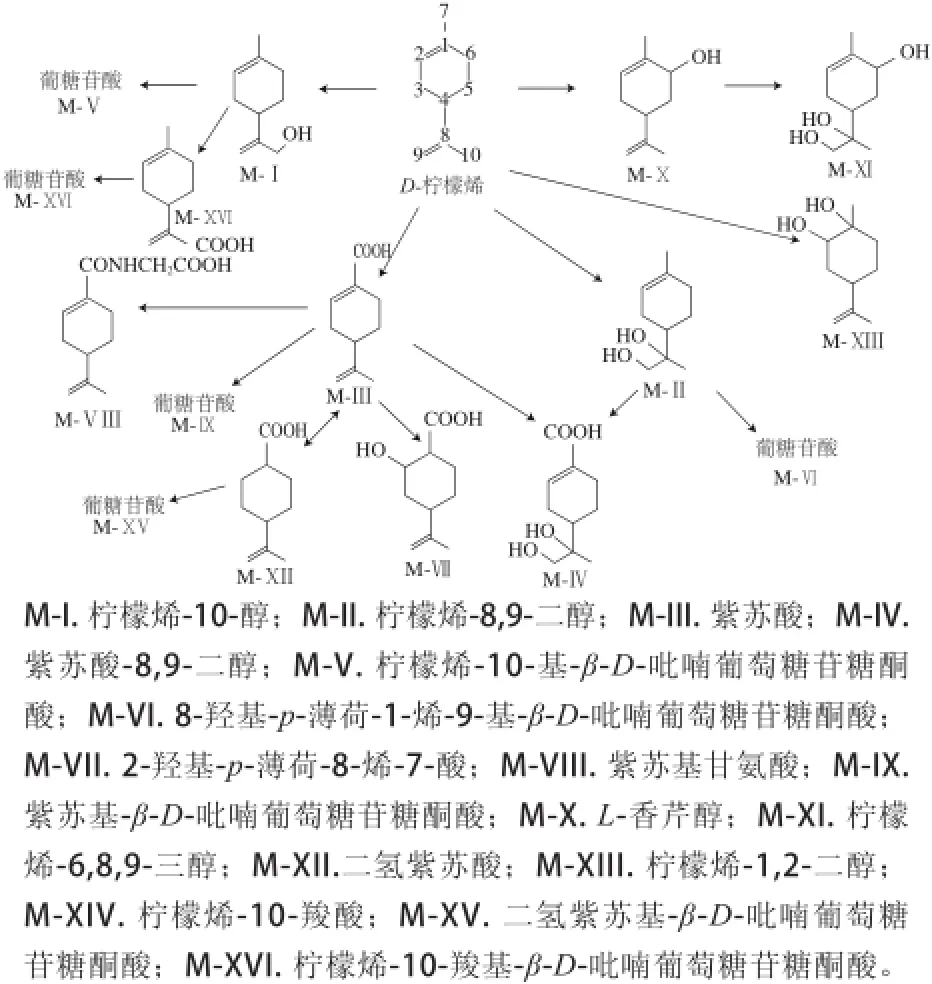
图2 柠檬烯的代谢途径[144--1166]Fig.2 Metabolic pathway of limonene[14-16]
柠檬烯的生物转化过程主要为甲基基团氧化为羟基,进一步反应生成羧酸衍生物。羟基化反应发生在C6位置上,氧化反应发生在碳碳双键上。此外,甘氨酸及葡糖醛酸与柠檬烯发生结合反应。D-柠檬烯在哺乳动物及人体中可能的分解代谢途径主要有5 条,如图2所示[14-16]。途径1:柠檬烯C6位置发生氧化及环氧化作用,生成柠檬烯-6,8,9-三醇;途径2:柠檬烯C10位置发生氧化作用,接着进一步氧化或与葡萄糖醛酸结合生成相应的葡糖苷酸;途径3:柠檬烯代谢为紫苏酸,紫苏酸可以直接排出体外,或者在尿液中结合甘氨酸及葡萄糖醛酸生成相应的葡糖苷酸,或者进一步氧化成紫苏酸-8,9-二醇,或者经水合或加氢生成2-羟基-p-薄荷-8-烯-7-酸及二氢紫苏酸,后者与葡萄糖醛酸结合生成相应的葡糖苷酸;途径4:柠檬烯1,2-双键经环氧化及水合作用生成柠檬烯-1,2-二醇;途径5:柠檬烯8,9-双键进行环氧化作用生成柠檬烯-8,9-二醇,并进一步与葡萄糖醛酸结合生成相应的葡糖苷酸。柠檬烯的代谢产物主要为血浆代谢产物,在大鼠血浆中主要为紫苏酸及二氢紫苏酸,在人体血浆中除以上两种物质外还有柠檬烯-1,2-二醇[16]。尽管大部分的代谢产物都已在各物种中被检验出,但各物种的代谢途径却存在差异:柠檬烯在大鼠体内的代谢主要是通过紫苏酸代谢为紫苏酸-8,9-二醇,此外,柠檬烯在大鼠体内还通过其他途径进行小部分代谢,如通过途径1、途径2及途径5进行代谢;仓鼠中柠檬烯主要是通过紫苏酸代谢为葡糖苷酸,但其生成紫苏酸-8,9-二醇的途径较弱;兔子体内柠檬烯主要经紫苏酸生成紫苏酸-8,9-二醇;豚鼠体内柠檬烯主要经紫苏酸生成紫苏基甘氨酸及经柠檬烯-8,9-二醇生成葡糖苷酸;对于柠檬烯在狗及人体内的代谢情况,研究者有不同的观点,Kodama等[14]认为柠檬烯代谢为柠檬烯-8,9-二醇及其衍生物,而另有研究者[15]认为柠檬烯在人体中主要代谢为紫苏酸及其衍生物。不同物种中柠檬烯的排泄方式相似,大部分都随尿液、气体等排出,少部分随粪便排出[9-11]。
2 柠檬烯安全性研究
2.1柠檬烯的毒理学评价
2.1.1急性毒性
Opdyke等[17]给大鼠口服柠檬烯,结果测得LD50为5.3 g/kg,属于实际无毒级。柠檬烯的急性毒性实验中不同给药方式下的LD50如表1所示。其中,大鼠口服及兔子皮肤接触柠檬烯的LD50为5 g/kg左右;小鼠口服柠檬烯的LD50为6 g/kg左右,表明柠檬烯对龋齿类动物具有极低的毒性。
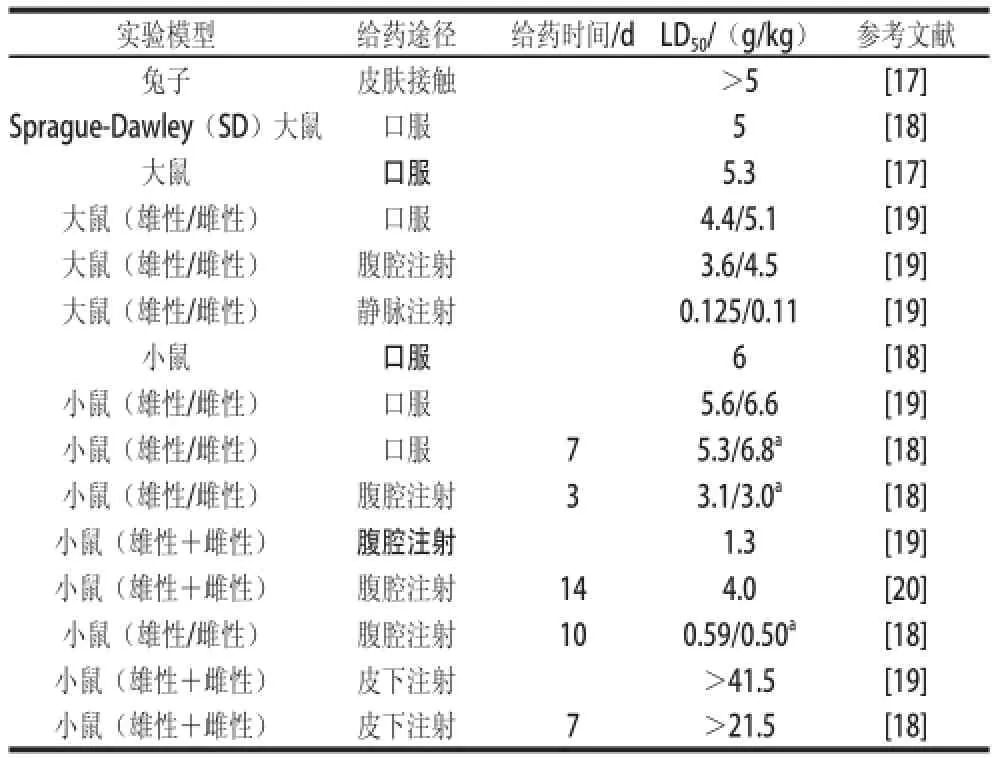
表1 柠檬烯的急性毒性评价Table 1 Acute toxicity assessment of limonene
2.1.2亚慢性及慢性毒性
关于柠檬烯的亚慢性及慢性毒性研究,主要集中在20世纪70-90年代。柠檬烯对各龋齿类动物的亚慢性及慢性毒性实验结果如表2所示,柠檬烯作用的靶器官主要为实验动物的肝脏及肾脏。在给药一段时间后,实验动物肝脏及肾脏的质量、肝脏中的酶活性、胆汁分泌、胆固醇水平等会有相应的变化。

表2 柠檬烯的亚慢性及慢性毒性评价Table 2 Subchronic and chronic toxicity assessment of limonene
在柠檬烯的慢性毒性研究中,很多研究者发现柠檬烯只对雄性大鼠具有肾毒性,甚至导致肾癌,他们认为这是因为柠檬烯通过刺激透明液滴的形成,进而促进雄性大鼠体内特异性α2u-球蛋白的积累,最终导致癌症发生[21-23]。但最近Mauro等[24]采用仓鼠细胞V79对D-柠檬烯进行安全性实验,发现D-柠檬烯作用的靶细胞为有丝分裂纺锤体微管,暴露的D-柠檬烯通过影响细胞分裂中纺锤体的形成导致细胞死亡,且其对细胞的毒性作用呈剂量依赖关系。因此,柠檬烯是否对雄性大鼠以外的物种致癌,还有待深入研究。
2.2其他毒性
2.2.1遗传毒性
WHO对柠檬烯进行安全性评价时,未发现其具有遗传毒性。美国国家毒理学规划处[23]研究柠檬烯的遗传毒性时,选用鼠伤寒沙门氏菌、小鼠L5178细胞及仓鼠卵巢细胞进行实验,结果发现D-柠檬烯对鼠伤寒沙门氏菌(TA98、TA100、TA1535、TA1537)没有致突变性;在小鼠L5178Y细胞中没有增加三氟胸苷耐药细胞的数量;在仓鼠卵巢细胞中未导致染色体畸变及姐妹染色单体交换。Sekihashi等[28]进行彗星实验比较了各种药物对小鼠和大鼠的关键器官的影响,未观察到D-柠檬烯引起任何器官DNA损伤。但近年来的一些研究却表明柠檬烯具有一定的遗传毒性。López等[29]在研究精油对大肠杆菌PQ37的遗传毒性时,发现其主要成分柠檬烯的含量在97~1 549 mmol/L时对PQ37具有遗传毒性,然而这一结果并未在动物及人体中得到验证。Saverini等[30]通过Ames实验和彗星实验研究柑橘废水中α-蒎烯、β-蒎烯、蒈烯、柠檬烯等萜烯对原核及真核细胞的遗传毒性,Ames实验结果显示此4 种萜烯单独作用未增加沙门氏菌TA100菌株的回复突变率,而4 种萜烯相结合则会增加回复突变率。彗星实验结果显示这几种萜烯类单独或混合处理仓鼠V79细胞1 h,能增加V79细胞DNA的损伤。这是首次报道萜烯类破坏DNA的实验,但该实验并未证明这些萜烯是直接还是间接地对DNA造成影响。
2.2.2细胞毒性
柠檬烯具有抗癌作用,原因之一是它对肿瘤细胞具有细胞毒性[31]。但柠檬烯对肿瘤细胞的毒性作用机理研究还不透彻,它是否对正常细胞具有毒性作用还不能确定。Mendanha等[32]利用四甲基偶氮唑蓝法对比研究了主要萜烯类对成纤维细胞的毒性及溶血性等,结果表明相对于其他萜烯,柠檬烯具有极低的细胞毒性、细胞膜攻击性及溶血性,且他们认为柠檬烯、桉树脑等萜烯能较好地促进极性及非极性的药物渗入皮肤。而Vajrabhaya等[33]研究柠檬烯及三氯甲烷等溶剂对小鼠成纤维细胞L929的毒性实验中发现:在溶剂稀释倍数为100 倍及400 倍时,三氯甲烷及柠檬烯处理细胞后,细胞的存活率相似(柠檬烯组为46.69%,三氯甲烷组为46.20%),但当溶剂稀释倍数为800 倍时,柠檬烯组的活细胞数(97.07%)相对三氯甲烷组(126.53%)反而更少。
2.3柠檬烯长期 暴露的安全性
2.3.1柠檬烯暴露对动物及人体的影响
纯净的柠檬烯对人体及动物几乎没有影响,而其在暴露的情况下易与氧气(O2)、臭氧(O3)、氮氧化合物(NOx)等物质反应,从而对动物、人体及环境造成一定的影响[34],如柠檬烯对皮肤的刺激性是由柠檬烯与氧结合后所引起的[35-37]。Matura等[38]调查了2 273 名皮炎病人对氧化后的D-柠檬烯的过敏频率,并对被氧化的D-柠檬烯进行补丁测试,结果发现共有63 名皮炎病人补丁测试呈阳性反应,即氧化的柠檬烯对皮肤有增敏作用。此后Matura等[39]又证明氧化的(S)-(-)-柠檬烯也会造成皮炎病人的过敏性反应。此外,柠檬烯氧化物常对人和动物的神经系统产生作用,并影响其他器官的反应,如柠檬烯氧化物能刺激人的三叉神经,且在臭氧存在下会对人眼造成刺激[40]。
柠檬烯和臭氧反应能形成气溶胶及超微颗粒,从而对动物的肺部及呼吸道产生不良影响[41]。Wolkoff等[42]认为D-柠檬烯和臭氧反应产生的甲醛和残余的D-柠檬烯是造成人的上呼吸道和肺部伤害的主要原因,而产生的超细颗粒则对呼吸道无明显影响。Rolseth等[34]研究表明暴露情况下柠檬烯浓度为100 μmmol/L时,对细胞没有不利作用,只有当柠檬烯的浓度达500 μmmol/L时,才会对人体肺部细胞造成毒害作用,即柠檬烯的浓度对肺部细胞的毒性起到关键作用。
2.3.2柠檬烯暴露对环境的影响
二次有机气溶胶(secondary organic aerosols,SOA)是大气中挥发性有机物与相关氧化剂(O3、·OH、·ONOO等)发生大气氧化反应,并经气粒分配形成悬浮于大气中的固体或液体颗粒[43]。SOA是灰霾气候形成的原因之一,柠檬烯作为主要单萜烯,其在室内空气中每月的平均质量浓度为227~513 μg/m3,是形成SOA的重要生物源[44]。Maksymiuk等[45]研究柠檬烯形成SOA的机理,发现在低浓度NOx存在的条件下,SOA主要是由残余的不饱和物通过非均匀地吸收臭氧而氧化形成的。Walser等[46]研究表明,D-柠檬烯在臭氧环境中会产生SOA,进一步产生甲醛,且臭氧分解柠檬烯产生的羰基化合物和过氧化物能吸收紫外光。因此,在工业生产中应尽量避免由于柠檬烯过度暴露而带来的不良影响。
3 结 语
柠檬烯作为一种单萜烯化合物,是柑橘类水果精油中主要的生物活性物质。柠檬烯在人体及动物组织中代谢迅速,经口摄入几乎能被机体完全吸收与利用,在尿液中的代谢产物主要为柠檬烯的醇类物质及柠檬烯与甘氨酸、葡萄糖醛酸的结合物质等。
近些年对柠檬烯安全性的研究尚未发现其对人体健康有明显影响,因此,柠檬烯通常被认为可安全运用到食品、化工、医药等行业中。GB 2760—2011《食品安全国家标准 食品添加剂使用标准》已规定D-柠檬烯为允许使用的香料之一,同时D-柠檬烯也是规定中允许使用的柠檬油萜烯和甜橙油萜烯的主要成分。联合国粮食与农业组织(Food and Agriculture Organization,FAO)/ WHO对D-柠檬烯每日允许摄入量未做限制性规定,且认为在目前的食用量下(欧洲:660 μg/(kg·d);美国:210 μg/(kg·d)),D-柠檬烯没有安全性问题[47-48]。目前国家食品药品监督管理局已批准了部分柠檬烯为主要成分的药物,如柠檬烯:国药准字H51023440;柠檬烯胶囊:国药准字H20094075、H20066154、H51023345、H51023297、H51023597等。
柠檬烯在食品、药品领域的应用已较为广泛,并得到相关部门的许可,但研究者对于柠檬烯的安全性仍存在不同的观点,如:柠檬烯是否具有遗传毒性、致癌性、细胞毒性等尚存争议。此外,空气中暴露的柠檬烯因与氧气等发生化学反应,其产物会对人体、动物及环境造成一定的影响。这些研究结果也应引起足够重视。因此,后续研究仍需对柠檬烯的安全性进行更广泛而深入的研究,进一步论证其潜在危害,为柠檬烯的风险评估提供依据,从而促进柠檬烯更加安全合理地应用到工业生产中。
[1] 王伟江. 天然活性单萜: 柠檬烯的研究进展[J]. 中国食品添加剂,2005(1): 33-37.
[2] MOHAMMAD A. Green solvents I: properties and applications in chemistry[M]. Germany: Springer Science & Business Media, 2012:175-186.
[3] FAURE K, BOUJU E, SUCHET P, et al. Use of limonene in countercurrent chromatography: a green alkane substitute[J]. Analytical Chemistry, 2013, 85(9): 4644-4650.
[4] TANZI C D, VIAN M A, CHEMAT F. New procedure for extraction of algal lipids from wet biomass: a green clean and scalable process[J]. Bioresource Technology, 2013, 134: 271-275.
[5] LANGMAN J M. d-Limonene: is it a safe, effective alternative to xylene?[J]. Journal of Histotechnology, 1995, 18(2): 131-137.
[6] International Agency for Research on Cancer. Monographs on the evaluation of carcinogenic risk to humans vol. 73[M]. Geneva: World Health Organization, 1999: 135-162.
[7] World Health Organization. Concise international chemical assessment document (5. Limonene)[R]. Geneva: WHO, 1998.
[8] KIM Y W, KIM M J, CHUNG B Y, et al. Safety evaluation and risk assessment of d-limonene[J]. Journal of Toxicology and Environmental Health, Part B: Critical Reviews, 2013, 16(1): 17-38.
[9] IGIMI H, NISHIMURA M, KODAMA R, et al. Studies on the metabolism of d-limonene (p-mentha-1,8-diene). I. The absorption,distribution and excretion of d-limonene in rats[J]. Xenobiotica, 1974,4(2): 77-84.
[10] API A M, RITACCO G, HAWKINS D R. The fate of dermally applied [14C] d-limonene in rats and humans[J]. International Journal of Toxicology, 2013, 32(2): 130-135.
[11] CHOW H H S, SALAZAR D, HAKIM I A. Pharmacokinetics of perillic acid in humans after a single dose administration of a citrus preparation rich in d-limonene content[J]. Cancer Epidemiology Biomarkers & Prevention, 2002, 11(11): 1472-1476.
[12] MILLER J A, THOMPSON P A, HAKIM I A, et al. Safety and feasibility of topical application of limonene as a massage oil to the breast[J]. Journal of Cancer Therapy, 2013, 3(5): 1-10.
[13] CROWELL P L, LIN Shouzhong, VEDEJS E, et al. Identification of circulating metabolites of the antitumor agent d-limonene capable of inhibiting protein isoprenylation and cell growth[J]. Cancer Chemotherapy and Pharmacology, 1992, 31(3): 205-212.
[14] KODAMA R, YANO T, FURUKAWA K, et al. Studies on the metabolism of d-limonene (p-mentha-1,8-diene). IV. Isolationand characterization of new metabolites and species differences in metabolism[J]. Xenobiotica, 1976, 6(6): 377-389.
[15] World Health Organization. Safety evaluation of certain food additives[R]. Geneva: WHO, 2006.
[16] CROWELL P L, ELSON C E, BAILEY H H, et al. Hum an metabolism of the experimental cancer therapeutic agent d-limonene[J]. Cancer Chemotherapy Pharmacology, 1994, 35(1): 31-37.
[17] OPDYKE D L J. Monographs on fragrance raw materials[J]. Food and Cosmetics Toxicology, 1981, 19(2): 237-254.
[18] TSUJI M, FUJISAKI Y, YAMACHIKA K, et al. Studies on d-limonene, as gallstone solubilizer (I): general pharmacological studies[J]. Oyo Yakuri, 1974, 8(10): 1439-1459.
[19] TSUJI M, FUJISAKI Y, ARIKAWA Y, et al. Studies on d-limonene,as a gallstone solubilizer(III): chronic toxicities in rats[J]. Oyo Yakuri,1975, 9(3): 403-412.
[20] de ALMEIDA A, COSTA J P, de CARVALHO R B, et al. Evaluation of acute toxicity of a natural compound (+)-limonene epoxide and its anxiolytic-like action[J]. Brain Research, 2012, 1448: 56-62.
[21] KANERVA R L, RIDDER G M, LEFEVER F R, et al. Comparison of shortterm renal effects due to oral administration of decalin or d-limonene in young adult male Fischer-344 rats[J]. Food and Chemical Toxicology, 1987, 25(5): 345-353.
[22] WEBB D, RIDDER G, ALDEN C. Acute and subchronic nephrotoxicity of d-limonene in Fischer 344 rats[J]. Food and Chemical Toxicology, 1989, 27(10): 639-649.
[23] National Toxicology Program. Toxicology and carcinogenesis studies of d-limonene (CAS No. 5989-27-5) in F344/N rats and B6C3F1 mice(gavage studies)[R]. America: National Toxicology Program, 1990.
[24] MAURO M, CATANZARO I, NASELLI F, et al. Abnormal mitotic spindle assembly and cytokinesis induced by d-limonene in cultured mammalian cells[J]. Mutagenesis, 2013, 28(6): 631-635.
[25] ARIYOSHI T, ARAKAKI M, IDEGUCHI K, et al. Studies on the metabolism of d-limonene (p-mentha-1, 8-diene). III. Effects of d-limonene on the lipids and drug-metabolizing enzymes in rat livers[J]. Xenobiotica, 1975, 5(1): 33-38.
[26] TSUJI M, FUJISAKI Y, ARIKAWA K, et al. Studies on d-limonene,as gallstone solubilizer(IV): chronic toxicity in dogs[J]. Oyo Yakuri,1975, 9(5): 775-808.
[27] WEBB D R, KANERVA R L, HYSELL D K, et al. Assessment of the subchronic oral toxicity of d-limonene in dogs[J]. Food and Chemical Toxicology, 1990, 28(10): 669-675.
[28] SEKIHASHI K, YAMAMOTO A, MATSUMURA Y, et al. Comparative investigation of multiple organs of mice and rats in the comet assay[J]. Mutation Research, 2002, 517(1/2): 53-75.
[29] L☒PEZ M A, STASHENKO E E, FUENTES J L. Chemical composition and antigenotoxic properties of Lippia alba essential oils[J]. Genetics and Molecular Biology, 2011, 34(3): 479-488.
[30] SAVERINI M, CATANZARO I, SCIANDRELLO G, et al. Genotoxicity of citrus wastewater in prokaryotic and eukaryotic cells and efficiency of heterogeneous photocatalysis by TiO2[J]. J ournal of Photochemistry and Photobiology B: Biology, 2012, 108(1): 8-15.
[31] RUSSO R, CIOCIARO A, BERLIOCCHI L, et al. Implication of limonene and linalyl acetate in cytotoxicity induced by bergamot essential oil in human neuroblastoma cells[J]. Fitoterapia, 2013, 89:48-57.
[32] MENDANHA S A, MOURA S S, ANJOS J L, et al. Toxicity of terpenes on fibroblast cells compared to their hemolytic potential and increase in erythrocyte membrane fluidity[J]. Toxicology in Vitro,2013, 27(1):323-329.
[33] VAJRABHAYA L O, SUWANNAWONG S K, KAMOLROONGWARAKUL R,et al. Cytotoxicity evaluation of gutta-percha solvents: chloroform and GP-solvent (limonene)[J]. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodonlogy, 2004, 98(6): 756-759.
[34] ROLSETH V, DJURHUUS R, SVARDAL A M. Additive toxicity of limonene and 50% oxygen and the role of glutathione in detoxification in human lung cells[J]. Toxicology, 2002, 70(1/2): 75-88.
[35] KARLBERG A T, BASKETTER D, GOOSSENS A, et al. Regulatory classification of substances oxidized to skin sensitizers on exposure to air[J]. Contact Dermatitis, 1999, 40(4): 183-188.
[36] CHRISTENSSON J B, FORSSTRÖM P, WENNBERG A M, et al. Air oxidation increases skin irritation from fragrance terpenes[J]. Contact Dermatitis, 2009, 60(1): 32-40.
[37] WEI Qingjun, HARADA K, OHMORI S, et al. Toxicity study of the volatile constituents of myoga utilizing acute dermal irritation assays and the Guinea-pig maximization test[J]. Journal of Occupational Health, 2006, 48(6): 480-486.
[38] MATURA M, GOOSSENS A, BORDALO O, et al. Oxidized citrus oil (R-limonene): a frequent skin sensitizer in Europe[J]. Journal of the American Academy of Dermatology, 2002, 47(5): 709-714.
[39] MATURA M, SKÖLD M, BÖRJE A, et al. Not only oxidized R-(+)- but also S-(-)-limonene is a common cause of contact allergy in dermatitis patients in Europe[J]. Contact Dermatitis, 2006, 55(5): 274-279.
[40] N☒JGAARD J K, CHRISTENSEN K B, WOLKOFF P. The effect on human eye blink frequency of exposure to limonene oxidation products and methacrolein[J]. Toxicology Letters, 2005, 156(2): 241-251.
[41] ROHR A C, WILKINS C K, CLAUSEN P A, et al. Upper airway and pulmonary effects of oxidation products of (+)-alpha-pinene,d-limonene, and isoprene in BALB/c mice[J]. Inhalation Toxicology,2002, 4(7): 663-684.
[42] WOLKOFF P, CLAUSEN P A, LARSEN K, et al. Acute airway effects of ozone-initiated d-limonene chemistry: importance of gaseous products[J]. Toxicology Letters, 2008, 181(3): 171-176.
[43] SEINFELD J H, PANDIS S N. Atmospheric chemistry and physics:from air pollution to climate change[M]. 2nd ed. America: Wiley InterScience, 2006: 25-41.
[44] KRÓL S, NAMIESNIK J, ZABIEGALA B. α-Pinene, 3-carene and d-limonene in indoor air of Polish apartments: the impact on air quality and human exposure[J]. Science of the Total Environment, 2014,468/469: 985-995.
[45] MAKSYMIUK C S, GAYAHTRI C, GIL R R, et al. Secondary organic aerosol formation from multiphase oxidation of limonene by ozone: mechanistic constraints via two-dimensional heteronuclear NMR spectroscopy[J]. Physical Chemistry Chemical Physics, 2009,11(36): 7810-7818.
[46] WALSER M L, PARK J, GOMEZ A L, et al. Photochemical aging of secondary organic aerosol particles generated from the oxidation of d-limonene[J]. Journal of Physical Chemistry A, 2007, 111(10): 1907-1913.
[47] World Health Organization. Evaluation of certain food additives:sixty-third report of the joint FAO/WHO expert committee on food additives[R]. Geneva: WHO, 2005.
[48] Food and Agriculture Organization of the United Nations, World Health Organization. Summary and conclusions of the sixty-third meeting[C]//Sixty-Third Report of the Joint FAO/WHO Expert Committee on Food Additives, Geneva: WHO, 2004: 1-18.
Progress in Understanding the Safety of Limonene
HUANG Qiaojuan, HUANG Linhua, SUN Zhigao*, HAO Jingmei, GUO Li
(Citrus Research Institute, Southwest University, Chongqing 400712, China)
Limonene is one of the main ingredients in citrus essential oils. It has been widely used in food and pharmaceutical industries due to its antibacterial and anticancer bioactivities. This paper reviews recent progress in understanding the safety of limonene from the perspectives of toxicological assessment, genotoxicity, cytotoxicity and its infl uence on human, animals and environment. We hope that this review could provide
for the effective and safe application of limonene.
limonene; safety; toxicology
TS201.6
A
1002-6630(2015)15-0277-05
10.7506/spkx1002-6630-201515051
2014-09-22
2012年度国家星火计划项目(2012GA811001);中央高校基本科研业务费专项资金项目(XDJK2013C100)
黄巧娟(1989—),女,硕士研究生,研究方向为功能性成分的提取。E-mail:hqj1027003283@163.com
孙志高(1964—),男,副研究员,本科,研究方向为农产品贮藏与加工。E-mail:cpro@cric.cn

