稠李花色苷的纯化及体外抗氧化活性
刘剑利,刘 晓,曹向宇*,于 慧,杨思敏,孙宇航
(辽宁大学生命科学院,辽宁 沈阳 110036)
LIU Jianli, LIU Xiao, CAO Xiangyu*, YU Hui, YANG Simin, SUN Yuhang
(School of Life Science, Liaoning University, Shenyang 110036, China)
稠李花色苷的纯化及体外抗氧化活性
刘剑利,刘 晓,曹向宇*,于 慧,杨思敏,孙宇航
(辽宁大学生命科学院,辽宁 沈阳 110036)
目的:建立AB-8大孔树脂纯化稠李花色苷的方法,并检测稠李花色苷体外抗氧化活性。方法:通过AB-8大孔树脂对稠李花色苷的动态吸附与解吸条件优化,确定最佳纯化条件;采用四唑氮蓝(nitroblue tetrazolium,NBT)光化还原法测定花色苷体外抗氧化活性,2',7'-二氢二氯荧光素二乙酸酯(2',7'-dichlorodihydrofluoresce in diacetate,DCFH-DA)法观察花色苷对H2O2诱导的N 2A细胞氧化损伤的保护作用。结果:稠李花色苷的最佳动态纯化条件是:吸附流速0.01 mL/s,粗提液质量浓度8 mg/mL,过柱次数2 次;解吸剂乙醇体积分数70%,流速0.01 mL/s,pH 3,纯化之后稠李花色苷的色价为57.1,纯化了16.31 倍;NBT实验结果表明,稠李花色苷具有清除超氧阴离子自由基的能力,且具有较好的剂量-效应关系;0.025 mg/mL的稠李花色苷能够保护H2O2损伤的N2A细胞,0.05 mg/mL的稠李花色苷能够降低细胞内活性氧水平。结论:AB-8大孔树脂是纯化稠李花色苷的一种有效方法,稠李花色苷在一定质量浓度范围内具有较好的体外抗氧化活性。
稠李;花色苷;纯化;大孔树脂;抗氧化;活性氧
LIU Jianli, LIU Xiao, CAO Xiangyu*, YU Hui, YANG Simin, SUN Yuhang
(School of Life Science, Liaoning University, Shenyang 110036, China)
稠李,为蔷薇科稠李属的植物,果期一般在5-10月。稠李果实味涩,微甜,形状卵球形,径长可达0.8~1 cm,果皮为红褐色至紫色[1]。稠李属植物因较耐湿寒,并且花香浓郁,为早春观赏植物之一。稠李在我国黑龙江、吉林、辽宁、内蒙古、河北、山西、河南、山东等地均有分布。由于稠李的树皮、叶、花和果均可入药,树干可做木材,因此其用途广泛[2]。
花色苷不仅具有很高的营养价值,也是替代合成色素的理想材料[3]。同时它具有较好的抗肿瘤、抗癌、抗炎等作用[4-6],还可与活性氧反应,减少和消除活性氧对生物体的伤害[7-8],因此,花色苷越来越受到人们的关注,在食品领域、医药与化妆品、保健品行业都有着巨大的应用价值和开发价值。
目前,国内外对于稠李的研究主要集中在稠李苗木繁育和稠李叶片成分分析两个方面[9],对稠李花色苷的研究也主要集中在花色苷制备及功能研究上[10-11],而对其分离纯化、抗氧化方面少有报道[12]。花色苷类化合物的分离纯化方法很多,有萃取法、添加剂法、重结晶法、层析法、高速逆流色谱技术法等,但均存在不同程度的缺点,从而限制了其工业化的生产[13-14]。目前采用的分离纯化花色苷类化合物的主要方法是大孔树脂吸附法,它具有效率高、质量稳定、成本低且操作简单易行等优点[15]。本实验采用AB-8大孔树脂对稠李花色苷进行有关吸附-解吸性能的纯化研究,并对纯化后的稠李花色苷进行了体外抗氧化活性和细胞水平损伤保护作用的研究,以期为稠李资源开发和深加工转化提供理论基础和实验依据。
1 材料与方法
1.1材料与试剂
蔷薇科稠李属稠李 辽宁大学校内采集并冷冻保存;AB-8大孔树脂 南开大学化工厂。
氮蓝四唑(nitroblue tetrazolium,NBT)、甲硫氨酸 国药集团化学试剂有限公司;乙二胺四乙酸 加拿大BioBasic公司;核黄素 北京奥博星生物技术有限公司;氯化钾、盐酸、无水乙醇等均为国产分析纯。
1.2仪器与设备
HH-W420数显三用恒温水浴箱 金坛市晶玻实验仪器厂;DZKW-D-6数显电热恒温水浴锅 上海申光仪器仪表有限公司;721N可见光分光光度计 上海精密科学仪器有限公司;JW-3021HR高速冷冻离心机 安徽嘉文仪器装备有限公司;CHRIST冷冻干燥机 北京鑫盛鸿阳科技有限公司;063335型电子蠕动泵 上海青浦沪西仪器厂;SHA-2型恒温摇床 上海比朗仪器有限公司;RE-52CS-2型旋转蒸发仪 上海虹昕电子仪器仪表有限公司。
1.3方法
1.3.1稠李果实花色苷的制备[16]
取稠李果实去柄,破碎,去核,于-80 ℃冰箱冷冻,冷冻干燥后取出,用体积分数为60%的乙醇按照1∶30(m/V)的比例混合均匀,在超声功率为300 W的条件下超声45 min,离心,取上清液比色。收集提取液,用旋转蒸发仪进行浓缩,最后冷冻干燥,得到稠李果实花色苷粉末。
1.3.2花色苷含量的测定
根据pH示差法[17]测定稠李果实中花色苷的含量,通过全波长扫描,确定稠李花色苷在可见光区的最大吸收波长是520 nm。根据花色苷的结构特性,当pH值为1.0时在520 nm波长处有最大吸收峰,而当pH值为4.5时,花色苷就转变为无色查耳酮形式,在520 nm波长处没有吸收峰,用示差法计算溶液中总花色苷含量,根据公式(1)计算花色苷含量。

式中:A0、A1分别为pH 1.0、4.5时花色苷在520 nm波长处的吸光度;V为提取溶液总体积/mL;n为稀释倍数;M为矢车菊-3-葡萄糖苷的摩尔质量/(g/mol);ε为矢车菊-3-葡萄糖苷的消光系数26 900/(L/(mol·cm));m为稠李果实质量/g;b为比色皿厚度/cm。
1.3.3大孔树脂动态纯化花色苷
1.3.3.1大孔树脂的预处理[18]
用蒸馏水对大孔树脂进行充分淋洗,置于无水乙醇中浸泡24 h,蒸馏水清洗残留乙醇;然后酸碱处理,用体积分数为5% HCl溶液浸泡12 h后,用蒸馏水洗至中性;然后用质量分数为2% NaOH溶液浸泡12 h,用蒸馏水洗至中性。
1.3.3.2吸附流速对花色苷动态吸附率的影响
量取5 份50 mL花色苷粗提液,测定吸光度A0,然后将粗提液均速过柱1 次,流速分别为0.01、0.05、0.10、0.15、0.20 mL/s,分别测定流出液的吸光度A1,根据公式(2)计算不同流速下的吸附率[19]。

1.3.3.3粗提液质量浓度对花色苷动态吸附率的影响
将花色苷粗提物分别配制成质量浓度为1、2、4、8、16 mg/mL的溶液,分别测定吸光度A0,然后溶液依次过柱,流速为0.01 mL/s,分别测定流出液的吸光度A1。按照公式(2)计算各自的吸附率。
1.3.3.4过柱次数对花色苷动态吸附率的影响
量取50 mL花色苷粗提液,测定吸光度A0,然后将粗提液分别过柱1~5 次,流速调为0.01 mL/s,分别测定流出液的吸光度A1。按照公式(2)计算各自的吸附率。
1.3.3.5乙醇体积分数对花 色苷动态解吸率的影响
将同一批次中吸附了花色苷的大孔树脂等量分配,量取5 份体积分数分别为40%、50%、60%、70%、80%的乙醇溶液,依次通过树脂柱,分别测定流出液吸光度A2,根据公式(3)计算解吸率[19]。

1.3.3.6解吸流速对花色苷动态解吸率的影响
将同一批次中吸附了花色苷的大孔树脂等量分配,量取5 份体积分数70%乙醇溶液,流速分别调为0.01、0.05、0.10、0.15、0.20 mL/s,依次通过树脂柱后,测定流出液的吸光度A2,按照公式(3)计算不同流速的解吸率。
1.3.3.7pH值对花色苷动态解吸率的影响
根据相关文献[20-21]可知,花色苷在酸性条件下较稳定,而在碱性溶液中,其稳定性受较大影响,因而将同一批次中吸附了花色苷的大孔树脂等量分配,量取5 份体积分数70%乙醇溶液,将pH值分别调至2、3、4、5、6,以0.01 mL/s的速率通过树脂柱。每次过柱后测定流出液吸光度A2,按照公式(3)计算解吸率。
1.3.4稠李花色苷色价的测定[22]
按照最佳的纯化条件对稠李果实花色苷进行纯化,经减压浓缩、冷冻干燥得到花色苷粉末。准确称取0.10 g的花色苷粉末,用pH 3.0的柠檬酸缓冲溶液定容到100 mL,稀释一定倍数,在520 nm波长处测定其吸光度,并按照公式(4)计算稠李花色苷色价E。

式中:A为样品在520 nm波长处的吸光度;m为花色苷粉末样品质量/g;r为测定吸光度时所吸样品被稀释的倍数。
1.3.5NBT光化还原法测定稠李花色苷的体外抗氧化活性[23]
配制质量浓度为0.02、0.04、0.06、0.08、0.10 mg/mL的稠李花色苷溶液进行实验。具体参考吕淑霞[24]的方法略有改进。
1.3.6稠李花色苷对H2O2诱导N2A细胞损伤的影响[25]
用含体积分数10%胎牛血清的培养液配成单个N2A细胞悬液,以每孔105个细胞接种到6 孔板,每孔体积2 mL,接着在37 ℃,体积分数5% CO2培养箱中进行细胞培养24 h,然后对细胞进行处理,设置3 个实验组,分别为正常对照组、模型组和花色苷处理组。其中模型组H2O2浓度为0.5 mmol/L,花色苷处理1组用0.5 mmol/L H2O2和0.025 mg/mL的花色苷作用于细胞,花色苷处理2组用0.5 mmol/L H2O2和0.05 mg/mL的花色苷作用于细胞,继续培养1 h,显微镜下分别观察不同组细胞的状态并计算贴壁细胞数目百分比。
1.3.7稠李花色苷对H2O2损伤的N2A细胞内活性氧含量的影响[26]
将N2A细胞进行种板,对照组加入0.5 mmol/L H2O2,花色苷处理组加入0.05 mg/mL的花色苷和0.5 mmol/L H2O2,去除细胞培养液,加入磷酸盐缓冲液(phosphate buffered saline,PBS)淋洗后,加入终浓度为20 μmol/L稀释好的2',7'-二氢二氯荧光素二乙酸酯(2',7'-dichlorodihydrofluorescein diacetate,DCFH-DA),包上锡纸,37 ℃培养箱内温育30 min,再用PBS进行淋洗,加入甲醇0.5 mL,-20 ℃固定30 min,再次淋洗后,加入丙酮(4 ℃预冷)0.5 mL固定6 min,然后每5 min用PBS淋洗3 次,最后进行封片观察。
1.4数据分析
实验重复3 次测定,结果表示为±s,采用SPSS 19.0软件进行统计分析。
2 结果与分析
2.1稠李果实花色苷含量
根据pH示差法,测得花色苷的含量为(0.897±0.013) mg/g,冷梅等[27]测得紫叶稠李花色苷的含量为(0.830±0.033)mg/g,本研究得到含量比其高8%。
2.2大孔树脂动态纯化稠李花色苷结果
2.2.1吸附流速对稠李花色苷动态吸附率的影响

图1 吸附流速对稠李花色苷动态吸附率的影响Fig.1 Effect of sample loading flow rate on the dynamic adsorption rate of Padus racemosa anthocyanins
图1为吸附流速对稠李花色苷动态吸附率的影响,在吸附流速为0.01 mL/s时,AB-8大孔树脂对稠李花色苷的吸附率为80.7%,而吸附流速为0.20 mL/s时,吸附率仅为41.2%,吸附率随流速的增加而降低。流速越低,稠李花色苷经过柱子所需的时间越长,与树脂接触的时间也就越久,从而吸附效果越好,因而在后续的吸附实验中采用吸附流速为0.01 mL/s。
2.2.2粗提液质量浓度对稠李花色苷动态吸附率的影响如图2所示,粗提液的质量浓度对稠李花色苷动态吸附率的影响不大,在质量浓度为8 mg/mL时,动态吸附率达到最大值,为89.2%。而当质量浓度继续加大时,树脂的吸附能力有所下降,原因可能是花色苷质量浓度的提高使得与花色苷竞争吸附的杂质的含量也增加,影响了花色苷在树脂内部的扩散[28]。因而,选择8 mg/mL的粗提液质量浓度为吸附原液质量浓度。

图2 稠李花色苷粗提液质量浓度对动态吸附率的影响Fig.2 Relationship between Padus racemosa anthocyanin concentration and dynamic adsorption rate
2.2.3过柱次数对稠李花色苷动态吸附率的影响

图3 过柱次数对稠李花色苷动态吸附率的影响Fig.3 Effect of sample loading number on the dynamic adsorption rate of Padus racemosa anthocyanin
如图3所示,随着过柱次数的增多,树脂对稠李花色苷的吸附效果略有增加,其中在过柱2 次后,吸附率为94.7%,而过柱5 次时的吸附率为96.4%。通过数据的比对可以得出:过柱2 次以后,吸附率增加的幅度不大,因此,出于实际操作和经济方面的考虑,过柱2 次为最佳选择。
2.2.4乙醇体积分数对稠李花色苷动态解吸率的影响
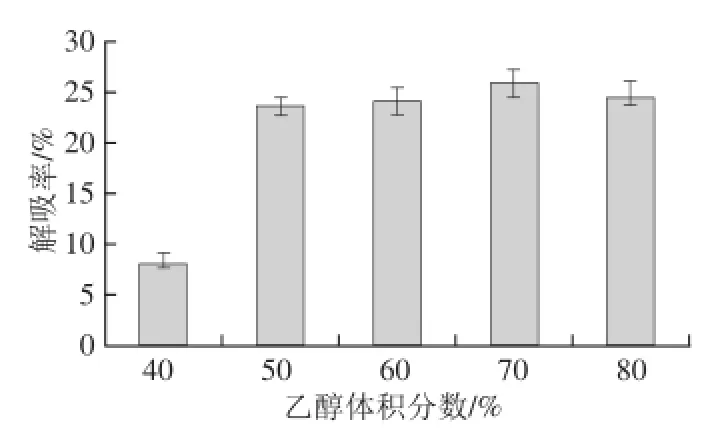
图4 乙醇体积分数对稠李花色苷动态解吸率的影响Fig.4 Effect of ethanol concentration on the dynamic desorption rate of Padus racemosa anthocyanins
乙醇可以使大孔树脂溶胀,减弱大孔树脂和被吸附物质之间的作用力,并且能够溶解被吸附的物质。如图4所示,当乙醇体积分数<70%时,稠李花色苷的解吸率随着乙醇体积分数的增大而增大;在70%时的解吸率为25.8%,而当乙醇体积分数>70%时,解吸率下降,在乙醇体积分数为80%时,解吸率为24.5%。因而,乙醇的体积分数选择为70%。
2.2.5解吸流速对稠李花色苷动态解吸率的影响

图5 解吸流速对稠李花色苷动态解吸率的影响Fig.5 Effect of flow rate on the dynamic desorption rate of Padus racemosa anthocyanins
如图5所示,随解吸流速的增加,乙醇对吸附了稠李花色苷的大孔树脂的解吸效果呈下降趋势,在0.01 mL/s时的解吸率为35.5%,而当流速为0.20 mL/s时,解吸率下降至25.4%,并且随着解吸流速的增加,解吸率略有降低,因而为获得比较高的解吸率,解吸流速选取0.01 mL/s进行实验。
2.2.6pH值对稠李花色苷动态解吸率的影响

图6 pH值对稠李花色苷动态解吸率的影响Fig.6 Effect of pH on the dynamic desorption rate of Padus racemosa anthocyanins
pH值对稠李花色苷动态解吸率的影响如图6所示,随着pH值的增大,稠李花色苷的解吸率呈现为先上升后下降的趋势。当pH值为3时,解吸率最大,达68.2%,并且稠李花色苷在酸性条件下比较稳定。因此,后续实验中采用实验条件为pH 3,以获得最好的解吸效果。
2.3稠李花色苷的色价
按最佳纯化条件进行纯化,稠李花色苷的吸附率为95.6%,解吸率为68.2%。纯化前的色价为3.5,纯化之后色价为57.1,纯化了16.31 倍。张勇等[29]利用AB-8大孔树脂对土豆色素进行纯化,最终纯化后的色价为43.15,是纯化前的8.4 倍;董周永等[30]用AB-8大孔树脂纯化红心萝卜花色苷,最终纯化后的色价为47.8,是纯化前的12 倍,证明AB-8大孔树脂是对花色苷纯化的有效方法,同时本研究得到的纯化方法效果相对好一些,但是对花色苷的纯化还不够完善,还可以利用凝胶层析、膜分离技术、超滤等方法进一步纯化,并且还可采用高效液相色谱的方法对纯化之后的花色苷进行鉴定。
2.4稠李花色苷的体外抗氧化活性
按照抗氧化物抑制NBT在光下的还原作用原理,来确定花色苷体外抗氧化活性。核黄素首先被光还原,有氧化物质存在下,被还原的核黄素在有氧条件下极易再氧化,而产生超氧阴离子自由基(),可将NBT还原为蓝色的甲腙,后者在560 nm波长处有最大吸收,而花色苷可清除,抑制甲腙的形成[24]。于是在光还原反应后,反应液蓝色愈深,说明花色苷的抗氧化性愈低,反之花色苷的抗氧化性愈高。由图7可知,稠李花色苷具有体外抗氧化活性,且随着花色苷质量浓度的增大,其对清除能力有上升的趋势。

图7 稠李花色苷的体外抗氧化活性Fig.7 Antioxidant activity of Padus racemosa anthocyanins in vitro
2.5稠李花色苷对H2O2诱导N2A细胞损伤的保护作用
通过0.5 mmol/L的H2O2处理能够显著降低N2A细胞的活力。然而,加入稠李花色苷之后,可以对N2A细胞进行保护,阻止H2O2对N2A细胞的损伤,其结果如图8、9所示。

图8 各组N2A细胞的形态Fig.8 Mo rphology of N2A cells in four experimental groups

图9 稠李花色苷对HH2O2诱导N2A细胞损伤的保护作用Fig.9 Protective effect of Padus racemosa anthocyanins on H2O2-induced N2A cell damage
由图8、9可知,正常对照组的细胞折光性强,细胞规则,贴壁状态良好;模型组细胞变圆,折光性变弱,贴壁不良,而稠李花色苷处理组细胞形态较模型组有所改善。H2O2能够损伤细胞膜的完整性,降低细胞的活性,对细胞的损伤很大,加入浓度为0.5 mmol/L的H2O2后,显微镜观察贴壁细胞数目只达到正常对照组的31.4%,但是,经0.025 mg/mL的花色苷处理后,贴壁细胞数目为正常对照组的72.2%,与模型组比较,差异极显著(P<0.01),经0.05 mg/mL的花色苷处理后,贴壁细胞数目为正常对照组的84.9%,与模型组比较,差异极显著(P<0.01)。由此,可以得出稠李花色苷对H2O2诱导的N2A细胞损伤具有很强的保护作用,能够显著提高细胞的活性,且具有较好的剂量-效应关系。张丽霞等[31]通过形态学观察、四甲基偶氮唑蓝实验得到黑莓花色苷对H2O2诱导的血管内皮细胞损伤有保护作用,Heo等[32]发现草莓花色苷同样可使H2O2诱导损伤细胞的存活率增加,都证明了花色苷对H2O2损伤的细胞具有较好保护作用。
2.6稠李花色苷对H2O2损伤的N2A细胞内活性氧水平的影响

图10 稠李花色苷对HH2O2损伤的N2A细胞内活性氧水平的影响Fig.10 Effect of Padus racemosa anthocyanin on ROS activity in N2A cells
如图10所示,相对于正常细胞(图10A),0.5 mmol/L H2O2处理的氧化应激条件下,细胞荧光信号显著增强,说明细胞内活性氧水平较高(图10B),加入0.05 mg/mL稠李花色苷后,细胞内荧光信号强度显著降低(图10C),说明细胞内活性氧水平降低,即稠李花色苷能够抑制细胞氧化应激。Ullah等[33]通过活性氧的荧光实验,也同样证明了花色苷能够降低细胞内活性氧水平。
3 结 论
本实验确定了AB-8大孔树脂纯化稠李花色苷最佳条件为:吸附流速为0.01 mL/s,粗提液质量浓度为8 mg/mL,过柱2 次;解吸剂乙醇体积分数为70%,解吸流速为0.01 mL/s,pH值为3。纯化之后稠李花色苷的色价为57.1,纯化了16.31 倍。分离纯化的稠李花色苷对O2-·清除能力较强,并存在剂量-效应关系;稠李花色苷对H2O2诱导的N2A细胞损伤具有较强的保护作用,DCFH-DA法观察稠李花色苷具有较好的降低细胞内活性氧水平作用,说明稠李花色苷具有较好的体外抗氧化活性。本研究为稠李花色苷深加工和保健食品的开发利用提供了基础资料和理论依据,但是有关稠李果实花色苷对H2O2诱导的N2A细胞损保护作用的确切机制以及对正常细胞的影响如何,还有待进一步研究。
[1] 俞德浚. 中国植物志[M]. 北京: 科学出版社, 1986: 89-104.
[2] 辛越, 刘荣, 何娇, 等. 稠李属三种果实花色苷对HepG2细胞的增殖抑制作用比较[J]. 食品工业科技, 2013, 34(9): 348-355.
[3] 邓洁红, 谭兴和, 王锋, 等. 刺葡萄皮花色苷的分离与检定[J]. 中国食品学报, 2010, 10(1): 200-205.
[4] LALA G, MALIK M, ZHAO Cuiwei, et al. Anthocyanin-rich extracts inhibit multiple biomarkers of colon cancer in rats[J]. Nutrition and Cancer, 2006, 54(1): 84-93.
[5] CHEN Peini, KUO W H, CHIANG C L, et al. Black rice anthocyanins inhibit cancer cells invasion via repressions of MMPs and u-PA expression[J]. Chemico-Biological Interactions, 2006, 163(3): 218-229.
[6] NETZEL M, NETZEL G, KAMMERER D R, et al. Cancer cell antiproliferation activity and metabolism of black carrot anthocyanins[J]. Innovative Food Science and Emerging Technologies,2007, 8(3): 365-372.
[7] 王湛, 付钰洁, 常徽, 等. 桑葚花色苷的提取及对人乳腺癌细胞株MDA-MB-453生长的抑制[J]. 第三军医大学学报, 2011, 33(10):988-990.
[8] 宋雪, 韩勇, 籍保平, 等. 笃斯越橘花色苷提取物对光损伤人视网膜色素上皮细胞的保护作用[J]. 食品科学, 2010, 31(21): 324-328.
[9] 王书凯, 徐善光, 高千荣, 等. 稠李和紫叶稠李的形态识别及园林应用[J]. 辽宁林业科技, 2010(1): 55-59.
[10] 王光全, 黄勇, 孟庆杰, 等. 紫叶稠李色素提取及测定研究[J]. 食品科学, 2007, 28(7): 178-181.
[11] 刘荣, 辛越, 何娇, 等. 山桃稠李果实花色苷对HepG2细胞抗氧化系统的影响[J]. 食品工业科技, 2013, 34(15): 66-69.
[12] 王振宇, 任健, 张宁, 等. 稠李属果实色素理化性质研究[J]. 食品科学, 2010, 31(17): 92-97.
[13] 谭仁祥. 植物成分分析[M]. 北京: 科学出版社, 2002: 67-87.
[14] 高孔荣, 黄惠华, 梁照为. 食品分离技术[M]. 广州: 华南理工大学出版社, 1998: 5-7.
[15] EL-MEKKAWY S, MESELHY M R, NAKAMURA N, et al. Anti-HIV-1 and anti-HIV-1-protease substances from Ganoderma lucidum[J]. Phytochemistry, 1998, 49(6): 1651-1657.
[16] 焦岩, 王振宇. 蓝靛果花色苷超声波辅助提取优化及其降血脂作用[J].中国食品学报, 2010, 10(2): 52-59.
[17] 肖军霞, 黄国清. 红树莓花色苷的提取及抗氧化活性研究[J]. 食品科学, 2011, 32(8): 15-18.
[18] 郭庆启, 张娜, 付立营, 等. 大孔树脂法纯化树莓花色苷及初步鉴定[J].食品与发酵工业, 2010, 36(6): 177-180.
[19] 李颖畅, 邓凤娥, 孟宪军. 大孔树脂纯化蓝莓果中花色苷的研究[J].食品与生物技术学报, 2009, 28(4): 496-500.
[20] 孙健, 蒋跃明, 彭宏祥, 等. 红毛丹果皮色素的提取及其稳定性的研究[J]. 食品科学, 2009, 30(11): 71-75.
[21] 韩林, 张海德, 万婧, 等. 槟榔红色素的提取工艺优化及稳定性研究[J].食品科学, 2010, 31(4): 1-5.
[22] 凌关庭. 天然食品添加剂手册[M]. 北京: 化学工业出版社, 2000:226-228.
[23] 刘剑利, 曹向宇. 小米多肽的制备及其抗氧化功能研究[J]. 食品科学, 2009, 30(8): 64-67.
[24] 吕淑霞. 基础生物化学实验指导[M]. 北京: 中国农业大学出版社,2003: 77-82.
[25] 杨莉, 袁丁, 代艳文, 等. 竹节参总提物对H2O2诱导SH-SY5Y神经细胞损伤的保护作用[J]. 第三军医大学学报, 2014, 36(2): 143-169.
[26] 王海涛, 林洁, 杨波, 等. 过氧化氢诱导人巨核细胞系Dami氧化应激模型的建立及评价[J]. 解放军医学院学报, 2014, 35(4): 349-356.
[27] 冷梅, 刘荣. 紫叶稠李果实花色苷的抗氧化活性[J]. 食品科学, 2013,34(11): 67-71. doi: 10.7506/spkx1002-6630-201311016.
[28] 王华, 菅蓁. 大孔吸附树脂纯化葡萄果皮花色素苷的研究[J]. 食品科学, 2008, 29(1): 86-90.
[29] 张勇, 李彩霞, 麻贝贝, 等. 大孔吸附树脂纯化“黑美人”土豆色素研究[J]. 食品工业科技, 2012, 33(2): 345-409.
[30] 董周永, 阿嘎, 赵国建. 等. 大孔树脂对红心萝卜花色苷的纯化[J].食品科学, 2011, 32(4): 21-24.
[31] 张丽霞, 周剑忠, 黄开红, 等. 黑莓花色苷对过氧化氢诱导血管内皮细胞损伤的保护作用[J]. 食品科学, 2013, 34(13): 257-261. doi:10.7506/spkx1002-6630-201313054.
[32] HEO H J, LEE C Y. Strawberry and its anthocyanins reduce oxidative stress-induced apoptosis in PC12 cells[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 1984-1999.
[33] ULLAH I, PARK H Y, KIM M O, et al. Anthocyanins protect against kainic acid-induced excitotoxicity and apoptosis via ROS-activated AMPK pathway in hippocampal neurons[J]. CNS Neuroscience and Therapeutics, 2014, 20(4): 327-338.
Purification and in vitro Antioxidant Activity of Anthocyanins from Padus racemosa
Purpose: To establish the best purification conditions for anthocyanins from the fruit pulp of Padus racemosa with AB-8 macroporous resin and detect the in vitro antioxidant activity of the extracted anthocyanins. Methods: The adsorption and desorption properties of macroporous resin AB-8 for anthocyanins from Padus racemosa were investigated to optimize the purification procedure, and the antioxidant activity in vitro was detected by nitroblue tetrazolium (NBT) photochemical reduction method. The protective effect of the extracted anthocyanins against oxidative stress induced by H2O2in N2A cells was analyzed by 2',7'-dichlorodihydrofluorescein diacetate (DCFH-DA) fluor escent probe assay. Results: The best purification conditions were achieved by adsorption performed twice with at a flow rate of 0.01 mL/s after adjustment of the crude extract concentration to 8 mg/mL and subsequent desorption with 70% ethanol acidified to pH 3 at a flow rate of 0.01 mL/s. The color value after purification was 57.1, achieving a 16.31-fold purification factor. The anthocyanins had a strong superoxide anion radical scavenging capacity in a dose-dependent manner. N2A cells could be protected by the anthocyanins at a concentration of 0.025 mg/mL, and the level of reactive oxide species in N2A cells could be reduced by the anthocyanins at 0.05 mg/mL. Conclusion: Macroporous resin AB-8 is an effective adsorbent for the purification of Padus racemosa anthocyanins, and Padus racemosa anthocyanins have strong antioxidant activity in vitro in a certain concentration range.
Pad us racemosa; anthocyanin; purification; macroporous resin; antioxidant; reactive oxide species
TS264.4
A
1002-6630(2015)15-0005-06
10.7506/spkx1002-6630-201515002
2014-10-05
国家自然科学基金委员会科学部主任基金项目(31240005);辽宁省高等学校优秀人才支持计划项目(LJQ2013002);辽宁省高等学校科学研究一般项目(L2014007);辽宁省科技厅农业攻关计划项目(2011211001);辽宁大学博士科研启动项目
刘剑利(1980—),男,副教授,博士,研究方向为食品生物技术。E-mail:liujianli119@163.com
曹向宇(1980—),男,教授,博士,研究方向为食品生物技术。E-mail:xycaolnu@163.com

