六盘水野生蕨菜多糖的超声波辅助提取及含量测定
方玉梅,张萍,王毅红,谭萍,王盼,赵晋军
(六盘水师范学院,贵州水城553004)
六盘水野生蕨菜多糖的超声波辅助提取及含量测定
方玉梅,张萍,王毅红,谭萍,王盼,赵晋军
(六盘水师范学院,贵州水城553004)
以六盘水野生蕨菜为材料,通过单因素设计以及正交试验对蕨菜多糖超声波提取的最佳工艺进行探索,并采用苯酚硫酸法对六盘水野生蕨菜多糖的含量进行测定。结果表明:蕨菜多糖的超声波辅助提取最佳工艺为料液比1∶100(g/mL)、功率70%(420 W)、时间50 min、温度35℃;蕨菜多糖的含量为245.751 67 mg/g。为六盘水野生蕨菜的进一步开发利用提供理论参考。
蕨菜;超声波辅助提取;多糖
蕨菜,别名拳头菜、如意菜、龙头菜等,属于蕨科。喜生于浅山区向阳地块,多分布于稀疏针阔混交林。其食用部分是未展开的幼嫩叶芽[1]。农业、医学及食品营养学等方面的研究结果显示,蕨菜的某些有效成分能扩张血管,降低血压;粗纤维能促进胃肠蠕动,具有下气通便的作用;蕨菜还具有清热解毒、杀菌清炎、补脾益气、强健机体、增强抗病能力保健功能,为某些疾病问题的解决提供了更简便有效的新途径[2]。目前,大多数对蕨菜的研究均集中于次生代谢物质(生物类黄酮)的含量上,对蕨菜多糖的研究鲜见报道。蕨菜多糖的提取方法多种多样,但在利用超声波辅助提取的方法上较少。
随着食品营养学的不断发展,人们更加关注植物性来源的非传统营养素,并试图从植物中寻找生理活性物质来降低、缓解、解决呈不断上升趋势的各种现代社会居民退行性疾病问题。研究表明植物多糖具有增强机体免疫功能、抗肿瘤、抗病毒、抗衰老、降血糖、刺激造血等多种生物学功效,而且对机体几乎没有毒性,故对植物多糖生物学功效的研究愈来愈引起国内外药理学家、生物学家和化学家们的兴趣,它已成为当代生物学的热门领域[3-4]。
蕨菜作为一种野生植物资源,生长在深山丛林之中,没有工业排放“三废”污染,也没有现代工业产品造成的农药污染,是一颗天然无公害的绿色珍珠,常年埋没在高山深谷内,属于天然无公害绿色食品[5]。如果能够以资源丰富且廉价的蕨菜为试验原料,利用超声波辅助提取的方法探索优化蕨菜多糖的提取工艺并测得其多糖含量,这将对进一步开发利用蕨菜多糖有着重要的意义。
1试验仪器与试剂
1.1主要原料及试剂
原料:蕨菜(采自六盘水石龙)。
试剂:石油醚(安徽易普化工有限公司,分析纯);蒸馏水(二次蒸馏);苯酚(江苏振日化工有限公司,分析纯);铝片(天津市化学试剂三厂,分析纯);碳酸氢钠(郑州超凡化工有限公司,分析纯);葡萄糖(吴江市永和精细化工有限公司,分析纯)。
1.2试验仪器及设备
LC-600B型数控超声波清洗机:济宁市中区鲁超仪器厂,总功率600 W;TU-1901双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;202A-3型恒温干燥箱:上海浦东跃欣科学仪器厂;TGL-16G型离心机:上海安亭科学仪器厂;FW80型高速万能粉碎机:天津市泰斯特仪器有限公司;BS110S电子天平:北京赛多利斯仪器系统有限公司。
2试验方法
2.1蕨菜的前处理及脱脂
将采来的新鲜蕨菜洗净置于调至65℃的恒温干燥箱中进行烘干处理,彻底脱水后用粉碎机粉碎成粉末,过60目筛,然后称取200 g蕨菜干粉于1 000 mL烧杯中,再量取400 mL石油醚加入其中,放置24 h进行脱脂,24 h后将蕨菜粉末过滤,然后将蕨菜粉末铺在大滤纸上待其干燥,将其盛入试剂瓶中放入恒温干燥箱备用。
2.2蕨菜多糖的显色工艺
采用苯酚-硫酸法[7-9]对蕨菜多糖进行显色反应。
2.2.15%苯酚溶液的配制
5%苯酚溶液配制:取苯酚100 g,加铝片0.1 g与碳酸氢钠0.05 g,蒸馏182℃馏分,吸取此馏分10 mL加水至200 mL棕色容量瓶中,即得。
2.2.2参比液的配制
精确吸取3 mL蒸馏水,置于10 mL容量瓶中,加入5%苯酚溶液1 mL混匀,再加入7 mL浓硫酸并计时,加蒸馏水至刻度,漩涡混合5 min,放置1 min,加蒸馏水至刻度,放置20 min,加蒸馏水至刻度。即获得参比液。
2.2.3蕨菜多糖样液的显色反应
从每次试验提取液中精确吸取3 mL蕨菜多糖样液,置于10 mL容量瓶中,加入5%苯酚溶液1 mL混匀,再加入7 mL浓硫酸并计时,加蒸馏水至刻度,漩涡混合5 min,放置1 min,加蒸馏水至刻度,放置20 min,加蒸馏水至刻度。
2.3蕨菜多糖的超声波辅助提取
2.3.1蕨菜多糖超声波辅助提取条件的单因素研究[10-11]
2.3.1.1提取料液比的单因素试验
准确称取0.1 g蕨菜干粉5份于干净标号的具塞试管中,按料液比1∶20、1∶40、1∶60、1∶80、1∶100(g/mL)依次加入2、4、6、8、10mL蒸馏水,置于超声波清洗机中,调节温度为55℃,功率70%(420W),提取30 min。然后离心取上清液,将上清液定容至10 mL,再依次精确吸取3 mL提取液进行显色,以制备的参比液作参比,在485nm处分别测其吸光度。以上试验每一处理,3次重复。
2.3.1.2提取功率的单因素试验
准确称取0.1 g蕨菜干粉5份于干净标号的具塞试管中,按料液比1∶80(g/mL)分别加入8 mL蒸馏水,调取温度55℃,分别在50%(300 W)、60%(360 W)、70%(420 W)、80%(480 W)、90%(540 W)5种功率下超声波辅助提取30 min。然后离心取上清液,将上清液定容至10 mL,再依次精确吸取3 mL提取液进行显色,以制备的参比液作参比,在485 nm处分别测其吸光度。以上试验每一处理,3次重复。
2.3.1.3提取时间的单因素试验
准确称取0.1 g蕨菜干粉5份于干净标号的具塞试管中,按料液比1∶80(g/mL)分别加入8 mL蒸馏水,调节超声波清洗机功率80%(480 W),温度55℃,分别按时间长短10、20、30、40、50min进行提取。然后离心取上清液,将上清液定容至10 mL,再依次精确吸取3 mL提取液进行显色,以制备的参比液作参比,在485 nm处分别测其吸光度。以上试验每一处理,3次重复。
2.3.1.4提取温度的单因素试验
准确称取0.1 g蕨菜粉末5份置于干净标号的具塞试管中,按料液比1∶80(g/mL)分别加入8 mL蒸馏水,调节超声波清洗机功率80%(480 W),分别在温度35、45、55、65、75℃下提取40 min。然后离心取上清液,将上清液定容至10 mL,再依次精确吸取3 mL提取液进行显色,以制备的参比液作参比,在485 nm处分别测其吸光度。以上试验每一处理,3次重复。
2.3.2蕨菜多糖超声波辅助提取的正交设计试验[12-13]
2.3.2.1蕨菜多糖超声波辅助提取正交设计
本试验采用L9(34)四因素三水平设计,见表1。

表1 蕨菜多糖超声波辅助提取正交设计因素表Table 1The orthogonal design table of Pteridium Revolutum polysaccharide extraction factors
2.3.2.2蕨菜多糖超声波辅助提取正交试验
准确称取0.1 g蕨菜粉末9份置于干净标号的具塞试管中,按以下正交表分别进行试验,然后离心取上清液,将上清液定容至10 mL,再依次精确吸取3 mL提取液进行显色,以制备的参比液作参比,在485 nm处分别测其吸光度。以上试验,每一处理,3次重复。
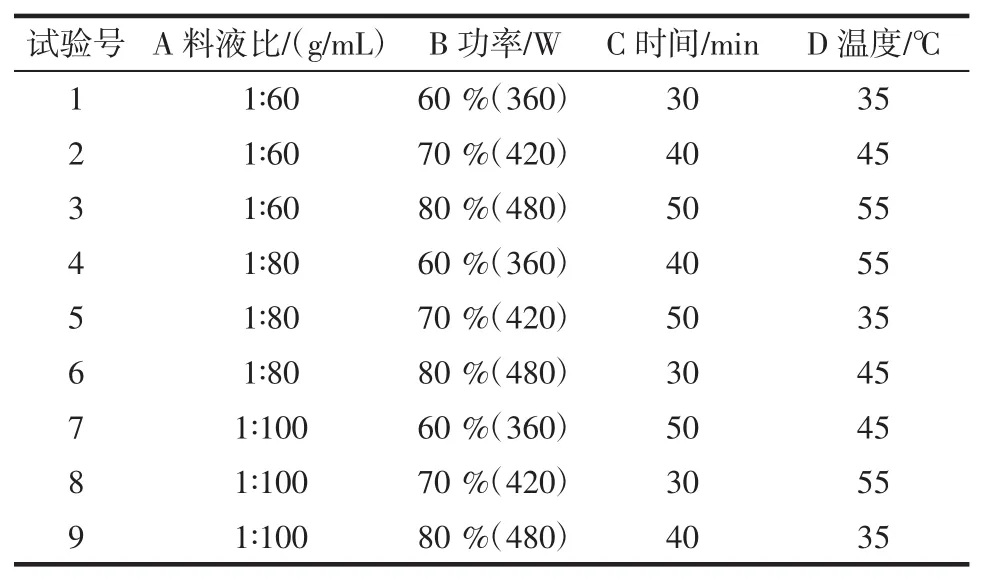
表2 蕨菜多糖超声波辅助提取正交表Table 2Orthogonal table of Pteridium Revolutum polysaccharide by ultrasonic-assisted extraction
2.4蕨菜多糖含量的测定
2.4.1标准曲线的绘制[14]
精确称取105℃干燥至恒重的无水葡萄糖0.1000g,置100 mL容量瓶中,加水溶解并稀至刻度,摇匀。精确吸取上述溶液1.0 mL,置50 mL容量瓶中,加水稀释至刻度。
精确量取0.500 0 mg/mL葡萄糖溶液0.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 mL,分别置于100 mL容量瓶中,加水稀释至刻度,摇匀,配成不同浓度的对照品系列溶液。于485 nm波长处测定吸光度,以吸光度(A)为纵坐标,以浓度(X)为横坐标,得回归方程,绘制标准曲线。
2.4.2蕨菜多糖含量测定
准确称取0.1 g蕨菜粉末一份置于干净标号的具塞试管中,按料液比1∶100(g/mL)加入10 mL蒸馏水,调节超声波清洗机功率70%(420 W),温度35℃,提取50min。然后离心取上清液,将上清液定容至10mL,再依次精确吸取3 mL提取液进行显色,以制备的参比液作参比,在485 nm处分别测其吸光度。以上试验,每一处理3次重复。之后取吸光度平均值带入回归方程,从而求得多糖浓度X。
3结果与分析
3.1蕨菜多糖超声波辅助提取条件的单因素研究结果
3.1.1超声波辅助提取单因素试验料液比的确定
以吸光度为纵坐标,料液比为横坐标,得到不同料液比对多糖的提取效果的影响,结果见图1。
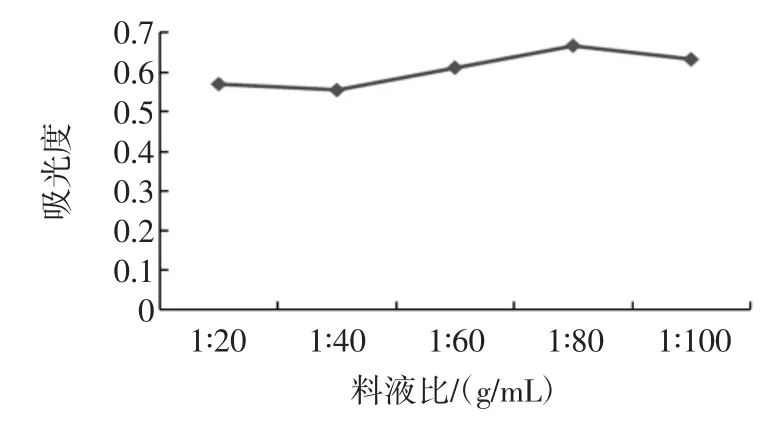
图1 超声波辅助提取单因素不同料液比的选择Fig.1Selection of single factor of ultrasonic-assisted extraction for different solid-liquid ratio
通过对图1数据分析,可得知料液比为1∶80(g/mL)时吸光度最高,故单因素最佳提取料液比为1∶80(g/mL)。
3.1.2超声波辅助提取单因素试验功率的确定
以吸光度为纵坐标,超声波功率为横坐标,得到不同超声波功率对多糖的提取效果的影响,结果见图2。
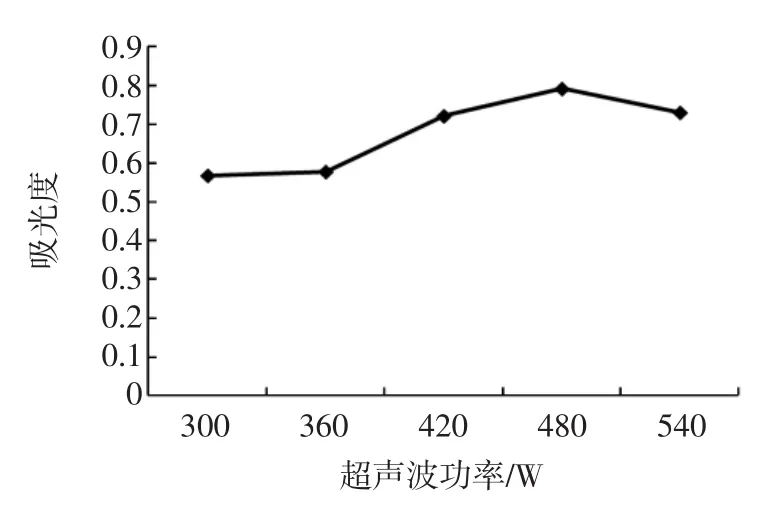
图2 超声波辅助提取单因素不同功率的选择Fig.2Selection of single factor of ultrasonic-assisted extraction
通过对图2数据分析,可得知功率为80%(480 W)时吸光度最高,故单因素最佳提取功率为80%(480W)。
3.1.3超声波辅助提取单因素试验时间的确定
以吸光度为纵坐标,提取时间为横坐标,得到不同提取时间对多糖的提取效果的影响,结果见图3。
图3 超声波辅助提取单因素不同提取时间的选择Fig.3Selection of single factor by ultrasonic-assisted extraction of time
通过对图3数据分析,可得知时间为40 min时吸光度最高,故单因素最佳提取时间为40 min。
3.1.4超声波辅助提取单因素试验温度的确定
以吸光度为纵坐标,提取温度为横坐标,得到不同提取温度对多糖的提取效果的影响,结果见图4。
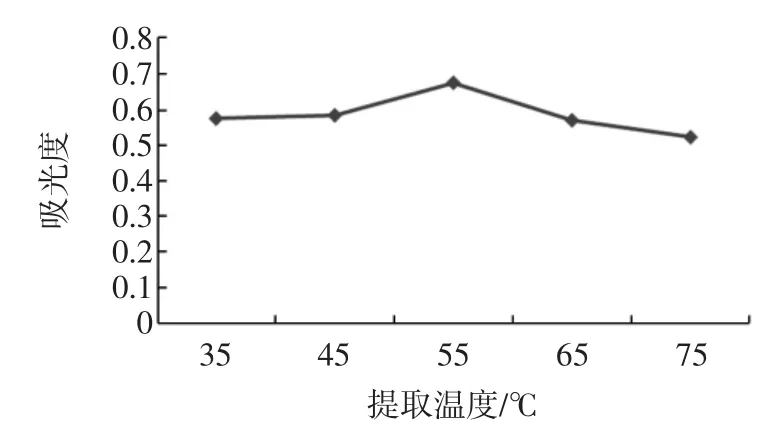
图4 超声波辅助提取单因素不同温度的选择Fig.4Selection of single factor by ultrasonic-assisted extraction of temperature
通过对图4数据分析,可得知温度为55℃时吸光度最高,故单因素最佳提取温度为55℃。
综上单因素试验结果,可得蕨菜多糖的超声波最佳提取条件为:料液比1∶80(g/mL)、功率80%(480 W)、时间40 min、温度为55℃。
3.2蕨菜多糖超声波辅助提取的正交设计试验结果
采用L9(34)四因素三水平对料液比、超声波功率、提取时间、提取温度进行设计,结果见表3。
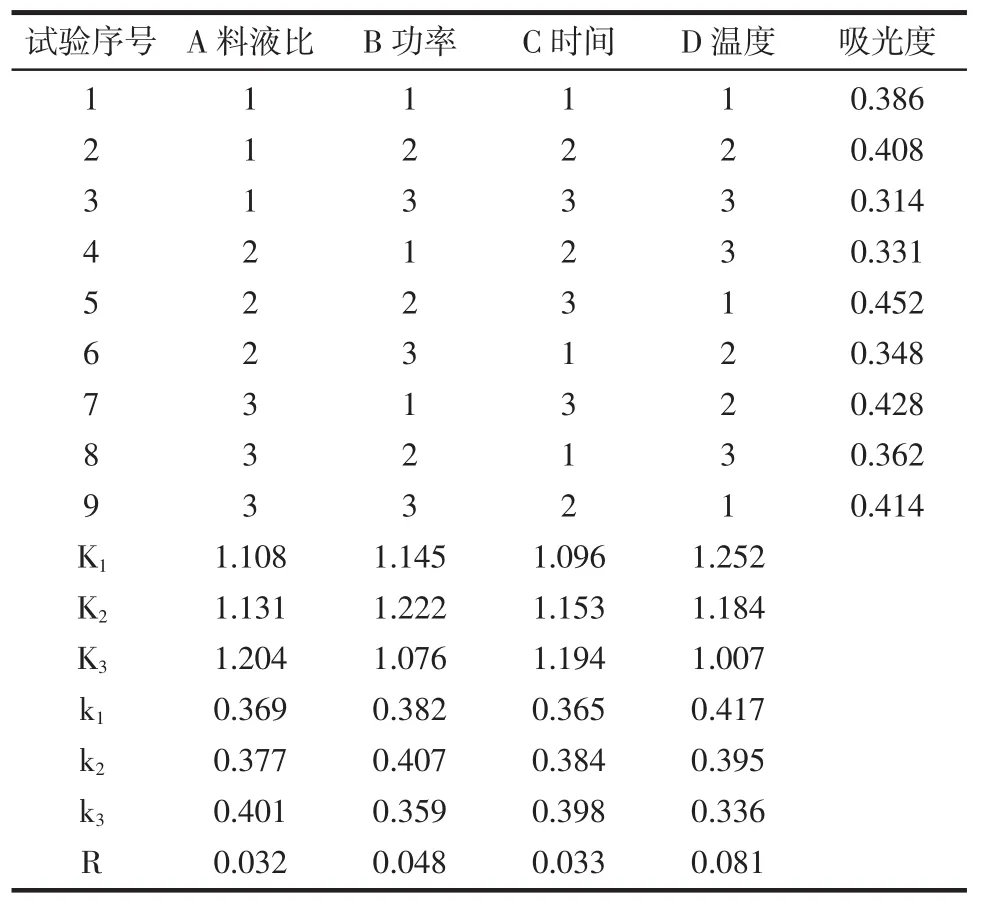
表3 正交设计极差分析结果Table 3Result of orthogonal design range analysis
由上表可知,料液比、功率、时间、温度为主要影响因子,这4个因素对蕨菜多糖的提取率影响因素显著,从正交的极差分析,可看出RD>RB>RC>RA,主次因素为D-B-C-A。从K值(直观分析)来看,D1>B2>C3>A3,所以可确定正交最优提取条件为A3B2C3D1,即:料液比1∶100(g/mL)、功率70%(420W)、时间50min、温度35℃。3.3超声波辅助提取多糖的验证试验
由于表3没有最优组合方案,故有必要对其做验证试验,以进一步确认正交试验的可行性。称取烘干的蕨菜粉3份,每份0.1 g,置于10 mL离心管内,按优选出的最佳生产工艺条件进行提取,于紫外分光光度计485 nm处测定吸光值,试验结果见表4。

表4 最佳工艺验证试验结果表Table 4Optimal process verification experiment results
由表4的试验结果可知,在最佳的提取工艺条件下,多糖的吸光度值为0.473,高于正交试验的最高水平(A2B2C3D1),其多糖的吸光度值为0.452。故最佳工艺验证试验成功,说明该提取工艺可靠且稳定。
3.4蕨菜多糖含量的测定结果
3.4.1标准曲线的绘制结果
标准曲线的绘制结果见图5。
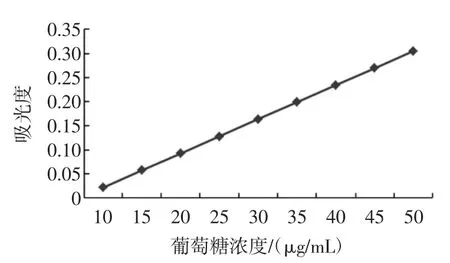
图5 葡萄糖标准曲线Fig.5The standard curve of glucose
求得回归方程为:A=0.007097X-0.05023,r=0.9990。
3.4.2多糖含量计算结果
将所测的吸光度均值0.473带入回归方程,求得蕨菜多糖含量为245.751 67 mg/g。
4结论与讨论
通过查阅文献及资料可知多糖类物质皆在485 nm处有最大吸收峰,故本试验都是采用485 nm来测其吸光度;通过单因素条件探索,初步得知蕨菜多糖的超声波辅助提取工艺。但是我们都知道,单因素试验考虑的因素比较单一,可信度不高,故设计了正交试验,通过对正交试验数据的极差以及方差处理分析,从而得出多糖的超声波辅助最佳提取工艺。然后通过利用0.500 0 mg/mL葡萄糖溶液配制的不同浓度对照品系溶液绘制的工作曲线求得回归方程A=0.007 097X-0.050 23,r=0.999 0;此步骤要求试验操作十分细致,所得r值须十分精确,不然会影响试验结果。之后通过蕨菜多糖超声波提取的最佳工艺提取样液作显色反应本试验以六盘水野生蕨菜为材料,通过单因素设计以及正交试验对蕨菜多糖超声波辅助提取的最佳工艺进行探索,并采用苯酚硫酸法对六盘水野生蕨菜多糖的含量进行测定。最终研究结果表明:蕨菜多糖的超声波辅助提取最佳工艺为料液比1∶100(g/mL)、功率70%(420 W)、时间50 min、温度35℃;蕨菜多糖的含量为245.751 67 mg/g。
后测得吸光度,3次重复试验后取吸光度均值带入回归方程,从而求得多糖浓度。
[1]章耀,郭衍银,王相友.野生蕨菜研究进展[J].长江蔬菜:学术版,2008,18(8):1-4
[2]黄劲松,何竞旻,刘延国,等.蕨菜研究进展综述[J].食品工业科技,2011,32(7):455-457
[3]韩宏义,白鹏,迟鹤.多糖的研究进展[J].农业科技与信息,2008,4(4):79-80
[4]余荣珍,柏华,王勤.信阳地区蕨菜的营养成分分析[J].信阳农业高等专科学校学报,2002,12(1):20-21
[5]刘建本,张克梅,易海峰.几种野菜部分营养元素的测定及营养价值[J].食品科学,1993,14(11):61-62
[6]文美,王文平.蕨菜系列休闲食品的开发[J].中国调味品,2002,286(12):7-11
[7]何佳奇,姚振生,熊耀康,等.苯酚-硫酸法测定麦冬须根中多糖的含量[J].中国中医药信息杂志,2006,13(10):51-52
[8]李妍,魏建和,许旭东.苯酚-硫酸法定量测定桔梗多糖的研究[J].时珍国医国药,2009,20(1):5-7
[9]马猛华,崔波,于海峰.苯酚-硫酸法测定玫瑰花渣中多糖含量的研究[J].山东轻工业学院学报,2008,22(4):23-25
[10]江萍,张倩,秦礼康,等.蕨菜多糖的提取及其对双歧杆菌生长的影响[J].山地农业生物学报,2001,20(3):223-225
[11]姚松君,黄生权,陈壮耀,等.超声辅助提取灵芝三萜的工艺研究[J].现代食品科技,2009,25(10):28-30
[12]许文涛,张方方,黄昆仑.响应曲面法优化蕨菜水溶性多糖提取工艺的研究[J].食品科学,2009,29(7):122-126
[13]夏海涛,刘玉芬,王蓉,等.花果山野生蕨菜多糖和黄酮的提取及含量测定[J].食品科学,2010,31(24):124-127
[14]谭萍,张萍,王玉珠,等.荞麦多糖的提取方法及含量测定[J].湖北农业科学,2008,47(8):954-956
[15]唐巧玉,朱玉昌,周毅峰.蕨菜中多糖的含量及其活性分析[J].食品工业,2008,2(2):21-22
[16]陈萍,路波,成东生.苦竹叶多糖定量分析方法[J].药物分析杂志,2006,26(3):319-321
[17]傅博强,谢明勇,聂少平.茶叶中多糖含量的测定[J].食品科学,2001,26(11):70-73
[18]李明元.真菌粗多糖测定方法的研究[J].食品研究与开发,2007,28(5):119-120
[19]刘丹.对多糖测定方法的探讨[J].四川文理学院学报(自然科学),2008,2(18):49-51
[20]吕玉光,杨丽敏.银耳多糖的含量测定[J].黑龙江医药科学,1999,22(6):32
Ultrasonic-assisted Extraction and Determination of Polysaccharide in Liu Panshui Wild Pteridium Revolutum
FANG Yu-mei,ZHANG Ping,WANG Yi-hong,TAN Ping,WANG Pan,ZHAO Jin-jun
(Liu Panshui Normal College,Shuicheng 553004,Guizhou,China)
Liu Panshui wild Pteridium revolutum as materials,the best technology of single factor and orthogonal experiment design of polysaccharides in Pteridium revolutum by ultrasonic-assisted extraction,and by phenol sulfuric acid method on the content of polysaccharide was determined in Liu Panshui wild Pteridium revolutum.The result showed that:the optimum ultrasonic-assisted extraction of polysaccharide in Pteridium revolutum as solid-liquid ratio was 1∶100(g/mL),power of 70%(420 W),extraction time was 50 min,temperature 35℃;content of polysaccharide in Pteridium revolutum was 245.751 67 mg/g.To provide theoreticalbasis for further development and utilization of Liu Panshui wild Pteridium revolutum.
pteridium revolutum;ultrasonic extraction-assisted;polysaccharide
10.3969/j.issn.1005-6521.2015.16.028
2014-06-04
六盘水师范学院自然科学科研计划(lpssy201204)
方玉梅(1982—),女,副教授,硕士研究生,从事植物生理学与分子生物学的教学与研究。

