不同磷酸氢二钠浓度对谷氨酸发酵的影响
臧传刚,梁恒宇,*,王宏龄,郝小明,王晓健,林海龙,陈博
(1.中粮营养健康研究院,北京100020;2.中粮生化能源(龙江)有限公司,黑龙江齐齐哈尔161100)
不同磷酸氢二钠浓度对谷氨酸发酵的影响
臧传刚1,梁恒宇1,*,王宏龄2,郝小明1,王晓健2,林海龙1,陈博1
(1.中粮营养健康研究院,北京100020;2.中粮生化能源(龙江)有限公司,黑龙江齐齐哈尔161100)
以谷氨酸工业菌株S9114为研究对象,在摇瓶培养条件下,研究不同浓度磷酸盐对谷氨酸发酵的影响,找到更适合该菌株产酸的磷酸氢二钠浓度范围,然后对该范围内磷酸氢二钠浓度谷氨酸发酵过程中主要指标进行动态研究。结果表明,2.095 mmol/L的磷酸氢二钠浓度与工业上普遍采用的磷酸氢二钠浓度6.280 mmol/L相比,生物量、谷氨酸产酸浓度和转化率均得到显著提高。
谷氨酸;磷酸氢二钠;谷氨酸棒杆菌;S9114;发酵
磷主要以正磷酸盐(Pi)、焦磷酸(PPi)或聚磷酸(polyPi)等无机化合物,以及核酸、磷酸糖、磷酸化蛋白和磷脂等有机磷形式存在于细胞内[1]。细胞中主要的含磷组分是DNA、RNA和polyPi等多聚化合物。但是,最易于细胞吸收的磷源是正磷酸盐。许多微生物进化出根据可利用磷源物质的实际情况而进行细胞代谢的调控机制[2]。例如,当培养环境中Pi足量时,微生物会大量生成polyPi。在微生物细胞内合成polyPi的关键酶是多聚磷酸激酶(PPK)。PPK催化ATP的末端磷酸残基连接到polyPi分子一端。而当Pi源不足时,PPK酶同样可以polyPi为底物,逆向反应生成ATP、GTP等含高能磷酸键物质[3]。
谷氨酸棒杆菌是一种革兰氏阳性短杆菌,其基因组具有较高的G+C含量。磷是谷氨酸棒杆菌细胞中主要组成元素之一,约占其细胞干重的1.5%~2.1%[1]。磷在谷氨酸棒杆菌中心碳代谢和能量代谢过程中扮演核心角色,这是因为许多酶反应,如3-磷酸甘油醛脱氢酶和F1F0-ATP合酶,需要以磷酸盐为底物[4]。而许多反应所需的关键酶活性受到磷浓度的调控,如磷酸果糖激酶、3-磷酸甘油酸激酶和丙酮酸激酶。同时,由底物磷酸化获得的自由能将贮存在由ADP和Pi合成的ATP中。此外,许多重要的细胞调控机制依靠磷元素,例如在双组分信号转导系统和丝氨酸/苏氨酸蛋白激酶的磷酸转移反应中[1]。
有关谷氨酸棒杆菌中磷代谢的研究起步较晚,在国内这方面的研究更为有限。培养条件中磷酸盐的浓度会显著影响谷氨酸棒杆菌的生长及基因的转录水平。谷氨酸棒杆菌磷(磷酸或磷酸盐)的半速率常数约为0.10 mmol/L[4]。在磷受限(0.10 mmol/L)和磷充足(13.00 mmol/L)的条件下,谷氨酸棒杆菌的转录组图谱明显不同[4]。磷在谷氨酸发酵生产中同样起着重要作用,但仅有少数研究对磷酸盐种类[5-6]和用量[7]对谷氨酸发酵的影响进行了优化。
本研究首先考察了不同磷酸盐浓度(从谷氨酸棒杆菌磷源受限浓度0.10 mmol/L到磷源充足浓度13.00 mmol/L)对谷氨酸发酵的影响,从中找到更适合谷氨酸发酵磷酸盐浓度的理想范围。然后对该浓度范围内磷酸盐对谷氨酸发酵影响与目前工业发酵所用浓度进行了动态比较研究。
1材料与方法
1.1菌株和试剂
谷氨酸生产菌株S9114:由中粮生化能源(龙江)有限公司味精生产部提供;葡萄糖、尿素、Na2HPO3· 12H2O、氯化钾、MgSO4·7H2O、MnSO4·H2O、(NH4)2SO4、苯酚红和氨水等均为分析纯:购自北京化工厂;玉米浆和糖蜜:由中粮生化能源(龙江)有限公司提供。
1.2培养基
1.2.1种子培养基
葡萄糖,0.222 mol/L(40g/L);(NH4)2SO4,0.114mol/L(约15g/L);Na2HPO3·12H2O,4.190 mmol/L;KCl,17.785 mmol/L;MgSO4·7H2O,2.029 mmol/L;玉米浆,8.3 mL/L;糖蜜,2.5 g/L;MnSO4·H2O,7.4×10-6mmol/L;用20%NaOH调节pH至7.2±0.20。分装30 mL于250 mL带挡板三角摇瓶中,121℃-15 min灭菌后冷却备用。
1.2.2发酵培养基
初步优化培养基:葡萄糖,0.444 mol/L(80 g/L);KCl,60.402mmol/L;MgSO4·7H2O,3.287mmol/L;玉米浆,560 μL/L;糖蜜,0.4 g/L;MnSO4·H2O,7.4×10-6mmol/L;在发酵培养基中分别添加0.100、0.628、2.095、4.190、6.280、8.380、13.000 mmol/L的Na2HPO3·12H2O;用浓度为25%的氨水将pH调至7.20±0.20。
生产验证培养基:葡萄糖,0.777 mol/L(140 g/L);KCl,60.402mmol/L;MgSO4·7H2O,3.287mmol/L;玉米浆,560μL/L;糖蜜,0.4g/L;MnSO4·H2O,7.4×10-6mmol/L;在发酵培养基中分别添加0.628、1.254、2.095、6.280 mmol/L的Na2HPO3·12H2O;用浓度为25%的氨水将pH调至7.20±0.20。
以上培养基吸取15 mL加入到250 mL带挡板的三角摇瓶内,121℃灭菌15 min后冷却备用。
1.3仪器与设备
PT-15型手持式数显pH计:德国Satorius;ZWY-2102C型恒温振荡摇床:上海智诚;SW-CJ-IFD型净化工作台:苏净安泰;SBA-40E型生物传感分析仪:山东济南;UV-1750型分光光度计:日本Shimadzu;Centrifuge 5418型高速离心机:德国Eppendorf;Milli-Q型超纯水分析仪:美国Millipore;CX31型显微镜:日本Olympus;9400V型超低温冰箱:美国Thermofisher;SX-700型全自动高压灭菌锅:日本Tomy。
1.4方法
1.4.1种子培养
从低温冰箱中取出一支S9114谷氨酸生产菌种冻存管,融化后将菌液加入灭菌后的种子培养基中。种子培养液于(32±0.5)℃下150 r/min振荡培养8 h,初始pH为7.20±0.20;在发酵过程中每隔2小时流加20 μL稀氨水(浓氨水∶水=1∶1)。
1.4.2发酵培养
将1.5 mL种子液加入无菌的2 mL离心管中,4 000 r/min离心5 min后去除上清液,再接种到初步优化培养基中,然后将摇瓶放在摇床中振荡培养,初始温度为32℃,初始转速为180 r/min,培养过程中不同发酵时间培养温度和转速设定见表1。

表1 不同发酵时间的发酵温度及摇床转速Table 1Fermentation temperature and shaker speed at different time
每隔1 h用精密pH试纸检测发酵液pH,并适当流加20%浓度的尿素溶液,以维持近中性的培养条件并增加氮源,直至培养24 h后至发酵终点。每组试验作2次重复,每次重复试验做2个平行。
将1.5 mL种子液接种到生产验证培养基中。然后将摇瓶放在摇床中振荡培养,初始温度为32℃,初始转速为180 r/min,随着发酵时间培养温度和转速不同设定见表1。每隔1 h用精密pH试纸检测发酵液pH,并适当流加20%浓度的尿素溶液,以维持近中性的培养条件并增加氮源,直至培养32 h后至发酵终点。每组试验作2次重复,每次重复试验做3个平行。
1.4.3OD值的测定
采用比浊法,样品稀释25倍后在620 nm条件下利用分光光度计进行测定。
1.4.4谷氨酸浓度的测定
采用生物传感分析仪法,样品稀释25倍后12 000 r/min离心5 min取上清测定。
1.4.5葡萄糖浓度的测定
采用生物传感分析仪法,样品稀释25倍后12 000 r/min离心5 min取上清测定。
1.4.6转化率的计算
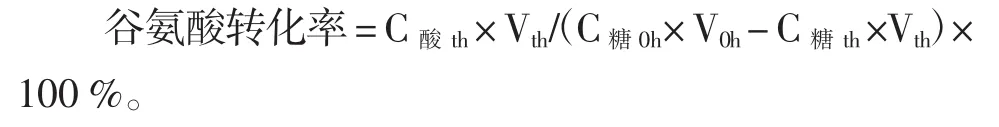
式中:C酸th为t小时时发酵液中谷氨酸的浓度;Vth为t小时时发酵液的体积;C糖0h为发酵液中初始葡萄糖浓度;V0h为发酵液的初始体积;C糖th为t小时时发酵液中葡萄糖的浓度。
1.4.7数据处理及统计分析
数据处理及ANOVA统计分析由SPSS 17.0软件完成。
2结果与分析
2.1不同浓度磷酸盐对谷氨酸发酵的影响
2.1.1不同浓度磷酸盐对OD值的影响
某种微生物磷的半速率常数指的是微生物比生长速率等于该微生物最大比生长速率一半时磷的浓度,即Monod常数。谷氨酸棒杆菌磷的半速率常数约为0.10 mmol/L[4]。不同浓度磷酸氢二钠对谷氨酸生产菌株OD值的影响见图1所示。

图1 不同试验组OD值的比较Fig.1Comparison of OD in different experimental groups
由图1可知,磷酸盐浓度为0.100 mmol/L时,谷氨酸棒杆菌生长受到显著抑制,与其他试验组OD值(OD24h=17.49±0.21)相比明显较低。随着磷元素浓度的增加,OD值起初呈现出逐渐增加的趋势,且在2.095 mmol/L试验组出现OD的峰值(OD24h=21.61± 0.51);但在4.190 mmol/L时,OD值出现了一个比较显著的下降,与磷添加量2.095 mmol/L试验组相比,其均值仅略高于磷元素0.100 mmol/L试验组;而6.280、8.380 mmol/L和13.000、2.095 mmol/L试验组出现峰值相比无统计学差异。以上结果表明磷的添加量过低会抑制生长,但OD的变化与磷的用量持续增长并不同步。
2.1.2不同浓度磷酸盐对葡萄糖消耗的影响
当摇瓶发酵培养基中含有0.444 mol/L(80 g/L)葡萄糖时,正常条件下24 h达到发酵终点,见图2。

图2 不同试验组葡萄糖消耗量的比较Fig.2Comparison of glucose consumptions in different experimental groups
从图2中可以看出,当发酵培养基中磷浓度为谷氨酸棒杆菌半速率常数0.100 mmol/L时,菌株的耗糖能力显著低于其他试验组,发酵到16 h和24 h时,培养基中还残存(55.86±1.07)g/L和(41.71±0.94)g/L的葡萄糖,这与不同磷酸浓度对尿素使用量的影响情况相对应(数据未列出);当发酵培养基中磷浓度为工业添加量的1/10(0.628 mmol/L)时,耗糖速率也低于除0.100 mmol/L的其他组,发酵16 h和24 h时,培养基中还残存(26.51±0.18)g/L和(4.28±0.41)g/L的葡萄糖;然而,当磷浓度为工业添加量的1/3(2.095 mmol/L)时,发酵16 h时培养基残存的葡萄糖浓度却显著低于其他所有试验组,为(14.25±0.43)g/L,与工业添加量试验组相比(17.67±1.54 g/L)低了3.00 g/L左右;发酵24 h后,除磷酸添加量为0.100 mmol/L的试验组外,其他试验组发酵液中葡萄糖基本耗尽,且均低于5 g/L。
2.1.3不同浓度磷酸盐对谷氨酸产量的影响
不同浓度磷酸盐对谷氨酸产量的影响见图3。

图3 不同试验组谷氨酸产量的比较Fig.3Comparison of glutamate productions in different experimental groups
如图3所示,与2.1.2中的试验结果相对应,糖耗速率快的试验组,其谷氨酸生成量较大。S9114菌株在磷酸氢二钠添加量为2.095 mmol/L时,发酵16 h和24 h时谷氨酸产量分别为(30.69±0.91)g/L和(38.10± 1.13)g/L,显著高于其他试验组。在磷元素受限浓度(0.100 mmol/L)实验条件下的谷氨酸产酸浓度不足或仅为最佳试验组的1/2,在16 h和24 h时分别为(9.69±0.27)g/L和(19.10±0.58)g/L。其他试验组发酵16 h和24 h结果均值虽不同,但相互间并无显著差异。
从以上试验结果我们发现,磷酸盐浓度受限不仅使谷氨酸棒杆菌生物量降低,同时也会影响糖耗及产酸。适当提高磷酸盐的浓度不仅促进菌株增殖,而且促进糖耗和产酸加速。然而,进一步增加磷酸盐的浓度并不能进一步提高谷氨酸的产量,反而会使糖耗和产酸有所下降,在生产上也会增加额外的生产成本。因此,选择0.628 mmol/L至2.095 mmol/L为最佳磷酸盐添加浓度,对其在工业发酵条件下产酸的动态与目前磷酸盐工业添加量(6.280 mmol/L)进行比较研究。
2.2不同磷酸盐浓度培养条件下谷氨酸发酵主要参数的动态变化
2.2.1不同磷酸盐浓度培养条件下OD值的动态变化
不同磷酸盐浓度培养条件下OD值的动态变化见图4。

图4 不同磷酸盐浓度条件下OD值的动态变化Fig.4Dynamic changes of OD values under different phosphate concentrations
图4展示了在含有不同浓度磷酸氢二钠的发酵培养基中,整个发酵过程中谷氨酸生产菌种OD值的变化。在发酵的前8 h,不同试验组生物量增长的趋势比较相似,但8h以后各试验组OD值的变化逐渐显现出差异。从图上看出发酵12 h后各试验组进入稳定期,OD值增长趋于平缓。与其他试验组相比,磷酸氢二钠添加量为2.095 mmol/L时OD值较大,而其他三组之间差异不显著。
2.2.2不同磷酸盐浓度培养条件下葡萄糖浓度的动态变化
不同磷酸盐浓度培养条件下葡萄糖浓度的动态变化见图5。

图5 不同磷酸盐浓度条件下葡萄糖浓度的动态变化Fig.5Dynamic changes of glucose concentrations under different phosphate concentrations
从图5中可以清晰看出,在谷氨酸发酵条件下,随着发酵时间的延长葡萄糖的浓度逐渐下降,但不同磷酸氢二钠的浓度会影响耗糖速率。与工业生产条件(6.280 mmol/L)相比,将磷酸氢二钠用量降低至1/3(2.095 mmol/L)可以从发酵中期(8 h后)提高耗糖速率。图5表明,在发酵的前16 h磷酸氢二钠1.254、2.095、6.280 mmol/L三个试验组葡萄糖浓度曲线无显著差别;20 h后1.254、2.095 mmol/L试验组的葡萄糖浓度开始显著低于工业对照组,但1.254 mmol/L试验组葡萄糖残留浓度高于2.095 mmol/L试验组;发酵28 h时1.254 mmol/L和2.095 mmol/L试验组的葡萄糖浓度已经降至(6.97±0.73)g/L和(1.37±0.26)g/L,显著低于对照组的(17.12±5.31)g/L;发酵32 h后,1.254 mmol/L和2.095 mmol/L试验组的葡萄糖已经耗尽,而对照组还残留(2.36±0.53)g/L残糖。
与1.254、2.095、6.280 mmol/L 3个试验组相比,将磷酸氢二钠的浓度降至工业对照组用量的1/10(0.628 mmol/L)却可以降低葡萄糖的糖耗速度,这一点从图中可以明显看出,直至32 h发酵终止时,该组仍残留(10.98±0.86)g/L葡萄糖。
2.2.3不同磷酸盐浓度培养条件下谷氨酸浓度的动态变化
在发酵的前4 h,谷氨酸浓度增长比较平稳;4 h后谷氨酸浓度开始快速增加,直至发酵结束,见图6。
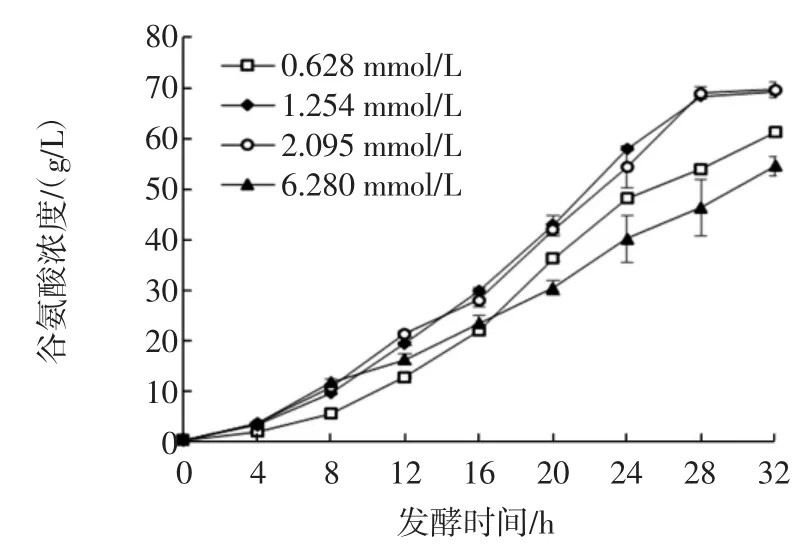
图6 不同磷酸盐浓度条件下谷氨酸浓度的动态变化Fig.6Dynamic changes of glutamate concentrations under different phosphate concentrations
由图6可知,发酵第8 h的统计数据表明,6.280 mmol/L试验组与2.095 mmol/L试验组无显著差异,却显著高于1.254 mmol/L试验组,三组谷氨酸浓度分别为(11.79±0.62)、(10.87±0.67)、(9.64±0.29)g/L;0.628 mmol/L试验组发酵8 h时谷氨酸浓度仅达到5.58g/L,显著低于其他3个试验组数据。而从12 h开始工业对照组(6.280 mmol/L)的产酸浓度开始显著低于1.254 mmol/L和2.095mmol/L试验组,甚至在20 h后工业对照组谷氨酸产酸浓度开始显著低于0.628 mmol/L试验组。以上结果表明,磷元素量的微弱变化可以对谷氨酸生产菌株S9114的谷氨酸产量造成较大的影响。目前所采用的磷酸盐浓度虽然在发酵初期有利于产酸,但从中后期开始,产酸能力却开始下降。32 h发酵结束后0.628、1.254、2.095、6.280 mmol/L试验组谷氨酸产酸浓度分别为(61.28±0.86)、(69.50±0.87)、(69.77±1.61)、(54.63±1.90)g/L。与原工业生产所采用的磷酸氢二钠浓度6.280 mmol/L相比,相对较低的磷酸氢二钠浓度可以将S9114产酸浓度提高20%以上。
2.2.4不同磷酸盐浓度培养条件下转化率的动态变化
不同磷酸盐浓度培养条件下转化率的动态变化见图7。

图7 不同磷酸盐浓度条件下转化率的动态变化Fig.7Dynamic changes of conversions of glucose to glutamate under different phosphate concentrations
通过图7可以看出,磷酸盐的添加量可以影响谷氨酸棒状杆菌S9114的谷氨酸转化率。随着发酵时间的延长,各试验组转化率持续增加,但增长情况有所差别。在发酵的前8 h转化率随着磷酸盐浓度的增大而增加,发酵8 h时磷酸氢二钠添加量为6.280、2.095、1.254、0.628 mmol/L 4个试验组谷氨酸转化率均值分别为20.75%、18.29%、15.92%和12.69%;但发酵12 h后,工业添加量试验组(6.280 mmol/L)转化率仅为21.45%,与8 h相比增长率急剧下降,其均值甚至低于0.628 mmol/L试验组(22.13%),此后工业对照组转化率虽仍然持续增长,但转化率均值始终显著低于其他三个试验组;与工业对照组相似,发酵16 h后,磷酸盐添加量为2.095 mmol/L的试验组转化率增量显著下降,显著低于1.254 mmol/L而略高于0.628 mmol/L试验组,此后添加量为2.095 mmol/L的试验组转化率始终低于1.254 mmol/L试验组;发酵20 h时,6.280、2.095、1.254和0.628 mmol/L 4个试验组谷氨酸转化率均值分别为30.46%、36.71%、41.00%和39.55%;发酵24 h时的趋势与20 h时一致;发酵28 h时,2.095、1.254、0.628 mmol/L3个试验组之间转化率差距进一步缩小,2.095 mmol/L试验组转化率均值略低于1.254 mmol/L试验组,但略高于0.628 mmol/L试验组;32 h发酵终止后,6.280、2.095、1.254、0.628 mmol/L 4个试验组谷氨酸转化率均值分别为40.28%、50.56%、50.36%和48.24%。
3结论与讨论
以生物素浓度亚适量为诱导谷氨酸高产的条件时,谷氨酸生产菌株在整个发酵过程中将经历两种明显不同的细胞形态,即生长型和产酸型。生长型菌体是粗壮的短杆状细胞。发酵7 h~10 h后,生物素处于贫乏状态,生长型细胞开始向产酸型细胞转变,此时细胞开始伸长、膨大,并伴随产酸速率逐渐增加。到发酵的12 h~20 h,生物素基本耗尽,完成了生长型细胞向产酸型细胞的转变,此时OD值稳定,谷氨酸产量仍持续增加直至发酵结束[8]。
在整个谷氨酸发酵过程中,磷源的量与菌体形变及生长速度有很大关系[9]。作为EMP途径的必须元素,磷与谷氨酸棒杆菌ATP的形成直接相关;而胞内ATP的周转速度和细胞能量水平决定了EMP途径中的葡萄糖消耗速率[10]。因此,在培养基中必需添加一定量的磷酸盐才能保证菌体的正常生长。
在磷元素充足(13 mmol/L)和不足(0.13 mmol/L)条件下,谷氨酸棒杆菌ATCC13032的生长速率分别为0.30 h-1和0.16 h-1[4]。在缺乏无机磷源时,微生物细胞中的Pi、ADP和ATP浓度会迅速下降,这会降低与糖酵解相关的酶活性和代谢流以及磷酸烯醇式丙酮酸的含量,进而导致葡萄糖消耗速率的降低[11]。与此同时谷氨酸棒杆菌胞内开始生成5'-核苷酸酶UshA,该酶以AMP和UDP-葡萄糖为唯一磷源维持菌体的生长[2]。这就会影响细胞的碳代谢及能量代谢。转录组学的研究表明,当磷源不足时谷氨酸棒杆菌细胞中有14个基因的转录水平显著下降,其中包括12个核糖体蛋白编码基因和1个转录起始因子基因[4]。这可以部分解释在磷元素浓度受限情况下,谷氨酸生产菌株耗糖较慢的原因。本研究中当磷元素为0.100 mmol/L时,葡萄糖消耗的情况与文献报道的情况基本相同。
发酵培养基中磷源的量不仅影响谷氨酸生产菌株的生长,而且影响谷氨酸的代谢[1]。磷源不足会严重抑制谷氨酸生产菌株的生长和产物代谢;但如果磷源过量,虽有利于糖代谢的进行,却会抑制6-磷酸葡萄糖脱氢酶的活性,将胞内代谢流转向合成缬氨酸的方向,从而降低谷氨酸产量[6]。因此,培养基中磷酸盐浓度适中是谷氨酸高产的重要条件之一。谷氨酸棒杆菌在胞内最高可以吸收600 mmol/L的磷,并以polyPi的形式将无机磷贮存于细胞内,以应对可能遇到的极端生存环境[12]。有研究表明过表达多聚磷酸合成关键基因ppnK可以显著提高赖氨酸产量[13]。但有报道称谷氨酸的产量与细胞中polyPi的含量并不相关[14]。
本研究表明,与谷氨酸发酵培养基原磷酸氢二钠添加量6.280 mmol/L相比,当摇瓶培养基中磷的浓度为1.254 mmol/L~2.095 mmol/L时更有利于谷氨酸生产菌株S9114的合成代谢,而2.095 mmol/L试验组最有利于菌株的生长。继续增加磷酸盐的浓度并不能提高谷氨酸的产量,甚至有些降低。尤其是在谷氨酸发酵的中后期,6.280 mmol/L磷酸氢二钠浓度在发酵8 h后产酸浓度和转化率开始低于其他试验组。这是否由于谷氨酸生产菌株胞内积累过多polyPi会影响胞内的电荷平衡,进而影响谷氨酸产量还需进一步研究。
[1]Liebl W.Handbook of Corynebacterium glutamicum[M].London: CRC Press,2005:9-34
[2]Rittmann D,Sorger-Herrmann U,Wendisch V F.Phosphate starvation-inducible gene ushA encodes a 5'nucleotidase required for growth of Corynebacterium glutamicum on media with nucleotides as the phosphorus source[J].Applied and environmental microbiology,2005,71(8):4339-4344
[3]Seufferheld M J,Alvarez H M,Farias M E.Role of polyphosphates in microbial adaptation to extreme environments[J].Applied and environmental microbiology,2008,74(19):5867-5874
[4]Ishige T,Krause M,Bott M,et al.The phosphate starvation stimulon of Corynebacterium glutamicum determined by DNA microarray analyses[J].Journal of bacteriology,2003,185(15):4519-4529
[5]白长胜,贺玉明,孙传钦,等.谷氨酸发酵培养基中磷酸盐替代可行性研究[J].中国调味品,2014,39(1):60-61
[6]田孝俊,张路军,任伟,等.三种磷酸盐在谷氨酸发酵中的应用分析[J].发酵科技通讯,2005,34(1):15-16
[7]刘利峰,于卫红.磷酸盐用量对谷氨酸发酵影响的研究[J].发酵科技通讯,2007,36(1):4
[8]康传利.L-谷氨酸产生菌的选育及其代谢调控[D].无锡:江南大学,2010:3-7
[9]Seibold G M,Eikmanns B J.Inactivation of the phosphoglucomutase gene pgm in Corynebacterium glutamicum affects cell shape and glycogen metabolism.Bioscience reports.2013,33(4):645-654
[10]胡小冰,林标声.磷对丙酮酸发酵生产影响作用研究[J].河南师范大学学报(自然科学版),2011,39(1):134-136
[11]Woo H M,Noack S,Seibold G M,Willbold S,Eikmanns B J,Bott M. Link between phosphate starvation and glycogen metabolism in Corynebacterium glutamicum,revealed by metabolomics[J].Applied and environmental microbiology,2010,76(20):6910-6919
[12]Lindner SN,Find all citations by this author(default).Orfilter your current search Vidaurre D,Find all citations by this author(default). Willbold S,Schoberth S M,Wendisch V F.NCgl2620 encodes a class II polyphosphate kinase in Corynebacterium glutamicum[J]. Applied and environmental microbiology,2007,73(15):5026-5033
[13]Lindner S N,Niederholtmeyer H,Schmitz K,et al.Polyphosphate/ ATP-dependent NAD kinase of Corynebacterium glutamicum:biochemical properties and impact of ppnK overexpression on lysine production[J].Applied microbiology and biotechnology,2010,87(2): 583-593
[14]Klauth P,Pallerla S R,Vidaurre D,et al.Determination of soluble and granular inorganic polyphosphate in Corynebacterium glutamicum[J].Applied microbiology and biotechnology,2006,72(5):1099-1106
Effects of Different Levels of Disodium Hydrogen Phosphate on Glutamate Fermentation
ZANG Chuan-gang1,LIANG Heng-yu1,*,WANG Hong-ling2,HAO Xiao-ming1,WANG Xiao-jian2,LIN Hai-long1,CHEN Bo1
(1.COFCO Nutrition&Health Research Institude,Beijing 100020,China;2.COFCO Bio-chemical Energy(Longjiang)CO.,Ltd.,Qiqihar 161100,Heilongjiang,China)
Under flask culture conditions,the effects of different phosphate concentrations on industrial strain S9114 glutamate fermentation were discussed in this work.A more suitable range of disodium hydrogen phosphate concentration for glutamate yield was developed,then the dynamics of major indexes during glutamate fermentation processes were compared.Results showed that the concentration of glutamate and conversion rates of glucose to glutamate had been improved significantly under 2.095 mmol/L disodium hydrogen phosphate condition compared with 6.280 mmol/L,level commonly used in industrial production.
glutamate;disodium hydrogen phosphate;Corynebacterium glutamicum;S9114;fermentation
10.3969/j.issn.1005-6521.2015.14.031
2014-06-05
国家973计划项目子课题(工业和环境微生物抗酸和抗高温元器件的构建与性能评估,2013CB733901);中粮集团技术开发研究项目(龙江生化谷氨酸棒杆菌生产水平的提升,2013-C2-T011)作者简介:臧传刚(1987—),男(汉),硕士,研究方向:生物化学与分子生物学。
梁恒宇(1980—),男(汉),工程师,博士,研究方向:食品生物技术、生物化工。

