绿豆酯酶的固定化条件优化
徐艳阳,吕燕婷,曾珊,于芮,付佳,李文强
(吉林大学生物与农业工程学院,吉林长春130022)
绿豆酯酶的固定化条件优化
徐艳阳,吕燕婷,曾珊,于芮,付佳,李文强
(吉林大学生物与农业工程学院,吉林长春130022)
为了探索绿豆酯酶的固定化方法,对阴离子交换树脂D261、D280、D301、D380酸碱处理后,通过离子交换吸附法来固定绿豆酯酶,筛选出固定效果较好的阴离子交换树脂D380,并进行固定化条件的优化研究。考查了固定化温度、固定化时间和粗酶液稀释倍数对固定化绿豆酯酶活力的影响,通过响应面法优化绿豆酯酶的固定条件。结果表明较佳的固定化条件为:粗酶液稀释25倍,固定化温度为30℃,固定化时间为3.0 h。实际测得固定化绿豆酯酶活力为0.825 1 U/g,与理论预测值相对误差为-1.7%,二者基本吻合。
绿豆;酯酶;阴离子交换吸附;固定化;响应面法
固定化酶是指在一定的空间范围内起催化作用,并能反复和连续使用的酶[1-2]。将酶固定化之后,既保持了酶的催化特性,又克服了游离酶的不足之处,使其具有回收反复使用的优点,并且在生产工艺上易于实现连续化和自动化[3]。因此,酶的固定化技术化学、生物技术、医学及生命科学等领域的研究异常活跃,在工业生产和分析检测方面也得到了迅速发展和广泛应用。
基于酶抑制技术的农药残留检测在有机磷农药检测方面得到了应用[4-8],使用的酶主要有乙酰胆碱酯酶、有机磷水解酶、植物酯酶等。其中乙酰胆碱酯酶主要来源于动物及昆虫,如马血、鸡血、猪血及苍蝇、棉铃虫等,但是动物体中胆碱酯酶含量少,因此较难获得、成本高。植物酯酶和乙酰胆碱酯酶具有相似的检测限,测量精密度较好,具有取材方便、酶源丰富、制备简单和成本低等优点,成为研究的热点。我国学者林素英、李建科和许学琴等[9-12]分别对植物酶源和固定化技术进行了研究。但对绿豆酯酶的固定化技术研究较少。所以本文对绿豆酯酶的固定化条件进行了优化研究。
1材料与方法
1.1试验材料
绿豆购于长春市远方超市,阴离子交换树脂D380、大孔弱碱性苯乙烯系阴离子交换树脂D301、大孔强碱性苯乙烯系阴离子交换树脂D280、大孔径强碱性阴离子交换树脂D261购于南开大学化工厂。
1.2仪器与设备
JB-2型恒温磁力搅拌器:上海雷磁新径仪器有限公司;JA3003A电子精密天平:上海精天电子仪器有限公司;HH数显恒温水浴锅:江苏金坛市金城固胜实验仪器厂;PB一10数字酸度计:SAI赛多利斯科学仪器(北京)有限公司;Fw177型中草药粉碎机:天津市泰斯特仪器有限公司;TDL一4A型台式低速离心机:上海菲恰尔分析仪器有限公司;T22N紫外可见分光光度计:上海精密科学仪器有限公司。
1.3方法
1.3.1绿豆酯酶的提取
准确称取绿豆粉碎样品5.00 g置于烧杯中,加入0.2 mol/L磷酸缓冲溶液25.0 mL,用磁力搅拌器搅拌30 min,静置12 h。然后用离心机以4 000 r/min离心20 min,取上清液于4℃条件下保存备用。
1.3.2绿豆酯酶的固定化条件
1.3.2.1树脂的处理
用去离子水浸泡树脂,使其充分溶胀,离心脱水。经过一定浓度的酸碱溶液处理后,用去离子水洗至中性,即得Cl-型交换树脂,加适量去离子水于4℃条件下贮存。
1.3.2.2固定化酯酶的单因素和响应面优化试验
分别选择不同粗酶液稀释倍数、固定化温度、固定化时间为因素,进行单因素试验研究。并根据单因素试验结果,以固定化酶活力为考指标,进行响应面法优化试验。
在试管中依次加入的不同稀释倍数10、20、30、40、50、60、80、100倍的粗酶液,按6∶1 mL/g液料比混合树脂,在30、40℃下,分别静置1、3、6、9、12、15、18 h后,用滤纸进行过滤,将固定化酶与酶液分开。用磷酸盐缓冲液对以上固定化酶洗涤8次,最后将其浸在缓冲液中即得固定化酶。
1.3.3试验指标及测定方法
1.3.3.1α-萘酚标准曲线的制作
将不同浓度的α-萘酚乙醇溶液与0.5 mL 0.08%固蓝B盐溶液混合,在波长595 nm处测定其吸光度。以α-萘酚溶液浓度为纵坐标、吸光度为横坐标作图,得到标准曲线的斜率为:

式(1)中:K为标准曲线的斜率;C1为α-萘酚溶液浓度,(μg/mL);A1为反应液在595 nm处的吸光度;n为标准曲线的浓度点数。
1.3.3.2总酯酶活力的测定
将50 μL 16 mmol/L α-乙酸萘酯乙醇溶液加入一定体积的稀释粗酶液中,混匀,在30℃恒温水浴中反应5 min。然后加入0.5 mL 0.08%固蓝B盐,同时做空白试验,在595 nm处测吸光度。总酯酶活力的计算式如下:

式(2)中:EA1为每毫升酶液所含的总酯酶活力,(U/mL);D为酶液的稀释倍数;OD595为在595 nm处测得的吸光度;kat为酶活力单位,1 U定义为在30℃下,1分钟内催化1 μmol α-萘酚所需的酶量。
1.3.3.3固定化酶活力的测定
称取适量的固定化酶,按1∶20(g/mL)加人磷酸盐缓冲溶液,再加人80 mmol/L α-乙酸萘酯乙醇溶液使其浓度达到0.4 mmol/L,混匀,在30℃的恒温水浴中反应5 min。在上述反应液中加入0.5 mL 0.08%固蓝B盐,同时做空白试验,在595 nm处测定吸光度。固定化酶活力的计算式为:
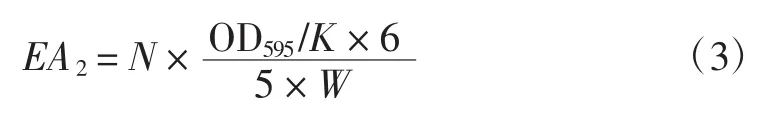
式(3)中:EA2为每克固定化酶所含的总酯酶活力(U/g);N为固定化树脂与缓冲溶液的比例;W为固定化酶质量,g。
1.3.3.4固定化酶回收率
固定化酶回收率的计算式如下:

式(4)中:ER为固定化酶回收率,%;W为固定化酶质量,g;E2为固定化酶活力,(U/g);V为粗酶液体积,mL;E1为粗酶液活力,(U/mL)。
2结果与分析
2.1树脂的选择
选择合适的树脂对于固定绿豆酯酶有较大的影响,本实验对阴离子交换树脂D380、D301、D280、D261 4种树脂分别进行绿豆酯酶的固定化实验并测定其酶活力,以选择出有较好固定化效果的树脂。
由表1可得知,当温度和稀释倍数固定时,4种树脂中D380固定的绿豆酯酶活力最高,因此,选择阴离子交换树脂D380的固定化效果较好。
2.2影响固定化酶活力的单因素试验
2.2.1酶液稀释倍数对固定化酶活力的影响
酶液稀释倍数是影响绿豆酯酶固定化的重要因素。当稀释倍数较小时,固定化酶活力较低,影响对有机磷农药残留量检测的灵敏度;当稀释倍数较大时,树脂上的结合位点趋向饱和,浪费大量的酶蛋白,不仅增加成本,还使酶活力下降。酶液稀释倍数对固定化酶活力的影响见图1。

表1 不同树脂固定化绿豆酯酶的活力Table 1Aactivy of immobilized mung bean esterase by different kinds of resins

图1 稀释倍数对固定化酶活力和回收率的影响Fig.1Effects of dilution times on the activity and recovery rate of immobilized enzyme
由图1可知,当酶液稀释倍数小于30时,固定化酶活力及其回收率随稀释倍数的增大而增大,当酶液稀释倍数大于30倍时,固定化酶活力及其回收率随稀释倍数的增大而减小,因此,当酶液稀释倍数为30倍时,固定化效果较佳。
2.2.2固定化温度对固定化酶活力的影响
酶反应对温度的变化非常敏感。当温度升高到一定程度后,会对蛋白质的空间结构产生破坏作用,从而使酶变性失活。固定化温度对固定化酶活力及其回收率的影响见图2。
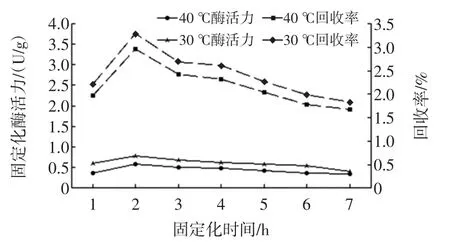
图2 固定化温度对固定化酶活力和回收率的影响Fig.2Effects of immobilized temperature on the activity and recovery rate of immobilized enzyme
由图2可知,固定化温度在30℃~40℃范围内,30℃时固定化酶活力比40℃时固定化酶活力高。
2.2.3固定化时间对固定化酶活力的影响
随着固定化时间的增加,固定化酶活力升高,且酶回收率增大。当达到一定时间后,酶活力增加缓慢,这可能是由于一方面树脂的结合位点接近饱和,另一方面可能是因为游离酶在磷酸盐缓冲溶液中放置过久使酶活力下降。固定化时间对固定化酶活力及其回收率的影响见图3。

图3 固定化时间对固定化酶活力和回收率的影响Fig.3Effects of immobilized time on the activity and recovery rate of immobilized enzyme
由图3可知,从1 h~3 h固定化酶活力及其回收率随吸附时间延长而增大,从3 h开始酶活力缓慢下降。由此可见,延长固定化时间不一定能够增加酶活力及其回收率。
2.3响应面法优化与分析
2.3.1响应面设计
在单因素试验的基础上,用Design-Expert8.05软件对各因素及水平进行设计,主要影响因素固定化温度、固定化时间和稀释倍数间分别用A、B、C表示,试验结果见表2和3。
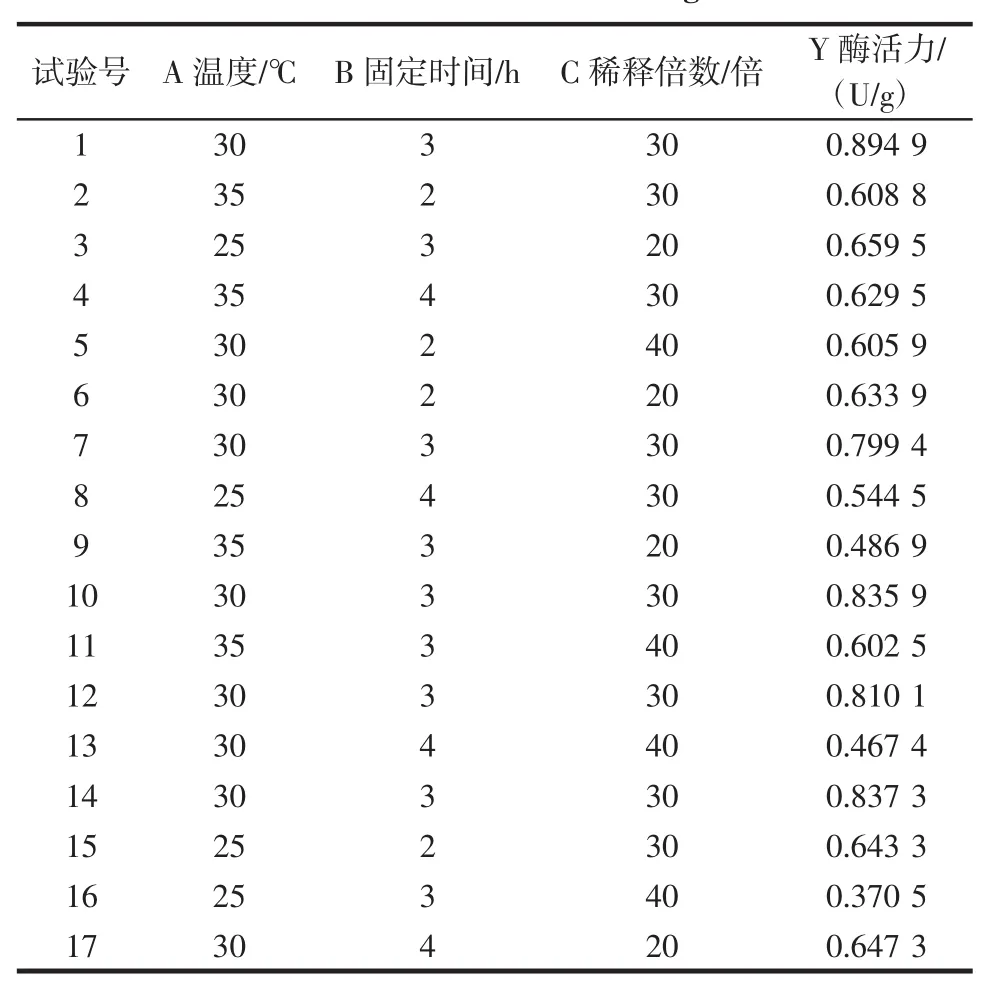
表2 BBD优化试验结果Table 2Results of BBD design

表3 二次回归模型的方差分析Table 3ANOVA for quadratic regression model
应用Design-Expert8.05软件对试验数据进行多元回归拟合,由各因素之间交互作用的显著性都在α= 0.05水平以下,得到固定化酶活力(y)与固定化温度(A)、固定时间(B)和稀释倍数(C)三因素的二次模拟模型:y=0.82+0.014×A-0.025×B-0.048×C+0.030×A×B+ 0.10×A×C-0.038×B×C-0.13×A2-0.076×B2-0.15×C2
从模型可以看出,影响绿豆酯酶固定的因素大小顺序为:稀释倍数>固定化时间>固定化温度。
由表2方差分析可以看出,上述二次模拟模型模型的R2=0.994 3,该模型有非常高的显著性(P<0.001)。失拟性在0.05水平以上不显著(P=0.727 6>0.05),表明该模型能够对固定化绿豆酯酶酶活力进行准确的预测和分析。调整确定系数为RAdj2=0.986 9,模型拟合程度良好,可以用来确定和预测绿豆酯酶固定化条件。
2.3.2响应曲面分析
根据回归方程来绘制交互作用较为明显的响应面立体分析图和等高线图,如图4、图5和图6。
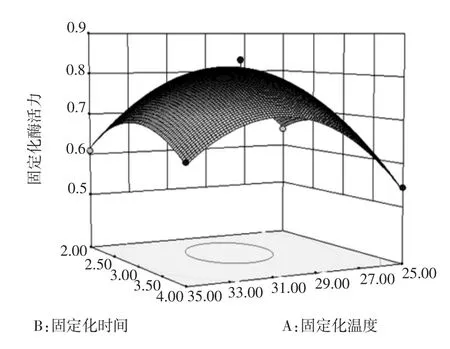
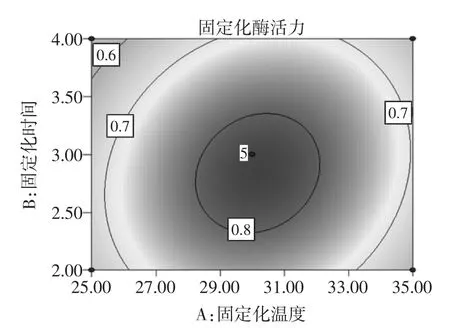
图4 固定化温度和固定化时间对固定化绿豆酯酶酶活力影响的响应面图和等高线图Fig.4Response surface and contour plots of activity of immobilized enzyme under the interaction between immobilized temperature and time

图5 固定化温度和稀释倍数度固定化绿豆酯酶酶活力影响的响应面图和等高线图Fig.5Response surface and contour plots of activity of immobilized enzyme under the interaction between immobilized temperature and dilution times

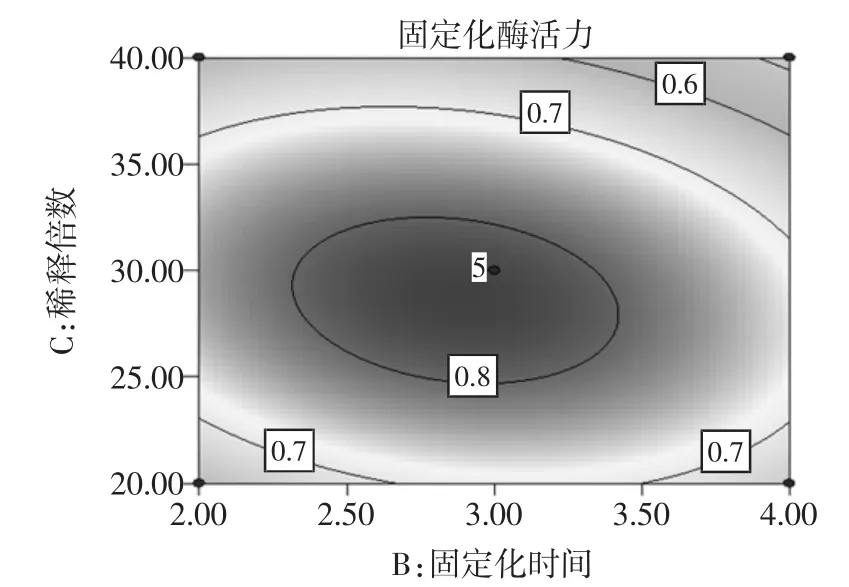
图6 固定化时间和稀释倍数度固定化绿豆酯酶酶活力影响的响应面图和等高线图Fig.6Response surface and contour plots of activity of immobilized enzyme under the interaction between immobilized time and dilution times
固定化温度、固定化时间和稀释倍数均对固定化绿豆酯酶的酶活力有显著的影响(P<0.05)。图4~图6直观地反映了各因素对响应值的影响,由等高线图可以看出存在极值的条件应该在近圆心处。由图4可知,固定化时间对固定化绿豆酯酶酶活力的影响比固定化温度大,表现为固定化时间所对应的曲线较固定化温度的曲线陡。由图4中等高线的形状可以确定这两个影响因素的较优水平范围为:固定化温度为28℃~32℃,固定化时间为2.3 h~3.2 h。
由图5可知,稀释倍数对固定化绿豆酯酶酶活力的影响比固定化温度大,表现为稀释倍数所对应的曲线较固定化温度对应的曲线陡。由图5中等高线的形状可以确定这两个影响因素的较优水平范围为:固定化温度为28℃~32℃,稀释倍数为22倍~34倍。
由图6可知,稀释倍数对固定化绿豆酯酶酶活力的影响比固定化时间大,表现为稀释倍数所对应的曲线较固定化时间对应的曲线陡。由图6中等高线的形状可以确定这两个影响因素的较优水平范围为:固定化时间为2.2 h~3.5 h,稀释倍数为25倍~32倍。
通过对y的回归系数的检验可知,各因素对固定化酶活力影响的大小顺序为稀释倍数>固定化时间>固定化温度。对函数进行分析得到其最大值点为A= 29.90℃、B=2.87 h、C=28.55,此时固定化酶活力最大,最大值为0.835 5 U/g,即最优绿豆酯酶固定化条件为固定化温度为29.90℃,固定化时间为2.87 h,稀释倍数28.55倍。
2.4验证试验
为检验响应面实验法的可靠性,按照最佳反应条件进行实验验证,重复3次,同时考虑到实际操作的便利,将绿豆酯酶固定化最佳条件调整为固定化温度30℃、固定化时间3.0 h,酶液稀释倍数为25倍。实际测得固定化绿豆酯酶活力为0.825 1 U/g,与模型理论预测值相比相对误差为-1.7%。因此,绿豆酯酶固定化采用响应面实验法优化得到的参数准确可靠,具有实用价值。
3结论
1)采用响应面法建立了固定化绿豆酯酶酶活力(y)与固定化温度(A)、固定时间(B)和稀释倍数(C)三因素的二次回归模型为:y=0.82+0.014×A-0.025×B-0.048×C+0.030×A×B+0.10×A×C-0.038×B×C-0.13×A2-0.076×B2-0.15×C2
绿豆酯酶固定化的影响因素大小顺序为:稀释倍数>固定化时间>固定化温度。
2)获得绿豆酯酶固定化的最佳工艺参数为:稀释倍数25倍,固定化温度为30℃,固定时间为3.0 h。
[1]许学勤,徐斐,吴燕雯,等.固定化对动植物酯酶性质的影响[J].食品与发酵工业,2004,30(7):38-42
[2]何国庆,丁立孝.食品酶学[M].北京:化学工业出版社,2006:3-5
[3]Aziz Amine,Hasna Mohammad,Ilhame Bourais,et al.Enzyme inhibition-based biosensors for food safety and environmental monitoring[J].Biosensors and Bioelectronics,2006,21:1405-1423
[4]黄志勇,袁园,吕禹泽.蔬菜中有机磷农药残留的两种酶抑制快速检测方法的比较研究[J].食品科学,2003(8):135-137
[5]温艳霞,兰文礼,李建科.大豆酯酶的分离、纯化及性质研究[J].食品科学,2008,29(5):292-294
[6]温艳霞,李建科,张晓敏,等.植物酯酶检测有机磷农药的敏感性和检测限的研究[J].食品科学,2006,27(9):186-188
[7]于基成,边辞,赵娜,等.酶抑制法快速检测蔬菜中有机磷农药残留[J].江苏农业科学,2006(5):170-172
[8]游金坤,余旭亚,赵鹏.吸附法固定化酶的研究进展[J].化学工程,2012,4,40(4):1-5
[9]林素英,林少琴.豆类酯酶的提取及其在有机磷农药检测中的应用[J].现代农业科学,2008,15(9):14-15
[10]许学勤,徐斐,华泽钊.用于有机磷农药残留快速检测的固定化小麦酯酶研究[J].食品科学,2003,24(5):122-126
[11]张开旺,雷勃钧,卢翠华,等.野生半野生栽培大豆及其小豆、绿豆的酯酶同工酶酶谱的比较研究[J].黑龙江农业科学,1985(3):52-54
[12]李建科,温艳霞,牛乐,等.一种大豆酯酶的制备方法:中国2005 10096207-4[P].2007-04-25
Optimination of Immobilization Conditions for Mung Bean Esterase
XU Yan-yang,LÜ Yan-ting,ZENG Shan,YU Rui,FU Jia,LI Wen-qiang
(College of Biological and Agricultural Engineering,Jilin University,Changchun 130022,Jilin,China)
To explore imobilization method of mung bean esterase,four types of anion exchange resins D261,D280,D301and D380 were treated using a given content acid and alkali solutions,and applied to imobilze mung bean esterase.Anion exchange resin D380 was better immobilization effect and its immobilization conditions were optimized.Based on single factor and response surface method experiments,immobilization conditions of mung bean esterase were investigated.Results showed that optimun immobilization conditions were a diluted 25 times of original enzyme solution,an immobilization temperature of 30℃,and an immobilization time of 3 hours.Under these conditions,imobilized mung bean esterase activity was 0.825 1 U/g,relative error between determined and predicted value was-1.7%,and tested and predicted value was similar basically.
mung bean;esterase;anion exchange adsorption;immobilization;response surface method
10.3969/j.issn.1005-6521.2015.14.032
2014-03-12
吉林大学大学生创新项目(2008AA100802)
徐艳阳(1972—),女(汉),副教授,博士,主要从事食品安全研究。

